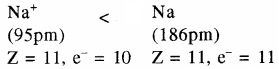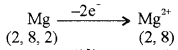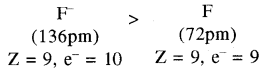हेलो स्टूडेंट्स, यहां हमने राजस्थान बोर्ड कक्षा 11वीं की रसायन विज्ञान सॉल्यूशंस को दिया हैं। यह solutions स्टूडेंट के परीक्षा में बहुत सहायक होंगे | Student RBSE solutions for Class 11 Chemistry Chapter 3 आवर्त सारणी pdf Download करे| RBSE solutions for Class 11 Chemistry Chapter 3 आवर्त सारणी notes will help you.
Table of Contents
Rajasthan Board RBSE Class 11 Chemistry Chapter 3 आवर्त सारणी
RBSE Class 11 Chemistry Chapter 3 पाठ्यपुस्तक के अभ्यास प्रश्न
RBSE Class 11 Chemistry Chapter 3 वस्तुनिष्ठ प्रश्न
प्रश्न 1.
मेंडलीव के आवर्त नियम का आधार था –
(अ) संयोजकता
(ब) परमाणु भार
(स) परमाणु क्रमांक
(द) परमाण्वीय आयतन
प्रश्न 2.
एक तत्त्व जिसका इलेक्ट्रॉनिक विन्यास [Ar] 3d24s2 है, किस ब्लॉक से सम्बन्धित है?
(अ) s – ब्लॉक
(ब) p – ब्लॉक
(स) d – ब्लॉक
(द) f – ब्लॉक
प्रश्न 3.
निम्नलिखित में से किस तत्त्व की आयनने एंथैल्पी सर्वाधिक है?
(अ) बोरॉन
(ब) कार्बन
(स) नाइट्रोजन
(द) ऑक्सीजन
प्रश्न 4. परमाणु क्रमांक 58 से 71 तक के तत्त्वों को कहते हैं –
(अ) संक्रमण तत्त्व
(ब) लैन्थेनॉयड
(स) एक्टिनॉयड
(द) क्षार धातु
प्रश्न 5.
किस आयन की त्रिज्या सर्वाधिक है?
(अ) F–
(ब) Cl–
(स) Br–
(द) I–
उत्तरमाला:
1. (ब)
2. (स)
3. (स)
4. (ब)
5. (द)
RBSE Class 11 Chemistry Chapter 3 अतिलघुत्तरात्मक प्रश्न
प्रश्न 1.
मेंडलीव के आवर्त नियम का आधार क्या था?
उत्तर:
मेंडलीव का आवर्त नियम परमाणु भार पर आधारित था।
प्रश्न 2.
आधुनिक आवर्त नियम का आधार क्या था?
उत्तर:
आधुनिक आवर्त नियम का आधार परमाणु क्रमांक था।
प्रश्न 3.
सत्रहवें वर्ग के सदस्यों को क्या कहते हैं?
उत्तर:
सत्रहवें वर्ग के सदस्यों को हैलोजन कहते हैं।
प्रश्न 4.
आवर्त सारणी के किन तत्त्वों में उपान्त्य कोश अपूर्ण होता है?
उत्तर:
आवर्त सारणी के संक्रमण तत्त्वों में उपान्त्य कोश अपूर्ण होता है।
प्रश्न 5.
4F श्रेणी में 14 तत्त्व क्यों होते हैं?
उत्तर:
4F उपकोश में 7 कक्षक होते हैं तथा एक कक्षक में दो इलेक्ट्रॉन भरे जाते हैं अतः 4F श्रेणी में 14 तत्त्व होते हैं। इसके अतिरिक्त d खण्ड में La57 तथा Hf72 के मध्य परमाणु क्रमांक में 14 का अन्तर है अतः इनके बीच 4F श्रेणी के 14 तत्त्व आते हैं।
प्रश्न 6.
परायूरेनियम तत्त्व किसे कहते हैं?
उत्तर:
(underset { 92 }{ U } ) के पश्चात् ((underset { 93 }{ { N }_{ p } } ) से) आने वाले सभी तत्त्व जो कि अस्थायी होते हैं (कृत्रिम तत्त्व) को परायूरेनियम तत्त्व कहते हैं।
प्रश्न 7.
120 परमाणु क्रमांक वाले तत्त्व का IUPAC नाम तथा प्रतीक क्या होगा?
उत्तर:
IUPAC के नियम के अनुसार 1, 2 तथा 0 अंकों के लिए मूल (root) क्रमशः un, bi तथा nil होंगे। अतः 120 परमाणुक्रमांक वाले तत्त्व का नाम Unbinilium तथा प्रतीक Ubn होगा।
प्रश्न 8.
तत्त्व × वर्ग 15 के प्रथम स्थान पर स्थित है। इस तत्त्व का बाह्यतम इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
वर्ग 15 का बाह्यतम इलेक्ट्रॉनिक विन्यास ns2np3 होता है अतः इसके प्रथम तत्त्व (n = 2) का बाह्यतम इलेक्ट्रॉनिक विन्यास 2s22p3 होगा।
प्रश्न 9.
मेंडलीव आवर्त सारणी की कोई दो कमियाँ लिखिए।
उत्तर:
मेंडलीव की आवर्त सारणी में हाइड्रोजन की स्थिति निश्चित नहीं है तथा इसमें समस्थानिकों के लिए कोई स्थान नहीं है।
प्रश्न 10.
आधुनिक आवर्त सारणी की कोई दो कमियाँ लिखिए।
उत्तर:
आधुनिक आवर्त सारणी में लैन्थेनॉयडों तथा एक्टिनॉयडों को स्थान नहीं दिया जा सका तथा लगभग समान गुणों वाले तत्वों को पृथक्-पृथक् वर्गों में रखा गया। जैसे – Ba व Pb
प्रश्न 11.
Uub तत्त्व का परमाणु क्रमांक लिखिए।
उत्तर:
Uub तत्त्व का परमाणु क्रमांक 112 होगा क्योंकि U = un = 1, u = un = 1 तथा b = bi = 2
प्रश्न 12.
आवर्त के किस सदस्य का आकार सबसे बड़ा होता हैं?
उत्तर:
आवर्त सारणी के किसी आवर्त में क्षार धातु का आकार सबसे बड़ा होता है।
प्रश्न 13.
S2-, Cl–, Ar, K+, Ca2+, Sc3+ को आकार के बढ़ते क्रम में व्यवस्थित कीजिए।
उत्तर:
Sc3+ < Ca2+ < K+ < Ar < Cl– < S2- (आकार का बढ़ता क्रम-समइलेक्ट्रॉनीय श्रेणी)।
प्रश्न 14.
वान्डरवाल्स त्रिज्या किसे कहते हैं?
उत्तर:
किसी तत्त्व के दो अणुओं के पास स्थित अबन्धित परमाणुओं के नाभिकों के बीच की दूरी का आधा, वान्डरवाल्स त्रिज्या कहलाता है।
प्रश्न 15.
Na+, Mg2+ तथा Al3+ आयन में किसकी आयनिक त्रिज्या सबसे छोटी है?
उत्तर:
Na+, Mg2+ तथा Al3+ आयनों में से Al3+ की आयनिक त्रिज्या सबसे छोटी है क्योंकि इसमें नाभिकीय आवेश अधिक होने के कारण नाभिकीय आकर्षण बल अधिक होगा।
प्रश्न 16.
उदासीन जनक परमाणु तथा धनायन में से किसकी त्रिज्या छोटी होती है?
उत्तर:
उदासीन जनक परमाणु तथा धनायन में से धनायन की त्रिज्या छोटी होती है।
प्रश्न 17.
आवर्त में बाईं से दाईं ओर जाने पर आयनन एंथैल्पी का मान किस प्रकार परिवर्तित होता है?
उत्तर:
आवर्त में बाईं से दाईं ओर जाने पर आयनन एंथैल्पी का मान बढ़ता है क्योंकि परमाणु त्रिज्या में कमी होती है।
प्रश्न 18.
क्षार धातुओं में किस तत्त्व की आयनन एंथैल्पी सबसे कम होती है?
उत्तर:
क्षार धातुओं में Cs (सीजियम) की आयनन एंथैल्पी सबसे कम होती है क्योंकि इसकी परमाणु त्रिज्या सबसे अधिक होती है।
प्रश्न 19.
आवर्त सारणी में सबसे अधिक इलेक्ट्रॉन लब्धि एंथैल्पी वाला तत्त्व कौनसा है?
उत्तर:
आवर्त सारणी में सबसे अधिक इलेक्ट्रॉन लब्धि एंथैल्पी, क्लोरीन (Cl) की होती है, लेकिन यह ऋणात्मक होती है।
प्रश्न 20.
Na तथा Mg में से किस तत्त्व की द्वितीय आयनन एंथैल्पी अधिक है?
उत्तर:
Na तथा Mg में से Na की द्वितीय आयनन एंथैल्पी का मान अधिक होता है।
प्रश्न 21.
आवर्त सारणी में सबसे अधिक विद्युतऋणात्मकता वाला तत्त्व कौनसा है?
उत्तर:
आवर्त सारणी में सबसे अधिक विद्युतऋणात्मकता वाला तत्त्व फ्लुओरीन (F) है।
प्रश्न 22.
विद्युतऋणात्मकता के परिकलन में पॉलिंग एवं मुलिकन मापक्रम में क्या सम्बन्ध है?
उत्तर: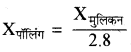
प्रश्न 23.
प्रतिशत आयनिक लक्षण परिकलित करने का सूत्र लिखिए।
उत्तर:
बन्ध में प्रतिशत आयनिक लक्षण
= 16(XA – XB) + 3.5 (XA – XB)2
XA व XB = तत्त्व A व B की विद्युतऋणता
प्रश्न 24.
संयोजकता किसे कहते हैं?
उत्तर:
किसी तत्त्व का एक परमाणु हाइड्रोजन या अन्य किसी एक संयोजी तत्त्व के जितने परमाणुओं से संयोग करता है अथवा कोई परमाणु जितने बन्ध बनाता है, उसे तत्त्व की संयोजकता कहते हैं।
प्रश्न 25.
क्षारीय मृदा धातुओं की संयोजकता कितनी होती है?
उत्तर:
क्षारीय मृदा धातुओं की संयोजकता 2 (दो) होती है।
RBSE Class 11 Chemistry Chapter 3 लघूत्तरात्मक प्रश्न
प्रश्न 26.
तत्त्वों के वर्गीकरण की आवश्यकता क्यों महसूस हुई?
उत्तर:
तत्त्वों की अधिक संख्या तथा इनके असंख्य यौगिकों के रसायन का अलग-अलग अध्ययन करना बहुत मुश्किल था अतः वैज्ञानिकों ने तत्त्वों का वर्गीकरण किया तथा इनके ज्ञान को संघटित किया ताकि इनका अध्ययन आसानी से किया जा सके। इस तरीके से सभी तत्त्वों से संबंधित रासायनिक तथ्यों को तर्कसंगत किया जा सकेगा तथा भविष्य में खोजे जाने वाले अन्य तत्त्वों का अध्ययन भी आसान हो सकेगा।
प्रश्न 27.
संक्रमण श्रेणी में बाईं से दाईं ओर जाने पर आकार में बहुत कम परिवर्तन होता है, क्यों?
उत्तर:
संक्रमण श्रेणी में बाईं से दाईं ओर जाने पर आकार में बहुत कम परिवर्तन होता है क्योंकि इलेक्ट्रॉन उपान्त्य [(n – 1)d] कोश में भरते हैं जिनका परिरक्षण प्रभाव, नाभिकीय आकर्षण बल को काफी हद तक संतुलित कर देता है।
प्रश्न 28.
ऋणायन का आकार सदैव जनक परमाणु से बड़ा होता है, क्यों?
उत्तर:
ऋणायन बनने पर इलेक्ट्रॉनों की संख्या बढ़ जाती है। जबकि नाभिकीय आवेश (प्रोटॉनों की संख्या) समान रहता है, इलेक्ट्रॉनों के मध्य प्रतिकर्षण बढ़ता है अतः नाभिकीय आकर्षण बल पहले की तुलना में कम हो जाता है इसलिए ऋणायन का आकार सदैव जनक परमाणु से बड़ा होता है।
प्रश्न 29.
Na से Na+ की अपेक्षा Cs से Cs+ अधिक सरलता से प्राप्त होता है, क्यों?
उत्तर:
वर्ग में ऊपर से नीचे जाने पर परमाणु आकार बढ़ता है। अतः आयनन एन्थैल्पी का मान कम होता है। Na की तुलना में Cs का परमाणु आकार बहुत अधिक होता है अतः इसकी आयनन एन्थैल्पी का मान भी Na की तुलना में बहुत कम होता है इसलिए इसमें से इलेक्ट्रॉन आसानी से निकल जाता है। इसी कारण Na से Na+ की अपेक्षा, Cs से Cs+ प्राप्त होना अधिक आसान है।
प्रश्न 30.
Na2O क्षारीय है जबकि Cl2O7 अम्लीय। कारण सहित स्पष्ट कीजिए।
उत्तर:
आवर्त में बाईं से दाईं ओर जाने पर तत्त्वों के ऑक्साइडों की अम्लीय प्रकृति बढ़ती है क्योंकि तत्त्व की विद्युतऋणता बढ़ती है, जिससे ऑक्सीजन तथा तत्त्व की विद्युतऋणता में अन्तर कम होता है। तथा Na2O जल से अभिक्रिया करके प्रबल क्षार बनाता है, जबकि Cl2O7 प्रबल अम्ल बनाता है। अतः Na2O एक क्षारीय तथा Cl2O7 एक अम्लीय ऑक्साइड है।
2Na + H2O → 2NaOH (सोडियम हाइड्रॉक्साइड)
Cl2O7 + H2O → 2HClO4 (परक्लोरिक अम्ल)
प्रश्न 31.
क्षारीय धातु द्विधनावेशित आयन क्यों नहीं बनाते हैं?
उत्तर:
प्रथम वर्ग के तत्त्वों (क्षारीय धातु) के लिए II तथा I आयनन एन्थैल्पी मानों का अन्तर 16ev से अधिक होता है, अतः इनकी निम्न ऑक्सीकरण अवस्था स्थायी होती अर्थात् ये M+1 (एक धनावेशित आयन) बनाते हैं न कि M+2 (द्विधनावेशित आयन)।
प्रश्न 32.
उत्कृष्ट गैस की आयनन एंथैल्पी अत्यधिक उच्च होती है। कारण सहित स्पष्ट कीजिए।
उत्तर:
उत्कृष्ट गैसों में पूर्ण पूरित कोश स्थायी विन्यास (ns2np6) होता है अर्थात् इनका अष्टक पूर्ण होता है जिसमें से इलेक्ट्रॉन निकालने के लिए बहुत अधिक ऊर्जा की आवश्यकता होती है, अतः उत्कृष्ट गैसों की आयनन एन्थैल्पी अत्यधिक उच्च होती है।
प्रश्न 33.
नाइट्रोजन की आयनन एंथैल्पी ऑक्सीजन से अधिक होती है, क्यों?
उत्तर:
नाइट्रोजन में अर्धपूरित (2p3) विन्यास होता है, जो कि स्थायी होता है जबकि ऑक्सीजन का विन्यास 2p4 होता है जो कि कम स्थायी होता है, इसलिए नाइट्रोजन के अर्धपूरित स्थायी विन्यास में से इलेक्ट्रॉन निकालने के लिए अधिक ऊर्जा की आवश्यकता होती है। इसी कारण नाइट्रोजन की आयनन एन्थैल्पी ऑक्सीजन की आयनन एन्थैल्पी से अधिक होती है।
प्रश्न 34.
क्षारीय मृदा धातु परिवर्तनशील ऑक्सीकरण अवस्था प्रदर्शित नहीं करते, क्यों?
उत्तर:
क्षारीय मृदा धातुओं (द्वितीय वर्ग के तत्त्व) के लिए II तथा I आयनन एन्थैल्पी मानों का अन्तर 11 ev से कम होता है। अतः इनमें उच्च ऑक्सीजन अवस्था स्थायी होती है अर्थात् ये सीधे ही + 2 ऑक्सीकरण अवस्था बनाती है न कि + 1 तथा + 2 अवस्था में उत्कृष्ट गैसों के समान स्थायी विन्यास प्राप्त हो जाता है अतः इनमें + 3 अवस्था भी नहीं बनती अतः क्षारीय मृदा धातु परिवर्तनशील ऑक्सीकरण अवस्था प्रदर्शित नहीं करते।
प्रश्न 35.
NaOH क्षार है जबकि HOCl अम्ल। कारण सहित स्पष्ट कीजिए।
उत्तर:
Na की आयनन एन्थैल्पी कम होने के कारण यह आसानी से इलेक्ट्रॉन दे देता है अतः जलीय विलयन में NaOH के आयनन से Na+ तथा OH– आसानी से प्राप्त हो जाते हैं इसलिए यह एक क्षार है, जबकि ClOH में Cl की आयनन एन्थैल्पी उच्च होने के कारण यह इलेक्ट्रॉन देकर OH– नहीं बनाता अतः इसके जलीय विलयन में H+ तथा O–Cl बनाते हैं इसलिए यह एक अम्ल होता है। तथा इसे हाइपोक्लोरस अम्ल कहते हैं।
प्रश्न 36.
CsF बंध में आयनिक लक्षण की प्रतिशतता को परिकलन कीजिए। Cs एवं F की विद्युतऋणताएँ क्रमशः 0.7 तथा 4.0 हैं।
उत्तर:
CsF में बन्ध का % आयनिक गुण
= 16∆ + 3.5∆2
= 16(XA – XB) + 3.5 (XA – XB)2
∆ = विद्युत ऋणतन में अन्तर
= XA – XB = 4.0 – 0.7 = 3.3
अतः बन्ध का % आयनिक गुण
= (16 × 3.3) + [3.5 (3.3)2]
= 52.8 + 3.5 × 10.89
= 52.8 + 38.1
= 90.9%
प्रश्न 37.
कारण सहित समझाइए कि F की इलेक्ट्रॉनिक बंधुता क्लोरीन से कम होती है।
उत्तर:
क्लोरीन की इलेक्ट्रॉन बन्धुता, F की इलेक्ट्रॉन बन्धुता से अधिक होती है क्योंकि F के छोटे आकार (n = 2) तथा इलेक्ट्रॉनों के उच्च आवेश घनत्व के कारण जुड़ने वाला इलेक्ट्रॉन, प्रबल इलेक्ट्रॉन – इलेक्ट्रॉन प्रतिकर्षण अनुभव करता है। अतः इसमें इलेक्ट्रॉन जुड़ना मुश्किल होता है जबकि Cl का आकार बड़ा (n = 3) होने के कारण इसमें इलेक्ट्रॉन जुड़ना आसान होता है।
प्रश्न 38.
बोरॉन की आयनन एन्थैल्पी बेरिलियम से कम होती है। कारण सहित समझाइए।
उत्तर:
Be (2s2) में अन्तिम इलेक्ट्रॉन s कक्षक में से निकलता है जो कि पूर्ण भरा है तथा इसकी ऊर्जा 2p से कम है अतः यह अधिक स्थायी है एवं यह p कक्षक की तुलना में नाभिक के अधिक पास है। (भेदन क्षमता अधिक) अतः इसमें से इलेक्ट्रॉन निकालने के लिए अधिक ऊर्जा की आवश्यकता होती है जबकि B (2p1) का p इलेक्ट्रॉन आसानी से निकल जाता है। इसलिए B की आयनन एन्थैल्पी, Be की आयनन एन्थैल्पी से कम होती है।
प्रश्न 39.
ऑक्सीजन की द्वितीय इलेक्ट्रॉन बंधुता का मान उच्च होता है। कारण सहित स्पष्ट कीजिए।
उत्तर:
जब किसी उदासीन परमाणु में एक इलेक्ट्रॉन जुड़कर ऋणायन बनता है तो ऊर्जा मुक्त होती है लेकिन जब दूसरा इलेक्ट्रॉन जुड़ता है तो ऊर्जा का अवशोषण होता है क्योंकि जुड़ने वाले इलेक्ट्रॉन तथा ऋणायन के इलेक्ट्रॉन के मध्य प्रतिकर्षण होता है। इसी कारण ऑक्सीजन की द्वितीय इलेक्ट्रॉन बन्धुता का मान उच्च होता है।
O(g) + e → O–(g) + 141 kJ mol-1
O–(g) + e → O2-(g) 844 kJ mol-1
प्रश्न 40.
NH3 का बंध कोण NF3 से अधिक होता है। कारण सहित स्पष्ट कीजिए।
उत्तर:
अणु ABx में B की विद्युतऋणता कम होने पर बन्ध कोण बढ़ता है। चूंकि NH3 में H की विद्युतऋणता NF3 के F से कम है अतः NH3 का बन्ध कोण NF3 से अधिक होता है।
RBSE Class 11 Chemistry Chapter 3 निबन्धात्मक प्रश्न
प्रश्न 41.
आवर्त सारणी के दीर्घ स्वरूप पर एक टिप्पणी लिखिए। इस स्वरूप के विभिन्न अभिलक्षणों का विवेचन कीजिए। इसकी क्या – क्या कमियाँ हैं?
उत्तर:
आवर्त सारणी का आधुनिक/दीर्घ रूप तत्त्वों को उनके परमाणु क्रमांक के बढ़ते क्रम में व्यवस्थित करने पर प्राप्त सारणी को आधुनिक आवर्त सारणी कहा गया। आवर्त सारणी का यह रूप मेंडलीव की आवर्त सारणी की तुलना में ज्यादा विस्तृत है, इसीलिए इसे आवर्त सारणी का दीर्घ स्वरूप भी कहते हैं। यह सारणी बोर द्वारा दी गयी।
आवर्त सारणी के दीर्घ स्वरूप में क्षैतिज पंक्तियों को आवर्त (period) तथा ऊर्ध्वाधर स्तम्भों को वर्ग (group) कहते हैं। इसमें समान बाह्यतम इलेक्ट्रॉन विन्यास वाले तत्त्वों को समान वर्ग (परिवार) में रखा जाता है। आवर्त सारणी में कुल सात आवर्त हैं। आवर्त संख्या, आवर्त में तत्त्व की अधिकतम मुख्य क्वान्टम संख्या (n) होती है। प्रथम से षष्ठम आवर्त में तत्त्वों की संख्या क्रमशः 2, 8, 8, 18, 18 तथा 32 है लेकिन सातवाँ आवर्त अपूर्ण है। छठे तथा सातवें आवर्त के लैन्थेनॉयड एवं एक्टिनॉयड तत्त्वों (14 + 14) को आवर्त सारणी के नीचे अलग से रखा गया है।
IUPAC द्वारा वर्गों के नाम की पुरानी पद्धति IA……. VII A, VIII तथा IB ……… VIIB के स्थान पर नया वर्गीकरण दिया गया है जिसके अनुसार वर्ग संख्या 1 से 18 दी जाती है। अतः आधुनिक आवर्त सारणी में वर्गों की कुल संख्या 18 होती है।

आधुनिक आवर्त सारणी की विशेषताएँ तथा महत्त्वपूर्ण बिन्दु –
- यह आवर्त सारणी परमाणु क्रमांक पर आधारित है। किसी उदासीन परमाणु में इलेक्ट्रॉनों की संख्या परमाणु क्रमांक के बराबर होती है अतः किसी तत्त्व की आवर्त सारणी में स्थिति इलेक्ट्रॉनिक विन्यास के आधार पर निर्धारित होती है तथा तत्त्वों के गुण इलेक्ट्रॉनिक विन्यास पर ही निर्भर करते हैं।
- इस आवर्त सारणी में धातुओं तथा अधातुओं को पूर्ण रूप से पृथक् कर दिया गया है। वर्ग संख्या 1 से 12 तक के तत्त्व धातु तथा वर्ग संख्या 13 से 18 तक के तत्त्वों में धातु, उपधातु तथा अधातु होते हैं। B,
Si, As, Te व At के नीचे खींची गयी सीढ़ीनुमा रेखा, आवर्त सारणी को धातुओं (बाएँ) तथा अधातुओं (दाएँ) में विभाजित करती है। - उत्कृष्ट गैसों (अक्रिय गैसों) में उपकोश पूर्ण हो जाता है। अतः इन्हें आवर्त सारणी के अन्त में 18वें वर्ग में रखा गया है।
- समस्थानिकों तथा समभारिकों की स्थिति की समस्या समाप्त हो गयी है।
- मेंडलीव की आवर्त सारणी के एक ही वर्ग के उपवर्गों को अलग – अलग स्थान देने से विभिन्न गुणों वाले तत्त्व एक वर्ग में न रहकर भिन्न – भिन्न वर्गों में चले गए हैं।
- मेंडलीव की आवर्त सारणी में समान गुणों वाले तत्त्वों को एक ही वर्ग में रखने के लिए परमाणु भार के बढ़ते क्रम में व्यवधान उत्पन्न हो गया था लेकिन परमाणु क्रमांक के बढ़ते क्रम के कारण ये स्वतः ही उस क्रम में आ जाते हैं।
- इस आवर्त सारणी से तत्त्वों के इलेक्ट्रॉनिक विन्यास को आसानी से समझा जा सकता है।
- मेंडलीव की आवर्त सारणी में परमाणु भार के आरोही क्रम का पालन नहीं करने वाले तत्त्व जैसे (Ar, K) (Co, Ni) तथा (Te, I) स्वतः ही परमाणु क्रमांक के बढ़ते क्रम का पालन करते हैं।
- प्रथम आवर्त को लघुतम (2 तत्त्व), द्वितीय एवं तृतीय आवर्त को लघु (8, 8 तत्त्व), चतुर्थ व पंचम आवर्त को दीर्घ (18, 18 तत्त्व) तथा षष्ठम आवर्त को दीर्घतम आवर्त (32 तत्त्व) कहा जाता है। सप्तम
आवर्त अभी अपूर्ण है। - वर्ग संख्या 1, 2 व 12 से 17 के तत्त्वों को प्रसामान्य तत्त्व (Normal Elements) या प्रतिनिधि तत्त्व (Representative Elements) कहा जाता है।
- वर्ग संख्या 3 से 11 तक के तत्त्वों को संक्रमण तत्त्व कहा जाता है।
- लैन्थेनॉयडों तथा ऐक्टिनॉयडों को सामूहिक रूप से आन्तरिक संक्रमण तत्त्व कहते हैं तथा इन्हें तीसरे वर्ग से सम्बन्धित माना जाता है।
आधुनिक आवर्त सारणी के दोष:
- हाइड्रोजन की स्थिति दीर्घ आवर्त सारणी में भी स्पष्ट नहीं है।
- लैन्थेनॉयडों तथा एक्टिनॉयडों को मूल आवर्त सारणी में स्थान नहीं दिया जा सका है तथा इन्हें आवर्त सारणी के नीचे ही पृथक् से रखा गया है।
- हीलियम एक उत्कृष्ट गैस है लेकिन इसका इलेक्ट्रॉनिक विन्यास अन्य उत्कृष्ट गैसों से भिन्न है।
- लगभग समान गुण वाले तत्त्वों को पृथक् – पृथक् वर्गों में रखा गया है, जैसे Ba व Pb तथा Cu व Hg.
प्रश्न 42.
परमाणु त्रिज्या किसे कहते हैं? इसको प्रभावित करने वाले कारक तथा इसकी आवर्तिता को समझाइए।
उत्तर:
परमाण्वीय त्रिज्या:
परमाणु के नाभिक तथा बाह्यतम कोश जहाँ पर इलेक्ट्रॉन उपस्थित हैं, के बीच की दूरी को परमाणु त्रिज्या कहते हैं। एकल गैसीय परमाणु की परमाणु त्रिज्या का सही – सही निर्धारण करना बहुत मुश्किल है क्योंकि इसका मान बहुत कम होता है तथा तरंग यांत्रिकी के अनुसार परमाणु के चारों ओर उपस्थित इलेक्ट्रॉन अभ्र की कोई स्पष्ट परिसीमा नहीं होती है। अतः प्रायोगिक विधि से परमाणु त्रिज्या का निर्धारण संभव नहीं है अतः इसे एक अप्रत्यक्ष विधि से ज्ञात किया जाता है जिसमें संयुक्त अवस्था में परमाणुओं के बीच की दूरी के आधार पर परमाणु क्रिज्यों का आकलन किया जाता है। यह दूरी X – किरण विवर्तन, इलेक्ट्रॉन विवर्तन, न्यूट्रॉन विवर्तन या NMR स्पेक्ट्रमी अध्ययन द्वारा ज्ञात की जाती है।
1. सहसंयोजक त्रिज्या:
सहसंयोजक अणुओं में, एकल आबन्ध से जुड़े हुए दो समान अधात्विक परमाणुओं के नाभिकों के बीच की दूरी (सहसंयोजक बन्ध दूरी) को अन्तरापरमाणुक दूरी या अन्तरानाभिकीय दूरी कहते हैं तथा इस दूरी का आधा, परमाणु कहलाता है। इसे सहसंयोजक त्रिज्या भी कहते हैं।
d( a – a) = ra + ra
ra = (frac { { d }_{ a-a } }{ 2 } )
उदाहरण:
क्लोरीन अणु में दो परमाणुओं के नाभिकों के बीच की दूरी (बन्ध लम्बाई) 198 pm होती है। अतः इसका आधा 99 pm क्लोरीन की परमाणु त्रिज्या होगी। ऑक्सीजन तथा नाइट्रोजन की परमाणु (अन्तरापरंमाणुक दूरी) त्रिज्याएँ O2, तथा N2 से ज्ञात नहीं की जा सकती क्योंकि इनमें बहुबन्ध है, अतः इनकी त्रिज्याएँ क्रमशः H – O – O – H तथा H2N – NH2 द्वारा ज्ञात की जाती हैं।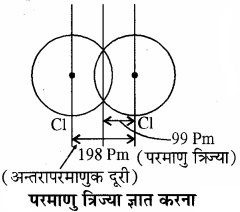
2. धात्विक त्रिज्या:
जब धातु परमाणुओं की त्रिज्या ज्ञात की जाती है तो इसे धात्विक त्रिज्या कहा जाता है। धातुओं के जालक में दो पास – पास स्थित धातु परमाणुओं के नाभिकों के बीच की दूरी (अन्तरानाभिकीय दूरी) का आधा, धात्विक त्रिज्या कहलाता है। जैसे कॉपर धातु में दो पास – पास स्थित कॉपर परमाणुओं के बीच की दूरी 256 pm है, अतः कॉपर की धात्विक त्रिज्या का मान 128 pm होगा। धात्विक त्रिज्या का मान सहसंयोजी त्रिज्या से अधिक होता है लेकिन वान्डर वाल त्रिज्या के मान से कम होता है, क्योंकि सहसंयोजक बन्ध में तो दो परमाणु अतिव्यापन द्वारा संगलित (fused) होते हैं जबकि धात्विक बन्ध में दो धातु परमाणु निकटस्थ रूप से संकुलित (Packed) होते हैं।
3. वान्डर वाल त्रिज्या:
अणुओं के मध्य एक दुर्बल आकर्षण बल पाया जाता है उसे वान्डर वाल बल कहते हैं, तथा किसी तत्त्व के दो अणुओं के पास-पास स्थित अबन्धित परमाणुओं के नाभिकों के बीच की दूरी के आधे को वान्डर वाल त्रिज्या कहते हैं।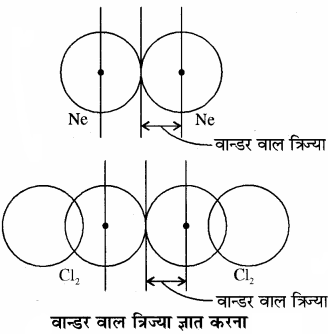
उत्कृष्ट गैसों की परमाणु त्रिज्या ज्ञात नहीं की जा सकती है। क्योंकि ये अणु नहीं बनाती हैं अतः इनकी वान्डरवाल त्रिज्या ज्ञात की जाती है जो कि परमाणु त्रिज्या से अधिक होती है। वान्डर वाल त्रिज्या का मान पदार्थ की भौतिक अवस्था पर भी निर्भर करता है। अतः ठोस अवस्था में इसका मान न्यूनतम तथा गैस अवस्था में अधिकतम होता है।
परमाणु त्रिज्या की सहायता से बन्ध लम्बाई ज्ञात की जा सकती है –
1. दो समान परमाणुओं के मध्य बने बन्ध की बन्ध लम्बाई –
dAA = rA + rA
यहाँ rA = परमाणु त्रिज्या
2. दो असमान परमाणुओं के मध्य बने बन्ध की लम्बाई –
dAB = rA + rB – 0.09 (XA – XB)
यहाँ rA = A की परमाणु त्रिज्या,
rB = B की परमाणु त्रिज्या
XA = A की विद्युत ऋणता, XB = B की विद्युत ऋणता तथा XA > XB
यह सूत्र शोमाकर तथा स्टीवेन्सन ने दिया था।
लम्बाई के आधार पर उपरोक्त प्रकार की त्रिज्याओं का घटता हुआ क्रम निम्नानुसार है –
वान्डरवाल्स त्रिज्या > धात्विक त्रिज्या > परमाण्वीय त्रिज्या
परमाणु त्रिज्या को प्रभावित करने वाले कारक:
प्रभावी नाभिकीय आवेश –
1. नाभिक द्वारा बाह्यतम कोश के इलेक्ट्रॉनों को अपनी ओर आकर्षित करना प्रभावी नाभिकीय आवेश कहलाता है। इसे Zeff द्वारा व्यक्त किया जाता है।
Zeff बढ़ने पर परमाणु त्रिज्या का मान घटता है।
परमाणु त्रिज्या ∝ (frac { 1 }{ { Z }_{ eff } } )
2. कोश की संख्या:
मुख्य क्वाण्टम संख्या (n) या कोशों की संख्या का मान बढ़ने पर परमाणु त्रिज्या का मान भी बढ़ता है।
परमाणु त्रिज्या ∝ कोशों की संख्या
3. परिरक्षण प्रभाव या आवरण प्रभाव:
मध्यवर्ती कोश के इलेक्ट्रॉनों का, बाह्यतम कोश के इलेक्ट्रॉनों पर डाला गया वह प्रतिकर्षी प्रभाव जिसके कारण बाह्यतम कोश के इलेक्ट्रॉन नाभिक का आकर्षण कम अनुभव करते हैं, परिरक्षण प्रभाव कहलाता है। इस प्रभाव के कारण परमाणु के संयोजी इलेक्ट्रॉनों द्वारा अनुभव किया गया Zeff नाभिक में उपस्थित वास्तविक नाभिकीय आवेश से कम हो जाता है, जिससे परमाणु त्रिज्या का मान बढ़ता है।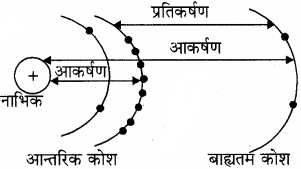
4. बंध की संख्या:
सहसंयोजक त्रिज्या बंधों की संख्या घर भी निर्भर करती है। सहसंयोजक बंधों की संख्या बढ़ने पर परमाणु त्रिज्या का मान कम होता है।![]()
सहसंयोजक यौगिकों जैसे H3C – CH3, H2C = CH2 तथा H – C = C – H में बंधों की संख्या में वृद्धि होती है, अतः परमाणु त्रिज्या का मान कम होता है।
H3C – CH3 (154pm), H2C = CH2(132pm) तथा H – C = C – H (120pm)
परमाणु त्रिज्या में आवर्तिता:
आवर्त सारणी के किसी आवर्त में बाएँ से दाएँ जाने पर परमाणु त्रिज्या का मान कम होता जाता है क्योंकि कोश तो वही रहता है। तथा उसी कोश में इलेक्ट्रॉन भरते जाते हैं लेकिन नाभिकीय आवेश (परमाणु क्रमांक) में वृद्धि होने के कारण, नाभिकीय आकर्षण बल बढ़ता है, जिससे इलेक्ट्रॉन अभ्र सिकुड़ता है। इस प्रकार किसी आवर्त में क्षार धातुओं की परमाणु त्रिज्या अधिकतम तथा हैलोजनों की परमाणु त्रिज्या न्यूनतम होती है जैसा कि द्वितीय तथा तृतीय आवर्त के तत्त्वों की परमाणु त्रिज्या के मान तथा चित्र से स्पष्ट है।
सारणी – द्वितीय तथा तृतीय आवर्त के तत्त्वों की परमाणु त्रिज्या के मान (pm)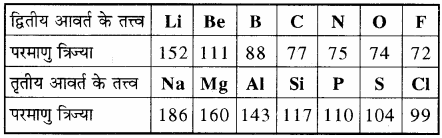
संक्रमण तत्त्वों में बाएँ से दाएँ जाने पर परमाणु त्रिज्या में कमी बहुत कम होती है अथवा आकार लगभग समान रहता है क्योंकि इलेक्ट्रॉन उपान्त्य [(n – 1)d] कोश में भरते हैं जिनका परिरक्षण प्रभाव, नाभिकीय आकर्षण बल को काफी हद तक संतुलित कर देता है। d – ब्लॉक में 4d श्रेणी तथा 5d श्रेणी के तत्त्वों का परमाणु आकार लगभग समान होता है जिसका मुख्य कारण लैन्थेनॉयड संकुचन है।
सारणी – वर्ग 1 तथा वर्ग 17 के तत्त्वों की परमाणु त्रिज्या के मान (pm)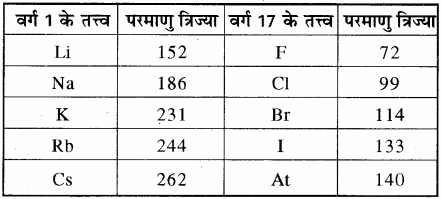
नोट –
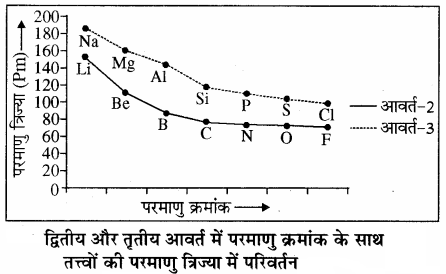
उत्कृष्ट गैसों की वान्डरवाल्स त्रिज्या को ही परमाण्वीय त्रिज्या मानते हैं। अतः इनके आकार आवर्त में सबसे बड़े होते हैं। आवर्त सारणी में किसी वर्ग में ऊपर से नीचे जाने पर मुख्य क्वांटम संख्या (n) का मान बढ़ता जाता है अर्थात् नया कोश जुड़ता जाता है। अतः संयोजी इलेक्ट्रॉन नाभिक से दूर होते जाते हैं क्योंकि आन्तरिक ऊर्जा स्तरों में इलेक्ट्रॉन भरे रहते हैं, जो कि बाह्य इलेक्ट्रॉनों पर नाभिकीय आकर्षण बल को कम कर देते हैं। (परिरक्षण प्रभाव) इसीलिए परमाणु त्रिज्या का मान बढ़ता है जैसा कि वर्ग 1 तथा वर्ग 17 के तत्त्वों के परमाणु आकार के मानों से स्पष्ट है। इसी प्रकार वर्ग 1 (क्षार धातु) तथा वर्ग 17 (हैलोजन) के तत्त्वों की परमाणु त्रिज्या में परिवर्तन को निम्नलिखित आलेख द्वारा प्रदर्शित किया जा सकता है –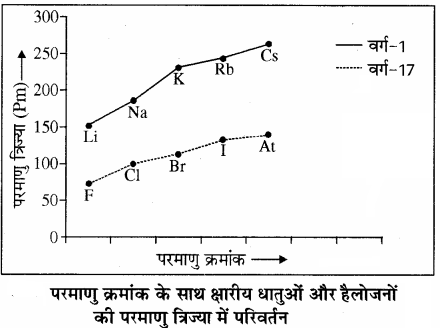
आयनिक त्रिज्या:
- आयनिक त्रिज्या किसी आयन का आकार बताती है। किसी आयन के नाभिक तथा उसके अन्तिम इलेक्ट्रॉन के बीच की दूरी जहाँ तक आयन का आयनिक बन्ध में प्रभाव रहता है, उसे आयनिक त्रिज्या कहते हैं।
- इसे आयनिक क्रिस्टल में स्थित धनायन तथा ऋणायन के बीच की दूरी के आधार पर ज्ञात किया जाता है।
- किसी परमाणु में से इलेक्ट्रॉनों के निकलने से धनायन बनते हैं।
- धनायन की त्रिज्या हमेशा उसके जनक परमाणु से कम होती है। क्योंकि इलेक्ट्रॉनों की संख्या तो कम हो जाती है लेकिन नाभिकीय आवेश (प्रोटोनों की संख्या) तथा प्रभावी नाभिकीय आवेश (Zeff) उतना ही रहता है अतः इलेक्ट्रॉनों पर नाभिकीय आकर्षण बल बढ़ जाता है, जिससे इलेक्ट्रॉन अभ्र सिकुड़ता है, जैसे Na+ आयन की त्रिज्या Na की परमाणु क्रिज्या से कम होती है।

जैसे – जैसे धनायन पर आवेश बढ़ता है, वैसे – वैसे Zeff का मान बढ़ेगा जिससे धनायनिक क्रिज्या का मान कम होगा।
Na+ > Mg2+ > Al3+
इसी प्रकार Fe > Fe2+ > Fe3+ - धनायन बनते समय यदि बाह्यतम कोश ही समाप्त हो जाता है। तो धनायन की त्रिज्या, परमाणु त्रिज्या की तुलना में बहुत कम होती है। जैसे Mg की त्रिज्या 1.36 Å होती है जबकि Mg2+ की त्रिज्या 0.65 मैं होती है। ऐसा सभी क्षार धातुओं तथा क्षारीय मृदा धातुओं में होता है।

- किसी परमाणु में इलेक्ट्रॉनों के जुड़ने से ऋणायन बनते हैं।
- ऋणायन की त्रिज्या उसके संगत परमाणु से अधिक होती है। क्योंकि एक या अधिक अतिरिक्त इलेक्ट्रॉन आने से इलेक्ट्रॉन – इलेक्ट्रॉन में प्रतिकर्षण बढ़ता है तथा प्रभावी नाभिकीय आवेश उतना ही रहता है, जिससे इलेक्ट्रॉन अभ्र का फैलाव होता है। जैसे F– की क्रिज्या F से अधिक होती है। इसी प्रकार O2- की क्रिज्या O से अधिक होती है।

जैसे – जैसे ऋणायन पर आवेश बढ़ता है, वैसे – वैसे इलेक्ट्रॉनइलेक्ट्रॉन में प्रतिकर्षण बढ़ेगा जिससे ऋणायनिक क्रिज्या का मान बढ़ेगा।
F < O2- < N3-
इसी प्रकार
O< O-1 < O-2 - आयनिक क्रिया में आवर्तिता भी सामान्यतः परमाणु त्रिज्या के समान ही होती है। जैसे वर्ग में आयनिक त्रिज्या बढ़ती है तथा आवर्त में आयनिक त्रिज्या कम होती है।
उदाहरण:
Li+ < Na+ < K+ < Rb+ < Cs+ (वर्ग)
F– < Cl– < Br– < I– (वर्ग)
Na+ > Mg+2 > Al3+ (आवर्त)
समइलेक्ट्रॉनीय स्पीशीज तथा उनका आकार:
विभिन्न परमाणुओं तथा आयनों में जब इलेक्ट्रॉनों की संख्या समान होती है तो इन्हें समइलेक्ट्रॉनिक स्पीशीज कहते हैं।
उदाहरण:
O2-, F–, Na+, Mg+2 इन सभी स्पीशीज में इलेक्ट्रॉनों की संख्या समान (10) है। लेकिन इनमें नाभिकीय आवेश भिन्न – भिन्न हैं। समइलेक्ट्रीय स्पीशीज में अधिक धनावेशित स्पीशीज की त्रिज्या का मान कम होता है, क्योंकि इनमें इलेक्ट्रॉनों की तुलना में प्रोटॉनों की संख्या अधिक होती है। अतः नाभिक तथा इलेक्ट्रॉनों के मध्य आकर्षण अधिक होता है। इसके विपरीत अधिक ऋणावेशित स्पीशीज की क्रिया अधिक होती है, क्योंकि इनमें प्रोटॉनों की तुलना में इलेक्ट्रॉनों की संख्या अधिक होती है। अतः इलेक्ट्रॉनों के मध्य प्रतिकर्षण, नाभिकीय आवेश से अधिक हो जाता है। अतः नाभिकीय आकर्षण बल कम हो जाता है। जैसे –
प्रश्न 43.
किसी तत्त्व की आयनन एन्थैल्पी से आप क्या समझते हैं? इसको प्रभावित करने वाले कारक तथा इसकी आवर्तिता को समझाइए।
उत्तर:
आयनन एन्थैल्पी या आयनन ऊर्जा:
किसी तत्त्व की आयनन एन्थैल्पी उसके द्वारा इलेक्ट्रॉन त्यागने की मात्रात्मक प्रवृत्ति है। किसी तत्त्व की तलस्थ अवस्था (Ground state) में एक मोल विलगित गैसीय परमाणु में से बाह्यतम इलेक्ट्रॉन, जो कि सबसे ढीला बंधा है, को पृथक् करने के लिए आवश्यक ऊर्जा को आयनन एन्थैल्पी या आयनन ऊर्जा या आयनन विभव कहते हैं। अतः किसी तत्त्व (X) की प्रथम आयनन एन्थैल्पी का मान निम्नलिखित रासायनिक प्रक्रम में हुए एन्थैल्पी परिवर्तन ∆iH के बराबर होगा।
X(g) → X+(g) + e–
आयनन एन्थैल्पी को सामान्यतया (kJ mol-1) या इलेक्ट्रॉन वोल्ट (ev) में व्यक्त किया जाता है तथा यह हमेशा धनात्मक होती है। इससे स्पष्ट होता है कि किसी तत्त्व की आयनन एन्थैल्पी का मान कम होने पर उस परमाणु को आसानी से धनायन में परिवर्तित किया जा सकता है। किसी परमाणु में से पहले, दूसरे तथा तीसरे इलेक्ट्रॉन को निकालने के लिए आवश्यक ऊर्जा को क्रमशः प्रथम आयनन एन्थैल्पी (IE1), द्वितीय आयनन एन्थैल्पी (IE2) तथा तृतीय आयनन एन्थैल्पी (IE3) कहते हैं।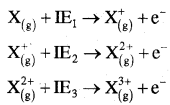
इन आयनन एन्थैल्पी मानों का क्रम निम्न प्रकार होता है –
IE1 < IE2 < IE3
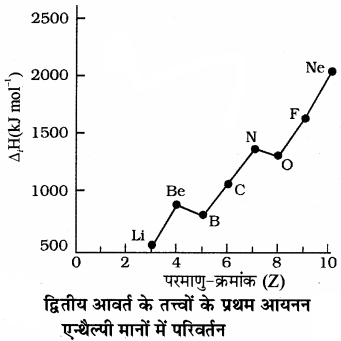
अतः किसी तत्त्व की द्वितीय आयनन एन्थैल्पी, आयनेन एन्थैल्पी से अधिक होती है, क्योंकि उदासीन परमाणु की तुलना में धनावेशित आयन में प्रभावी नाभिकीय आवेश अधिक होता है अतः बाह्यतम इलेक्ट्रॉन तथा नाभिक के मध्य आकर्षण बल बढ़ जाता है, दूसरे इलेक्ट्रॉन को निकालने के लिए अधिक ऊर्जा की आवश्यकता होती है। इसी प्रकार तृतीय आयनन एन्थैल्पी, द्वितीय आयनन एन्थैल्पी से अधिक होती है। जब केवल आयनन एन्थैल्पी दिया होता है तो इसे प्रथम आयनन एन्थैल्पी माना जाता है। परमाणु क्रमांक 1 से 60 तक वाले तत्त्वों की प्रथम आयनन एन्थैल्पी तथा परमाणु क्रमांक में आलेख निम्न प्रकार होता है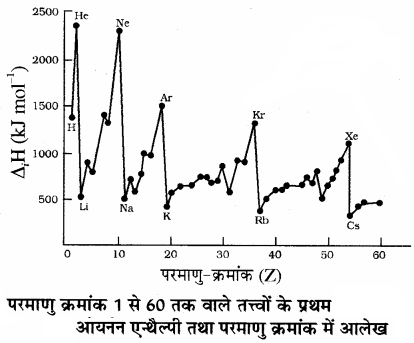
आयनन एन्थैल्पी तथा परमाणु क्रमांक में आलेख आयनन एन्थैल्पी को प्रभावित करने वाले कारक:
आयनन एन्थैल्पी को प्रभावित करने वाले कारक निम्नलिखित –
- परमाण्वीय आकार:
आयनन एन्थैल्पी, परमाण्वीय आकार के व्युत्क्रमानुपाती होती है अर्थात्
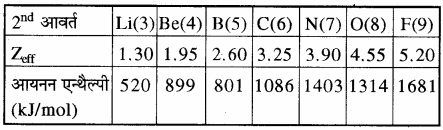
- प्रभावी नाभिकीय आवेश:
किसी आवर्त में बाएँ से दाएँ जाने पर नाभिकीय आवेश तथा प्रभावी नाभिकीय आवेश (Zeff) दोनों बढ़ते हैं जिससे बाह्यतम इलेक्ट्रॉन पर नाभिकीय आकर्षण बल बढ़ जाता है अतः आयनन एन्थैल्पी का मान भी बढ़ता है। द्वितीय आवर्त के तत्त्वों की प्रथम आयनन एन्थैल्पी मानों का बढ़ता क्रम निम्न प्रकार होता है –
इनके परमाणु क्रमांक तथा आयनन एन्थैल्पी मानों के मध्य आलेख आगे दिया गया है।
- परिरक्षण प्रभाव या आवरणी प्रभाव:
परमाणुओं में आन्तरिक कोशों के इलेक्ट्रॉन (क्रोडीय इलेक्ट्रॉन), नाभिक तथा संयोजी इलेक्ट्रॉन के मध्य उपस्थित होते हैं अतः संयोजी इलेक्ट्रॉन नाभिक से परिरक्षित हो जाता है अर्थात् उस पर नाभिकीय आकर्षण बल कम हो जाता है। इस प्रभाव को परिरक्षण प्रभाव (Shielding Effect) या आवरणी प्रभाव (Screening Effect) कहते हैं। आवरणी-प्रभाव के कारण परमाणु के संयोजी इलेक्ट्रॉनों द्वारा अनुभव किया गया प्रभावी नाभिकीय आवेश (Effective Nuclear Charge) नाभिक के वास्तविक नाभिकीय आवेश से कम हो जाता है।
आवरणी – प्रभाव उस स्थिति में अत्यधिक प्रभावी होता है, जब आन्तरिक कोश पूर्ण भरा होता है। यह स्थिति क्षार धातुओं में होती है, जिनमें ns1 इलेक्ट्रॉन से पूर्व के कोश में उत्कृष्ट गैस का पूर्णपूरित विन्यास होता है। आन्तरिक कोशों में इलेक्ट्रॉनों की संख्या बढ़ने पर परिरक्षण प्रभाव बढ़ता है जिससे नाभिकीय आकर्षण बल कम हो जाता है अतः आयनन एन्थैल्पी का मान भी कम होता है। - कक्षकों की भेदन क्षमता:
कक्षकों की नाभिक के समीप रहने की प्रवृत्ति को उनकी भेदन क्षमता कहते हैं। जब मुख्य क्वान्टम संख्या का मान समान होता है तो विभिन्न कक्षकों की भेदन क्षमता का क्रम निम्न प्रकार होता है –
s > p > d > f
तः s – कक्षक नाभिक के अधिक पास होते हैं जिन पर नाभिकीय आकर्षण बल अधिक लगता है इसलिए p – कक्षक की तुलना में s – कक्षक में से इलेक्ट्रॉन को निकालने के लिए अधिक ऊर्जा की आवश्यकता होती है अर्थात् आयनन एन्थैल्पी का मान अधिक होता है।उदाहरण:
बोरॉन (Z = 5) की प्रथम आयनन एन्थैल्पी का मान बेरिलियम (Z = 4) की प्रथम आयनन एन्थैल्पी के मान से कम होता है, जबकि बोरॉन का नाभिकीय आवेश अधिक है। Be में इलेक्ट्रॉन 2s में से निकलता है। जबकि B में इलेक्ट्रॉन 2p में से निकलता है। 2s की ऊर्जा 2p से कम है अतः 2s अधिक स्थायी है एवं 2s की भेदन क्षमता 2p से अधिक है। इसी प्रकार Al की प्रथम आयनन एन्थैल्पी का मान Mg की प्रथम आयनन एन्थैल्पी के मान से कम होता है। - अर्धपूरित एवं पूर्णपूरित कक्षकों को स्थायित्व:
अर्धपूरित (p3, d5, f7) तथा पूर्ण पूरित (p6, d10, f14) विन्यास वाले कक्षक अधिक स्थायी होते हैं क्योंकि इनमें इलेक्ट्रॉनों का सममित वितरण होता है तथा इनकी स्थायीकरण ऊर्जा का मान भी अधिक होता है। अतः ऐसे विन्यास वाले कक्षकों में से इलेक्ट्रॉन को निकालने के लिए अधिक ऊर्जा की आवश्यकता होती है, इसी कारण आयनन एन्थैल्पी का मान भी अधिक होता है।लेकिन यह ध्यान रहे कि पूर्ण पूरित विन्यास, अर्धपूरित विन्यास से भी अधिक स्थायी होता है। इसी कारण उत्कृष्ट गैसों की आयनन एन्थैल्पी का मान अपने आवर्त में उच्चतम होता है क्योंकि इनमें पूर्ण पूरित कोश स्थायी विन्यास (ns2np6) होता है जिसमें से इलेक्ट्रॉन को निकालने के लिए अधिक ऊर्जा की आवश्यकता होती है। नाइट्रोजन (Z = 7) तथा फास्फोरस (Z = 15) के प्रथम आयनन एन्थैल्पी मान क्रमशः ऑक्सीजन (Z = 8) तथा सल्फर (Z = 16) के प्रथम आयनन एन्थैल्पी मानों से अधिक होते हैं क्योंकि N तथा P में अर्धपूरित (2p3 तथा 3p3) विन्यास होता है जो कि O तथा S के विन्यास (2p4 तथा 3p4) से अधिक स्थायी है, जिसमें से इलेक्ट्रॉन को निकालने के लिए अधिक ऊर्जा की आवश्यकता होती है। - मुख्य क्वाण्टम संख्या:
मुख्य क्वाण्टम संख्या के मान में वृद्धि के साथ – साथ संयोजी इलेक्ट्रॉन एवं नाभिक के मध्य की दूरी बढती है, जिससे नाभिकीय आकर्षण कम होता है अतः आयनन एन्थैल्पी का मान घटता है।
IE ∝ (frac { 1 }{ n } ) - परमाणु या आयन पर कुल आवेश:
उदासीन परमाणु की तुलना में धनावेशित आयन से इलेक्ट्रॉन का निकलना कठिन होता है क्योंकि धनायन का आकार छोटा होता है तथा इसमें प्रभावी नाभिकीय आवेश अधिक होता है। अतः IE का क्रम निम्न प्रकार होगा –
M+ < M2+< M3+ < M4+
आयनन एन्थैल्पी में आवर्त के अनुदिश आवर्तिता:
आवर्त सारणी के किसी आवर्त में बाएँ से दाएँ जाने पर परमाणु आकार में कमी होती है अतः आयनन एन्थैल्पी का मान बढ़ता है क्योंकि बाह्यतम इलेक्ट्रॉन पर नाभिकीय आकर्षण बल बढ़ता है। इस कारण इलेक्ट्रॉन को निकालने के लिए अधिक ऊर्जा की आवश्यकता होती है। अतः किसी आवर्त में क्षार धातुओं की आयनन एन्थैल्पी का मान सबसे कम होता है क्योंकि इनका परमाणु आकार बड़ा होने के कारण ये आसानी से इलेक्ट्रॉन त्याग देती हैं।
नोट –
Al तथा Ga के प्रथम आयनन एन्थैल्पी मान लगभग समान होते हैं क्योंकि Al से Ga तक जाने पर बीच में 10 संक्रमण तत्त्व आते हैं जिससे नाभिकीय आवेश बढ़ जाने के कारण नाभिकीय आकर्षण बल बढ़ जाता है। अतः इनका आकार भी लगभग समान होता है। किसी आवर्त में सामान्यतः परिरक्षण प्रभाव लगभग समान रहता है क्योंकि आन्तरिक कोशों में इलेक्ट्रॉनों की संख्या समान रहती है।
जैसे – द्वितीय आवर्त में लीथियम से फ्लुओरीन की ओर जाने पर इलेक्ट्रॉन क्रमशः एक ही मुख्य ऊर्जा – स्तर के कक्षकों में भरते हैं तथा नाभिक पंर आन्तरिक क्रोड इलेक्ट्रॉनों द्वारा डाले गए आवरणी – प्रभाव में इतनी वृद्धि नहीं होती कि नाभिक तथा इलेक्ट्रॉन के बीच बढ़ते हुए आकर्षण बल को संतुलित कर सके।
अतः नाभिकीय आकर्षण बल अधिक होता है इसलिए आवर्त में आयनन एन्थैल्पी का मान बढ़ता है। संक्रमण तत्त्वों में आवर्त में आयनन एन्थैल्पी में वृद्धि बहुत कम होती है क्योंकि इनमें इलेक्ट्रॉन आन्तरिक [(n – 1) d] कक्षकों में भरे जाते हैं जिनका परिरक्षण प्रभाव नाभिकीय आकर्षण बल को काफी हद तक संतुलित कर देता है।
आयनन एन्थैल्पी में वर्ग के अनुदिश आवर्तिता:
आवर्त सारणी के किसी वर्ग में ऊपर से नीचे जाने पर परमाणु आकार बढ़ता है अतः आयनन एन्थैल्पी का मान कम होता है क्योंकि परमाणु आकार बढ़ने पर बाह्यतम इलेक्ट्रॉन की नाभिक से दूरी बढ़ती है इसलिए उस इलेक्ट्रॉन पर लगने वाला नाभिकीय आकर्षण बल कम हो जाता है अतः उसे परमाणु से पृथक् करने के लिए कम ऊर्जा की आवश्यकता होती है। जैसे क्षार धातुओं की प्रथम आयनन एन्थैल्पी मानों का घटता क्रम निम्न प्रकार होता है –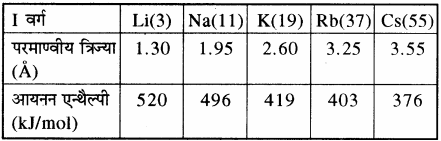
इनके परमाणु क्रमांक तथा आयनन एन्थैल्पी मानों के मध्य आलेख नीचे दिया गया है।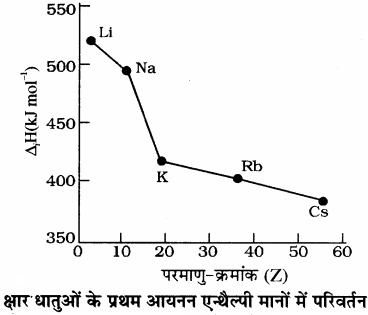
आवर्त सारणी के किसी वर्ग में ऊपर से नीचे की ओर जाने पर आन्तरिक कोशों की संख्या में वृद्धि होती है जिससे परिरक्षण प्रभाव बढ़ता है जो कि नाभिकीय आवेश की तुलना में अधिक होता है। अतः वर्ग में आयनन एन्थैल्पी का मान कम होता है। संक्रमण तत्त्वों में वर्ग में 3d से 4d में जाने पर संगत तत्त्वों की आयनन एन्थैल्पी कम होती है क्योंकि परमाणु आकार बढ़ता है। जबकि Y(39) से La(57) को छोड़कर 4d से 5d में जाने पर आयनन एन्थैल्पी के मान में वृद्धि होती है, क्योंकि 4f इलेक्ट्रॉन लैन्थेनॉयड संकुचन के कारण 5d इलेक्ट्रॉनों को परिरक्षित नहीं कर पाते, जिससे आकर्षण बल बढ़ जाता है।
प्रश्न 44.
विद्युतऋणात्मकता एवं इलेक्ट्रॉन लब्धि एन्थैल्पी के अनुप्रयोगों को समझाइए।
उत्तर:
विद्युत ऋणता के मुख्य अनुप्रयोग निम्नलिखित हैं:
- तत्त्वों का धात्विक तथा अधात्विक गुण:
अधातु तत्त्वों में इलेक्ट्रॉन लेने की प्रवृत्ति अधिक होती है अतः विद्युत ऋणात्मकता अधातु गुण का माप है। इस कारण आवर्त में अधातु गुण बढ़ता है। जबकि वर्ग में अधातु गुण कम होता है अर्थात् धातु गुण बढ़ता है। - सहसंयोजक बंध में आंशिक आयनिक गुण:
दो समान परमाणुओं (विद्युत ऋणता समान) के मध्य बने बन्ध को शुद्ध सहसंयोजी बन्ध कहते हैं। जैसे – H2, Cl2 इत्यादि; लेकिन जब दो भिन्न – भिन्न परमाणुओं के मध्य बन्ध बनता है तो बन्ध में ध्रुवता आ जाती है क्योंकि साझे का इलेक्ट्रॉन युग्म अधिक विद्युत ऋणी परमाणु की ओर विस्थापित हो जाता है। इस प्रकार के बन्ध को ध्रुवीय सहसंयोजी बन्ध कहते हैं। जैसे – Hδ+– Clδ- – Cl की E.N. > H की E.N.ध्रुवीय सहसंयोजी बन्ध का अर्थ है कि सहसंयोजी बन्ध में आंशिक आयनिक लक्षण आ गया है। दो परमाणुओं की विद्युत ऋणता में जितना अधिक अन्तर होगा, बन्ध में आयनिक लक्षण भी उतना ही अधिक होगा। हैनी तथा स्मिथ ने किसी बन्ध का प्रतिशत आयनिक गुण ज्ञात करने के लिए निम्नलिखित सम्बन्ध दिया। माना परमाणु A तथा B के मध्य बन्ध बना है तो बन्ध में % आयनिक गुण –
= (0.16 ∆ + 0.035 ∆2) × 100
= 16 ∆+ 3.5 ∆2
यहाँ ∆ = विद्युत ऋणता में अन्तर तथा XA – XB = तत्त्व A व B की विद्युत ऋणता
अतः प्रतिशत आयनिक गुण = 16 (XA – XB) + 3.5 (XA– XB)
यहाँ XA > XB
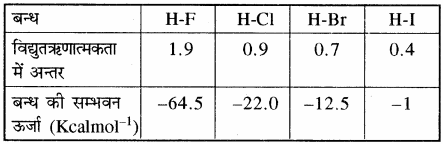
इस सूत्र के अनुसार विद्युत ऋणता में अन्तर 2.1 होने पर बन्ध में। लगभग 50% आयनिक गुण होगा। जैसे –
HF > HCl > HBr> HI
बन्ध में आयनिक गुण का घटता क्रम
- बन्ध सामर्थ्य:
दो परमाणुओं के मध्य विद्युत ऋणता में अन्तर बढ़ने पर बन्ध सामर्थ्य तथा स्थायित्व बढ़ता है।
उदाहरण:
HF > HCl > HBr > HI
बन्ध सामर्थ्य को घटता क्रम (विद्युत ऋणता में अन्तर का घटता क्रम)
अतः बन्ध सामर्थ्य ∝ परमाणुओं की विद्युत ऋणता में अन्तर
- ऑक्साइडों की क्षारीय तथा अम्लीय प्रवृत्ति:
सामान्यतः आवर्त में बाएँ से दाएँ जाने पर तत्त्वों के आक्साइडों की अम्लीय प्रकृति बढ़ती है क्योंकि तत्त्व की विद्युत ऋणता बढ़ती है जिससे ऑक्सीजन तथा तत्त्व की विद्युत ऋणता में अन्तर कम होता है। वर्ग में ऊपर से नीचे जाने पर तत्त्वों के ऑक्साइड की क्षारीय प्रकृति बढ़ती है। जब ऑक्सीजन तथा तत्त्व की विद्युत ऋणता में अन्तर 2.3 से अधिक होता है, तो ऑक्साइड क्षारीय तथा यह अन्तर 2.3 से कम होता है तो ऑक्साइड अम्लीय होगा।
अतः X0 – Xm > 2.3 क्षारीय ऑक्साइड
X0 – Xm < 2.3 अम्लीय ऑक्साइड
X0 = ऑक्सीजन की विद्युतऋणता
Xm = तत्त्व की विद्युतऋणता
उदाहरण:
- बन्थ लम्बाई ज्ञात करना:
शोमाकर तथा स्टीवेन्सन के अनुसार ध्रुवीय सहसंयोजी बन्ध (A – B) की बन्ध लम्बाई
dA – B = rA + rB – 0.09 (XA – XB)
या
यहाँ rA = A की परमाणु त्रिज्या, rB = B की परमाणु त्रिज्या
XA = A की विद्युत ऋणता, XB = B की विद्युत ऋणता तथा XA > XB
अध्रुवीय बन्ध के लिए XA ≃ XB
अतः बन्ध लम्बाई dA – B = rA + rB
उपरोक्त सूत्र से सिद्ध होता है कि दो परमाणुओं के मध्य विद्युत ऋणता में अन्तर बढ़ने पर, बन्ध लम्बाई कम होती है, इसका कारण यह है कि विद्युत ऋणता में अन्तर बढ़ने पर बन्ध का आयनिक गुण (ध्रुवता) बढ़ता है जिससे परमाणुओं पर आवेश भी बढ़ता है अतः उनके मध्य आकर्षण बढ़ता है जिससे बन्ध लम्बाई में कमी होती है। - द्विअंगी अकार्बनिक यौगिकों का सूत्र लिखना तथा उनका IUPAC नामकरण:
भिन्न – भिन्न तत्त्वों से बने यौगिकों को द्विअंगी यौगिक कहते हैं। अकार्बनिक द्विअंगी यौगिकों के सूत्र लिखते समय कम विद्युत ऋणी तत्त्व के संकेत को पहले तथा अधिक विद्युत ऋणी तत्त्व के संकेत को बाद में लिखा जाता है एवं यौगिक का नाम, अधिक विद्युत ऋणी तत्त्व के व्युत्पन्न के रूप में दिया जाता है। जैसे – NaCl, ClF Cl2O (O की E.N. > Cl की E.N.) इस आधार पर Cl2O का नाम डाइक्लोरीन मोनोऑक्साइड या क्लोरीन ऑक्साइड होगा। इसी प्रकार OF2 का नाम ऑक्सीजन डाइफ्लुओराइड होगा। अतः सूत्र Cl2O सही है जबकि (OCl2 गलत, लेकिन सूत्र F2O गलत है जबकि OF2 सही, क्योंकि F की विद्युत ऋणता O की विद्युत ऋणता से अधिक होती है। इसी आधार पर कुछ यौगिकों के सूत्र तथा नाम निम्न प्रकार हैं –
ICl (आयोडीन क्लोराइड), BrCl (ब्रोमीन क्लोराइड) तथा IF (आयोडीन फ्लुओराइड) इस नामकरण तथा सूत्र लिखने के तरीके के कुछ अपवाद भी हैं; जैसे – NH3 (अमोनिया), NH2 – NH2 (हाइड्रेजीन), NCl3 (नाइट्रोजन ट्राइक्लोराइड) तथा N3H (हाइड्रेजोइक अम्ल)। नाम तथा सूत्र परम्परागत रूप से चले आ रहे हैं, अतः इन्हें IUPAC द्वारा मान्यता दे दी गयी है। - बन्ध कोण:
ABx अणु में B की विद्युतऋणात्मकता कम होने पर बंध कोण बढ़ता है इसीलिए NH3 का बंध कोण NF3 से अधिक होता है।
ABx अणु में केन्द्रीय परमाणु A की विद्युतऋणात्मकता कम होने पर भी B – A – B बन्ध कोण घटता है।
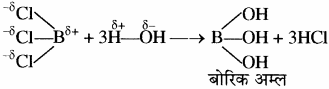
- यौगिकों के जल अपघटन की क्रियाविधि:
विद्युत ऋणता की सहायता से यौगिकों के जल अपघटन से प्राप्त उत्पादों की व्याख्या की जा सकती है। जैसे – BCl3 के जल अपघटन से HCl तथा H3BO3 बनते हैं।
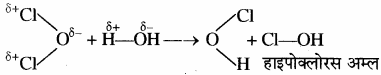
इन उत्पादों का बनना इस आधार पर समझाया जा सकता है कि Cl की E.N., B की E.N. से अधिक है जिससे Cl पर आंशिक ऋणावेश तथा B पर आंशिक धनावेश आ जाता है, अतः धनावेशित बोरोन, जल के ऋणावेशित OH– से तथा ऋणावेशित क्लोरीन जल के Hδ+ से क्रिया करके B(OH)3 तथा HCl देते हैं। इसी प्रकार Cl2O के जल अपघटन से HOCl प्राप्त होता है।
- हाइड्रॉक्साइडों की अम्लीय तथा क्षारीय प्रवृत्ति:
तत्त्वों के हाइड्रॉक्साइडों की अम्लीय तथा क्षारीय प्रवृत्ति की व्याख्या हम आयनन एन्थैल्पी के आधार पर कर चुके हैं लेकिन विद्युत ऋणता के आधार पर भी इनके अम्लीय तथा क्षारीय गुण की व्याख्या की जा सकती है। किसी तत्त्व (A) के हाइड्रॉक्साइड AOH के जलीय विलयन का आयनन दो प्रकार से हो सकता है –
1. AOH ⇌ A+ + OH– (क्षारीय हाइड्रॉक्साइड)
2. AOH ⇌ AO– + H+ (अम्लीय हाइड्रॉक्साइड)
1. जब (Xo – XA) < (Xo – XH) तो A – O बन्ध, O – H बन्ध की तुलना में अधिक ध्रुवीय होगा अतः AOH के आयनन से OH– प्राप्त होंगे इसलिए हाइड्रॉक्साइड क्षारीय होगा, जैसे – Na – O – H
2. लेकिन जब (Xo – XA) > (Xo – XH) तो O – H बन्ध, A – O बन्ध की अपेक्षा अधिक ध्रुवीय होगा अतः A – OH के आयनन से H+ प्राप्त होंगे इसलिए यह अम्लीय होगा जैसे – Cl – O – H
यहाँ Xo = O की E.N., XA= A की E.N., XH = H की E.N.
गैलिस के अनुसार A की विद्युत ऋणती का मान 1.7 से कम होने पर A – OH क्षारीय तथा यह मान 1.7 से अधिक होने पर A – OH अम्लीय होगा।
आवर्त सारणी में तत्त्वों की आवर्त प्रवृत्ति को निम्न प्रकार दर्शाया जा सकता है –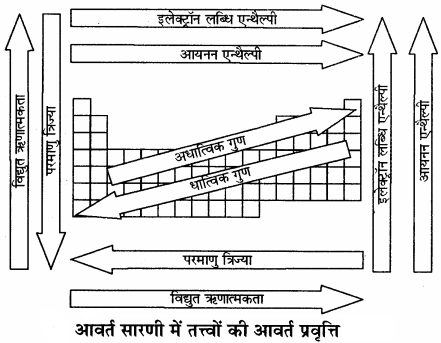
रासायनिक गुण धर्मों में आवर्त प्रवृत्ति:
भौतिक गुण धर्मों के समान अनेक रासायनिक गुण भी आवर्ती परिवर्तन दर्शाते हैं। इस भाग में हम तत्त्वों की संयोजकता में आवर्तिता तथा दूसरे आवर्त के तत्त्वों के असामान्य गुणों का अध्ययन करेंगे।
प्रश्न 45.
इलेक्ट्रॉन लब्धि एन्थैल्पी किसे कहते हैं? इसको प्रभावित करने वाले कारक तथा इसकी आवर्तिता को समझाइए।
उत्तर:
इलेक्ट्रॉन लब्धि एन्थैल्पी:
किसी तत्त्व की तलस्थ अवस्था में एक मोल विलगित गैसीय परमाणु के संयोजकता कोश में इलेक्ट्रॉन के जुड़ने पर मुक्त ऊर्जा को उस तत्त्व की इलेक्ट्रॉन लब्धि एन्थैल्पी कहते हैं अर्थात् जब कोई उदासीन गैसीय परमाणु (X) इलेक्ट्रॉन ग्रहण करके ऋणायन में परिवर्तित होता है, तो इस प्रक्रम में हुए एन्थैल्पी परिवर्तन को ‘इलेक्ट्रॉन लब्धि एन्थैल्पी’ (ΔegH) कहते हैं। यह एन्थैल्प परिवर्तन यह दर्शाता है कि कितनी सरलता से परमाणु इलेक्ट्रॉन को ग्रहण करके ऋणायन बनाता है।
X–(g)+ e– → X–(g) + ΔegH
इलेक्ट्रॉन लब्धि एन्थैल्पी को सामान्यतः kJ mol-1 में व्यक्त किया जाता है। किसी परमाणु में इलेक्ट्रॉन जुड़ने पर सामान्यतः ऊर्जा का उत्सर्जन होता है अतः इलेक्ट्रॉन लब्धि एन्थैल्पी ऋणात्मक होती है। किसी परमाणु में एक इलेक्ट्रॉन जोड़ने से प्राप्त ऋणायन में एक इलेक्ट्रॉन और जोड़ने पर ऊर्जा का उत्सर्जन नहीं होता बल्कि ऊर्जा का अवशोषण होता है अर्थात् किसी परमाणु में दूसरा इलेक्ट्रॉन जोड़ने पर ऊर्जा की आवश्यकता होती है क्योंकि जुड़ने वाले इलेक्ट्रॉन तथा ऋणायन के इलेक्ट्रॉन के मध्य प्रतिकर्षण होता है अतः द्वितीय इलेक्ट्रॉन लब्धि एन्थैल्पी हमेशा धनात्मक होती है।
X–(g) + e– → X2-(g) + ΔegH
O(g) से O2-(g) बनने पर ऊर्जा का अवशोषण होता है क्योंकि प्रथम पद में प्राप्त ऊर्जा का मान द्वितीय पद में अवशोषित ऊर्जा से कम है।
O(g) + e → O–(g) – + 141 kJ mol-1 ΔH = – 141 KJ
Og+ e → O2-g – 844 kJ mol-1 ΔH = + 844 KJ
कुछ तत्त्वों की इलेक्ट्रॉन लब्धि एन्थैल्पी का मान निम्न प्रकार है –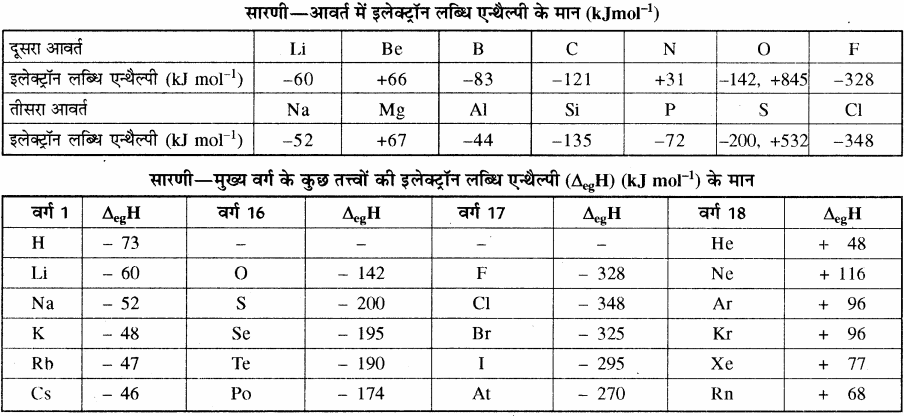
नोट –
किसी गैसीय परमाणु में इलेक्ट्रॉन जोड़कर ऋणायन बनाने के प्रक्रम में हुए एन्थैल्पी परिवर्तन के ऋणात्मक मान को इलेक्ट्रॉन बन्धुता (Electron affinity) (Ae) के रूप में भी परिभाषित किया जाता है। लेकिन किसी परमाणु द्वारा इलेक्ट्रॉन ग्रहण करने पर जब ऊर्जा उत्सर्जित होती है, तो इलेक्ट्रॉन बन्धुता को धनात्मक माना जाता है, जो ऊष्मागतिकी की परम्परा के विपरीत है। यदि किसी परमाणु में इलेक्ट्रॉन जोड़ने के लिए बाहर से ऊर्जा देनी पड़ती है, तब इलेक्ट्रॉन बंधुता को ऋणात्मक माना जाता है तथा इलेक्ट्रॉन – बंधुता को परम शून्य ताप पर परिभाषित किया जाता है। इलेक्ट्रॉन बन्धुता तथा इलेक्ट्रॉन लब्धि एन्थैल्पी में निम्नलिखित सम्बन्ध होता है – ΔegH = – Ae – (frac { 5 }{ 2 } ) RT
इलेक्ट्रॉन लब्धि एन्थैल्पी को प्रभावित करने वाले कारक तथा आवर्तिता:
इलेक्ट्रॉन लब्धि एन्थैल्पी को प्रभावित करने वाले कारक निम्नलिखित हैं –
- परमाण्वीय आकार:
आवर्त सारणी में वर्ग में परमाणु आकार बढ़ने के कारण बाह्यतम कोश की नाभिक से दूरी बढ़ती है अतः जुड़ने वाले इलेक्ट्रॉन तथा परमाणु के नाभिक के मध्य आकर्षण बल कम होता है जिससे उत्सर्जित ऊर्जा का मान कम होता है। अर्थात् इलेक्ट्रॉन लब्धि एन्थैल्पी कम ऋणात्मक होती है। इसके विपरीत आवर्त में परमाणु आकार कम होने के कारण आने वाले इलेक्ट्रॉन पर नाभिकीय आकर्षण बल बढ़ता है अतः इलेक्ट्रॉन लब्धि एन्थैल्पी का मान बढ़ता है। - प्रभावी नाभिकीय आवेश:
प्रभावी नाभिकीय आवेश बढ़ने पर आने वाले इलेक्ट्रॉन तथा परमाणु के नाभिक के मध्य आकर्षण बढ़ता है जिससे इलेक्ट्रॉन के जुड़ने पर अधिक ऊर्जा मुक्त होती है अतः इलेक्ट्रॉन लब्धि एन्थैल्पी का मान बढ़ता है जैसा कि आवर्त सारणी के आवर्त में होता है। - परिरक्षण प्रभाव या आवरणी प्रभाव:
आन्तरिक कोशों में उपस्थित इलेक्ट्रॉनों का परिरक्षण प्रभाव, सामान्यतः नाभिकीय आकर्षण बल के विपरीत कार्य करता है अतः परिरक्षण प्रभाव बढ़ने पर, नाभिकीय आकर्षण बल कम हो जाता है। जिससे परमाणु में इलेक्ट्रॉन जुड़ने पर उत्सर्जित ऊर्जा का मान कम होता है अतः इलेक्ट्रॉन लब्धि एन्थैल्पी का मान भी कम होता है। - अर्धपूरित तथा पूर्णपूरित कक्षकों का स्थायित्व:
जज़ किसी तत्त्व का इलेक्ट्रॉनिक विन्यास अर्धपूरित या पूर्णपूरित होता है तो वह तुलनात्मक रूप से अधिक स्थायी होता है अतः इसमें इलेक्ट्रॉन जुड़ना मुश्किल होता है तथा उत्सर्जित ऊर्जा (इलेक्ट्रॉन लब्धि एन्थैल्पी) का मान भी कम होता है। लेकिन कुछ स्थितियों जैसे उत्कृष्ट गैसों में इलेक्ट्रॉन जुड़ने पर ऊर्जा का अवशोषण होता है। इसके विपरीत जब इलेक्ट्रॉन जुड़ने पर परमाणु अर्धपूरित या पूर्णपूरित स्थायी विन्यास प्राप्त करता है तो इलेक्ट्रॉन जुड़ना आसान होता है अतः इलेक्ट्रॉन लब्धि एन्थैल्पी का मान अपेक्षाकृत अधिक होता है।
इलेक्ट्रॉन लब्धि एन्थैल्पी से सम्बन्धित महत्त्वपूर्ण तथ्य:
- वर्ग में ऊपर से नीचे की ओर जाने पर इलेक्ट्रॉन लब्धि एन्थैल्पी का मान कम ऋणात्मक होता जाता है, क्योंकि परमाणु आकार बढ़ने के कारण जुड़ने वाला इलेक्ट्रॉन नाभिक से दूर होता है अतः इस पर नाभिकीय आकर्षण बल कम लगता है।
- सामान्यतः आवर्त सारणी के किसी आवर्त में बाएँ से दाएँ। जाने पर बढ़ते हुए परमाणु क्रमांक के साथ इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होती जाती है, क्योंकि प्रभावी नाभिकीय आवेश में वृद्धि होती है। अतः इलेक्ट्रॉन का जुड़ना आसान होता है तथा जुड़ने वाला इलेक्ट्रॉन नाभिक के पास होने के कारण इस पर नाभिकीय। आकर्षण बल अधिक लगता है।
- 17वें वर्ग के तत्त्वों (हैलोजन) की इलेक्ट्रॉन लब्धि एन्थैल्पी का मान अत्यधिक ऋणात्मक होता है, क्योंकि ये एक इलेक्ट्रॉन ग्रहण करके उत्कृष्ट गैस के समान स्थायी विन्यास प्राप्त कर लेते हैं।
- उत्कृष्ट गैसों की इलेक्ट्रॉन लब्धि एन्थैल्पी का मान अत्यधिक धनात्मक होता है, क्योंकि इनमें पूर्णपूरित स्थायी विन्यास पाया जाता है (ns2np6) अतः इलेक्ट्रॉन को उच्च ऊर्जा स्तर में प्रवेश करना पड़ेगा जो कि बहुत ही अस्थायी विन्यास होगा, क्योंकि इतनी दूरी पर नाभिकीय आकर्षण बल नहीं लग पाता है।
- क्षार धातुओं की इलेक्ट्रॉन लब्धि एन्थैल्पी का मान बहुत कम ऋणात्मक होता है क्योंकि इनमें इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति बहुत कम होती है।
- प्रथम वर्ग में हाइड्रोजन की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिकतम ऋणात्मक होती है क्योंकि यह एक इलेक्ट्रॉन ग्रहण कर हीलियम के समान स्थायी विन्यास प्राप्त कर लेता है।
- द्वितीय वर्ग के तत्त्व Be तथा Mg इत्यादि की इलेक्ट्रॉन लब्धि एन्थैल्पी का मान धनात्मक होता है अर्थात् इलेक्ट्रॉन जोड़ने पर ऊर्जा देनी पड़ती है क्योंकि इनमें क्रमशः बाह्यतम 2s2 तथा 3s2 कक्षक पूर्ण भरे हैं अतः आने वाला इलेक्ट्रॉन क्रमशः उच्च ऊर्जा के 2p तथा 3p कक्षक में प्रवेश करता है जिस पर नाभिकीय आकर्षण बल नहीं लग पाता है। इसलिए इनमें इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति नहीं होती है।
- नाइट्रोजन तथा फॉस्फोरस की इलेक्ट्रॉन लब्धि एन्थैल्पी क्रमशः कार्बन तथा सिलिकन की इलेक्ट्रॉन लब्धि एन्थैल्पी से कम ऋणात्मक होती है क्योंकि अर्धपूरित स्थायी विन्यास (2p3 तथा 3p3) होने के कारण इनमें इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति कम होती है, जबकि कार्बन तथा सिलिकन में एक इलेक्ट्रॉन जुड़ने पर अर्धपूरित स्थायी विन्यास प्राप्त होता है अतः ये आसानी से इलेक्ट्रॉन ग्रहण कर लेते हैं। यहाँ यह ध्यान देने योग्य है कि नाइट्रोजन के छोटे आकार के कारण इसकी इलेक्ट्रॉन लब्धि एन्थैल्पी तो धनात्मक होती है।
- द्वितीय आवर्त में B से F तक के तत्त्वों की इलेक्ट्रॉन लब्धि एन्थैल्पी का मान सम्बन्धित तृतीय आवर्त के तत्त्वों Al से Cl तक की तुलना में कम ऋणात्मक होता है जबकि वर्ग में नीचे जाने पर इलेक्ट्रॉन लब्धि एन्थैल्पी कम होती है। इसका कारण यह है कि द्वितीय आवर्त के तत्त्वों का आकार बहुत छोटा होता है अतः (n = 2) इनमें पहले से उपस्थित इलेक्ट्रॉन 2p कक्षक में होते हैं, जिनका आवेश घनत्व अधिक होता है।
- इस कारण ये आने वाले इलेक्ट्रॉन को प्रतिकर्षित करते हैं, इसलिए इनमें इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति कम होती है; जबकि तृतीय आवर्त के इन तत्त्वों के बड़े आकार (n = 3) के कारण ये आने वाला इलेक्ट्रॉन 3p कक्षक में जाता है, जिसका आवेश घनत्व कम होने के कारण यह इलेक्ट्रॉन को कम प्रतिकर्षित करते हैं। इसलिए इनमें इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति अधिक होती है। अतः फ्लुओरीन (F) की इलेक्ट्रॉन लब्धि एन्थैल्पी क्लोरीन (Cl) से कम होती है। इसी कारण आवर्त सारणी में अधिकतम ऋणात्मक इलेक्ट्रॉन लब्धि एन्थैल्पी क्लोरीन की होती है।
All Chapter RBSE Solutions For Class 11 Chemistry Hindi Medium
—————————————————————————–
All Subject RBSE Solutions For Class 11 Hindi Medium
*************************************************
————————————————————
All Chapter RBSE Solutions For Class 11 Chemistry Hindi Medium
All Subject RBSE Solutions For Class 11 Hindi Medium
Remark:
हम उम्मीद रखते है कि यह RBSE Class 11 chemistry Solutions in Hindi आपकी स्टडी में उपयोगी साबित हुए होंगे | अगर आप लोगो को इससे रिलेटेड कोई भी किसी भी प्रकार का डॉउट हो तो कमेंट बॉक्स में कमेंट करके पूंछ सकते है |
यदि इन solutions से आपको हेल्प मिली हो तो आप इन्हे अपने Classmates & Friends के साथ शेयर कर सकते है और HindiLearning.in को सोशल मीडिया में शेयर कर सकते है, जिससे हमारा मोटिवेशन बढ़ेगा और हम आप लोगो के लिए ऐसे ही और मैटेरियल अपलोड कर पाएंगे |
आपके भविष्य के लिए शुभकामनाएं!!