हेलो स्टूडेंट्स, यहां हमने राजस्थान बोर्ड कक्षा 11वीं की रसायन विज्ञान सॉल्यूशंस को दिया हैं। यह solutions स्टूडेंट के परीक्षा में बहुत सहायक होंगे | Student RBSE solutions for Class 11 Chemistry Chapter 5 गैस एवं द्रव pdf Download करे| RBSE solutions for Class 11 Chemistry Chapter 5 गैस एवं द्रव notes will help you.
Table of Contents
Rajasthan Board RBSE Class 11 Chemistry Chapter 5 द्रव्य की अवस्थाएँ: गैस एवं द्रव
RBSE Class 11 Chemistry Chapter 5 पाठ्यपुस्तक के अभ्यास प्रश्न
RBSE Class 11 Chemistry Chapter 5 वस्तुनिष्ठ प्रश्न
प्रश्न 1.
आदर्श गैस समीकरण में R की विमा है –
(अ) mole atom K-1
(ब) lit mole
(स) erg K-1
(द) lit atm K-1 mole-1
प्रश्न 2.
वह ताप व दाब जिस पर बर्फ, जल और जलवाष्प एक साथ अस्तित्व में होते हैं –
(अ) 0°C, 1 atm
(ब) 0°C, 4.7 mm
(स) 2°C, 4.7 atm
(द) – 2°C, 4.7 mm
प्रश्न 3.
निम्नलिखित में से किस गैस की विसरण दरें अधिकतम हैं –
(अ) NH3
(ब) N2
(स) CO2
(द) O2
प्रश्न 4.
यदि एक आदर्श गैस के दो मोल 546 K ताप पर हैं, उनका आयतन 44.8 लीटर है, तो उनका दाब होगा –
(अ) 2 atm
(a) 1 atm
(स) 4 atm
(द) 3 atm
प्रश्न 5.
यदि एक आदर्श गैस का परम ताप दुगुना और दाब आधा हो जाता है तो गैस का आयतन हो जायेगा –
(अ) दुगुना
(ब) चार गुना
(स) चौथाई
(द) अपरिवर्तित
उत्तरमाला:
1. (द)
2. (ब)
3. (अ)
4. (अ)
5. (ब)
RBSE Class 11 Chemistry Chapter 5 अतिलघूत्तरात्मक प्रश्न
प्रश्न 6.
क्वथनांक एवं वाष्पीकरण प्रक्रिया में क्या अंन्तर है?
उत्तर:
क्वथनांक वह ताप है जिस पर किसी द्रव का वाष्प दाब बाह्य दाब (वायुमण्डलीय दाब) के बराबर होता है। जबकि वाष्पीकरण एक धीमा प्रक्रम है जो सभी तापों पर स्वतः होता है।
प्रश्न 7.
दाब बढ़ाने पर द्रव का क्वथनांक क्यों बढ़ जाता है?
उत्तर:
किसी द्रव का क्वथनांक वह ताप है जिस पर उसका वाष्प दाब, बाह्य दाब के बराबर हो जाता है। जब दाब बढ़ाते हैं तो द्रव का वाष्प दाब को इस बाह्य दाब के बराबर करने के लिए अधिक ऊर्जा की आवश्यकता होती है अर्थात् द्रव को अधिक गर्म करना पड़ता है जिससे उसका क्वथनांक बढ़ जाता है।
प्रश्न 8.
किसी गैस के लिए वाण्डर वाल स्थिरांक ‘a’ का शून्य मान क्या दर्शाता है?
उत्तर:
‘a’ का मान शून्य होने पर उस गैस का द्रवण नहीं होगा क्योंकि ‘a’ का मान शून्य होने पर उस गैस के अणुओं के मध्य आकर्षण नहीं होता है।
प्रश्न 9.
ताप का कैल्विन पैमाना, सेल्सियस पैमाने की अपेक्षा अधिक बेहतर क्यों होता है?
उत्तर:
कैल्विन पैमाने में ऋणात्मक वेल्यू नहीं होती है जबकि सेल्सियस में ऋणात्मक वेल्यू होती है एवं बहुत से आंकिक प्रश्नों में ताप की ऋणात्मक वेल्यू से सही उत्तर नहीं आते हैं एवं आदर्श गैस नियम व अन्य गैस नियमों में absolute temperature (परमताप) होता है जो कि कैल्विन में होता है।
प्रश्न 10.
पहाड़ी स्टेशन पर सब्जियाँ कठिनाई से क्यों पकती हैं?
उत्तर:
पहाड़ों पर वायु दाब कम होता है अतः जल कम ताप पर उबलता है जिससे जल का क्वथनांक कम हो जाता है जिससे सब्ज़ियाँ कठिनाई से पकती हैं।
प्रश्न 11.
किसी गैस को परम शून्य ताप पर ठण्डा क्यों नहीं किया जा सकता है?
उत्तर:
क्योंकि इसे ताप के आने से पहले ही गैस द्रवित हो जाती हैं।
प्रश्न 12.
दाब का SI मात्रक क्या है?
उत्तर:
दाब का SI मात्रक Pa या Nm-2 होता है।
प्रश्न 13.
किसी गैस के लिए संपीड्यता गुणांक Z का मान एक से कम क्यों होता है?
उत्तर:
संपीड्यता गुणांक गैस के वास्तविक मोलर आयतन तथा उसी ताप व दाब पर आदर्श गैसों के मोलर आयतन का अनुपात होता है।
प्रश्न 14.
लॉयल ताप किसे कहते हैं?
उत्तर:
वह ताप जिस पर कोई वास्तविक गैस दाब की पर्याप्त मात्रा पर आदर्श गैस के समान व्यवहार करती है उसे लॉयल ताप कहते हैं।
प्रश्न 15.
जल एवं ग्लिसरीन में से किसकी श्यानता अधिक है। और क्यों?
उत्तर:
ग्लिसरीन में अपेक्षाकृत प्रबल हाइड्रोजन बन्ध होता है। अतः इसकी श्यानता जल से अधिक होती है।
प्रश्न 16.
सामान्य ताप व दाब की स्थिति में आदर्श गैस का मोलर आयतन क्या होता है?
उत्तर:
22.4 dm3
प्रश्न 17.
यदि स्थिर ताप पर वायुमण्डलीय दाब 20 सेमी3 गैस 50 सेमी3 तक फैलती है तब उसका अन्तिम दाब क्या होगा?
उत्तर: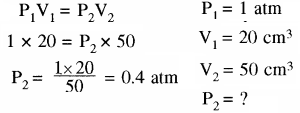
प्रश्न 18.
NH3 एवं HCl गैसों का मिश्रण डाल्टन के आंशिक दाब के नियम का पालन नहीं करता, क्यों?
उत्तर:
HCl एवं NH3 को मिलाने पर वे अभिक्रिया करके NH4Cl का निर्माण कर लेती हैं जो एक ठोस पदार्थ है जो कि डाल्टन के नियम का पालन नहीं करता है।
NH3 + HCl → NH4Cl
प्रश्न 19.
किन दो परिस्थितियों में आदर्श व्यवहार से वास्तविक गैसें अधिकतम विचलन दर्शाती हैं?
उत्तर:
निम्न ताप एवं उच्च दाब पर।
प्रश्न 20.
273 K ताप एवं 1 atm दाब पर 0.5 मोल गैस का आयतन कितना होगा?
उत्तर: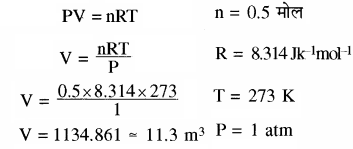
RBSE Class 11 Chemistry Chapter 5 लघूत्तरात्मक प्रश्न
प्रश्न 21.
द्रव की बूंदें गोल आकार ग्रहण कर लेती हैं, क्यों?
उत्तर:
पृष्ठ तनाव के कारण द्रव न्यूनतम पृष्ठ क्षेत्रफल ग्रहण करना चाहता है। चूंकि दिए गए आयतन के लिए गोले का पृष्ठ क्षेत्रफल न्यूनतम होता है अतः द्रव की बूंदें गोल होती हैं। इसी कारण द्रव बूंदें निम्नतम ऊर्जा स्तर पर गोलाकार होती हैं।
प्रश्न 22.
पृष्ठ तनाव पर ताप का क्या प्रभाव पड़ता है?
उत्तर:
ताप बढ़ाने परे द्रव का पृष्ठ तनाव कम हो जाता है, क्योंकि ताप बढ़ाने से अणुओं की गतिज ऊर्जा बढ़ जाती है तथा अणुओं के बीच अन्तःक्रिया कम प्रभावी हो जाती है। अतः ताप बढ़ाने पर पृष्ठ तनाव कम हो जाता है।
प्रश्न 23.
दव का क्वथनांक दाब बढ़ाने से परिवर्तित होता है, क्यों?
उत्तर:
किसी द्रव का क्वथनांक वह ताप होता है जिस पर उनका वाष्प दाब बाह्य दाब के बराबर हो जाता है। जब दाब बढ़ाते हैं तो द्रव के वाष्प दाब को इस बाह्य दाब के बराबर करने के लिए अधिक ऊर्जा की आवश्यकता होती है अर्थात् द्रव को अधिक गर्म करना पड़ता है। जिससे उसका क्वथनांक बढ़ जाता है।
प्रश्न 24.
ऐथेनॉल की श्यानता ईथर से अधिक क्यों है?
उत्तर:
जिन पदार्थों में हाइड्रोजन बन्ध होते हैं वे आसानी से नहीं बहते हैं क्योंकि हाइड्रोजन बन्ध के कारण उनके अणु अधिक पास-पास होते हैं। ऐथेनॉल में हाइड्रोजन बन्ध होते हैं जबकि ईथर के अणुओं के मध्य वाण्डर वाल बल होते हैं एवं हाइड्रोजन बन्ध वाण्डरवाल बल से अधिक प्रबल होते हैं। इसी कारण ऐथेनॉल की श्यानता ईथर से अधिक होती है।
प्रश्न 25.
वाण्डरवाल स्थिरांक a एवं b की भौतिक सार्थकता क्या है?
उत्तर:
वाण्डरवाल स्थिरांक a को मान गैस के अणुओं के मध्य आकर्षण बल की प्रबलता का माप है अतः a का मान अधिक होने पर अन्तराण्विक आकर्षण बल अधिक होगा। यह ताप एवं दाब पर निर्भर नहीं करता है। वाण्डरवाल स्थिरांक b को सह आयतन कहते हैं। यह गैस के अणुओं का प्रभावी आकार बताता है। इसका मान गैस के अणुओं के वास्तविक आयतन का चार गुना होता है।
प्रश्न 26.
CO2 एवं CH4 गैसों के क्रान्तिक ताप क्रमशः 31.1°C तथा – 81.9°C हैं। दोनों में से किसमें प्रबल अन्तराण्विक बल है एवं क्यों?
उत्तर:
गैस का क्रान्तिक ताप जितना अधिक होता है उसक द्रवीकरण उतना ही आसानी से होता है अर्थात् अणुओं में अन्तराअणुक आकर्षण बल प्रबल होगा चूँकि CO2 का क्रान्तिक ताप (31.1°C) CH4 के क्रान्तिक ताप (- 81.9°C) से अधिक है अत: CO2 में अणुओं के मध्य आकर्षण बल CH4 से अधिक है। यद्यपि CO2 तथा CH4 दोनों ही अध्रुवीय हैं लेकिन CO2 का मोलर द्रव्यमान CH4 से अधिक होने के कारण इसके अणुओं के मध्य आकर्षण बल अधिक होता है।
प्रश्न 27.
गैसों के क्रान्तिक ताप किसे कहते हैं?
उत्तर:
वह अधिकतम ताप जिस पर कोई गैस पर्याप्त दाब लगा। से द्रव अवस्था में परिवर्तित हो जाती है उसे क्रान्तिक ताप कहते हैं।
प्रश्न 28.
बॉयल के नियम को परिभाषित कीजिए।
उत्तर:
बॉयल का नियम –
स्थिर ताप पर किसी गैस की निश्चित मात्रा (मोलों की संख्या) का दाब, उसके आयतन के व्युत्क्रमानुपाती होता है।
गणितीय रूप से –
![]()
= समानुपातिक स्थिरांक
[PV = k1] अर्थात् स्थिर ताप पर गैस की निश्चित मात्रा के आयतन तथा दाब का गुणनफल स्थिर होता है। स्थिरांक k1 का मान, गैस की मात्रा, ताप तथा P तथा V की इकाइयों पर निर्भर करता है। यदि किसी गैस की निश्चित मात्रा को स्थिर ताप T पर दाब P1 तथा आयतन V1 से प्रसारित किया जाता है (जिससे आयतन V2 तथा दाब P2 हो जाए), तो बॉयल के नियमानुसार
P1V1= P2V2 = स्थिरांक
अतः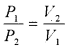
प्रश्न 29.
आर्गन एवं क्रिप्टोन में किसका क्वथनांक अधिक होगा एवं क्यों?
उत्तर:
क्रिप्टोन का क्वथनांक आर्गन से अधिक होता है क्योंकि क्रिप्टोन का आकार आर्गन से अधिक होता है एवं आकार बढ़ने के साथ-साथ वाण्डरवाल बल बढ़ता है अतः अधिक वाण्डरवाल वाले। क्रिप्टोन को अधिक ताप की आवश्यकता होती है।
प्रश्न 30.
HCl जैसे ध्रुवीय अणुओं के मध्य कौनसा बल लगता है?
उत्तर:
HCl जैसे अणुओं के मध्य द्विध्रुव – द्विध्रुव आकर्षण बल लगता है, जो एक प्रकार का वाण्डरवाल बल है। अर्थात् वे अणु जिनमें स्थायी द्विध्रुव होता है उनमें एक अणु का आंशिक धनावेशित सिरा दूसरे अणु के आंशिक ऋणावेशित सिरे को अपनी ओर आकर्षित करता है, इसे द्विध्रुव – द्विध्रुव आकर्षण कहते हैं।
प्रश्न 31.
आदर्श गैस नियम एवं समीकरण लिखिए।
उत्तर:
आदर्श गैस (Ideal Gas):
वह काल्पनिक गैस जो सभी गैस नियमों (बॉयल का नियम, चार्ल्स का नियम तथा आवोगादो नियम) का पूर्ण रूप से पालन करती है, उसे आदर्श गैस कहते हैं। इसमें ऐसा माना जाता है कि अणुओं के मध्य अंतरा-अणुक बल नगण्य होते हैं। वास्तविक गैस केवल विशेष परिस्थितियों में ही गैस नियमों का पालन करती है जब अन्योन्य बल प्रायोगिक रूप से नगण्य होते हैं। अन्य सभी परिस्थितियों में ये आदर्श व्यवहार से विचलन दर्शाती हैं।
बॉयल के नियम से V α (frac { 1 }{ P } )
चार्ल्स के नियम से V α T
आवोगाद्रो के नियम में V α n
V α(frac { n{ T } }{ P } )
V = R (frac { n{ T } }{ P } )
या PV = nRT
R = समानुपातिक स्थिरांक या गैस स्थिरांक
प्रश्न 32.
यदि एक आदर्श गैस के दो मोल 546 K ताप पर हैं उनका आयतन 44.8 लीटर है तो उनको दाब क्या होगा?
उत्तर:
प्रश्न 33.
डाल्टन का आंशिक दाब को नियम क्या है?
उत्तर:
दो या दो से अधिक अक्रियाशील गैसों के मिश्रण को एक बन्द पात्र में लेने पर मिश्रण का कुल दाब प्रत्येक गैस के आंशिक दाब के योग के बराबर होता है।
P कुल = P1 + P2 + P3 +……….. (स्थिर ताप व आयतन पर)
P1, P2, तथा P3 भिन्न – भिन्न गैसों के आंशिक दाब हैं।
प्रश्न 34.
किसी गैसीय मिश्रण में O2 एवं N2 का भार के अनुसार अनुपात 1 : 4 है तो उनकी संख्या का अनुपात कितना होगा?
उत्तर:
माना ऑक्सीजन का भार 32 ग्राम है अतः नाइट्रोजन का भार 4 × 32 = 128 ग्राम होगा क्योंकि O2 एवं N2 के भार का अनुपात 1 : 4 है अत: O2 के मोल (frac { 32 }{ 32 } ) = 1
एवं N2 के मोल = (frac { 128 }{ 28 } ) = 4.57
अत: O2 एवं N2 की संख्याओं का अनुपात 1 : 4.57 या 7 : 32 होगा।
प्रश्न 35.
पृष्ठ तनाव किसे कहते हैं?
उत्तर:
द्रव की सतह पर खींची गई एक रेखा की एकांक लम्बाई पर लगने वाले लम्बवत् बल को पृष्ठ तनाव कहते हैं। इसकी इकाई Kg s-2 तथा SI मात्रक में Nm-1 होती है। किसी द्रव की निम्नतम ऊर्जा स्तर तब होता है जब उसका पृष्ठ क्षेत्रफल न्यूनतम हो। किसी द्रव के पृष्ठ क्षेत्रफल में एकांक वृद्धि करने के लिए आवश्यक ऊर्जा को पृष्ठीय ऊर्जा कहते हैं। इसकी इकाई Jm-2 होती है।
RBSE Class 11 Chemistry Chapter 5 निबन्धात्मक प्रश्न
प्रश्न 36.
निम्नलिखित पर टिप्पणी लिखिये –
1. श्यानता।
उत्तर:
श्यानता (Viscosity):
श्यानता द्रवों का अभिलाक्षणिक गुण होता है। हम जानते हैं कि सभी द्रव समान वेग से नहीं बहते हैं। कुछ द्रव आसानी से बहते हैं। जबकि कुछ द्रव मुश्किल से बहते हैं। आसानी से बहने वाले द्रवों में जल, ऐल्कोहॉल, ईथर तथा बेन्जीन मुख्य हैं जबकि मुश्किल से बहने वाले द्रव शहद, ग्लिसरीन तथा सान्द्र सल्फ्यूरिक बल हैं। जब द्रव का प्रवाह होता है तो उसकी परतें एक – दूसरे के ऊपर से गुजरती हैं जिससे उनके मध्य घर्षण बल उत्पन्न होता है। इस घर्षण बल का माप ही श्यानता कहलाता है अर्थात् किसी द्रव के प्रवाह के प्रति उत्पन्न आन्तरिक प्रतिरोध को श्यानता कहते हैं।
जब द्रव का प्रवाह किसी स्थिर सतह पर होता है, तो द्रव की वह परत, जो सतह के सम्पर्क में होती है, स्थायी हो जाती है। जैसे – जैसे स्थायी परत से ऊपर वाली परतों की दूरी बढ़ती जाती है, वैसे – वैसे परत का वेग भी बढ़ता जाता है। अतः इस प्रकार का प्रवाह, जिसमें एक परत से दूसरी परत का वेग क्रमशः बढ़ता जाता है, स्तरीय प्रवाह’ (Laminar Flow) कहलाता है। यदि हम प्रवाहित द्रव में किसी भी परत को लें, तो उससे ऊपरी परत इसका वेग बढ़ाती है, जबकि निचली परत से वेग कम होता है।
इस प्रकार द्रव की परतों की आपेक्षिक गतियों को प्रभावित करने वाले घर्षण बल सम्पर्क युक्त परतों के क्षेत्रफल तथा दो परतों के बीच वेग प्रवणता के समानुपाती होता है। मानक दूरी पर स्थित द्रव की दो परतों के बीच वेग परिवर्तन को वेग प्रवणता (Velocity gradient) कहते हैं।
माना, परतों के सम्पर्क का क्षेत्रफल A है तथा वेग – प्रवणता (frac { d{ U } }{ d{ Z } } ) है तो घर्षण बल (F)
F ∝ (frac { d{ U } }{ d{ Z } } )
F ∝ A (frac { d{ U } }{ d{ Z } } )
यहाँ dU = परत के वेग में परिवर्तन
तथा dZ = परतों के बीच की दूरी अतः वेग प्रवणता (frac { d{ U } }{ d{ Z } } ) दूरी के साथ वेग में परिवर्तन है।
F = ηA (frac { d{ U } }{ d{ Z } } ) यहाँ η एक समानुपातिक स्थिरांक है जिसे श्यानता गुणांक कहते हैं जिसे सामान्यतः श्यानता कहा जाता है। यह द्रव की प्रकृति तथा ताप पर निर्भर करता है।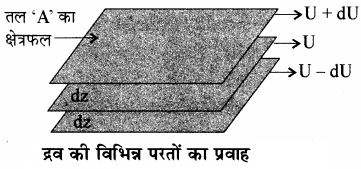
यदि A = 1 cm2 तथा (frac { d{ U } }{ d{ Z } } ) = 1
तो F = η
अतः किसी द्रव में एक सेमी. दूरी पर स्थिर दो समानान्तर परतों के वेग में इकाई अन्तर बनाये रखने के लिए प्रति इकाई क्षेत्रफल पर लगने वाले बल को श्यानता गुणांक कहते हैं।
तरलता (Fluidity) (Φ):
श्यानता गुणांक के व्युत्क्रम को तरलता कहते हैं। अतः
Φ = (frac { 1 }{ eta } )
श्यानता गुणांक की इकाई:
1. CGS मात्रक में – dyne cm-2 sec. या gm cm-1 sec-1 या पॉयज (Poise)
2. SI मात्रक में – Nm-2 sec. (न्यूटन सेकण्ड प्रति वर्गमीटर) या kg m-1 s-1 याPas (पास्कल सेकण्ड)
1 Poise = 1 gm cm-1 s-1 = 10-3 kg-1 102 m-1 s-1
= 10-1 kg m-1 s-1
= 0.1 Pas
अतः 1 Poise = 0.1 Pas (पास्कल सेकण्ड)
श्यानता पर ताप का प्रभाव:
ताप बढ़ाने पर श्यानता कम होती है क्योंकि ताप के बढ़ने : पर अणुओं की गतिज ऊर्जा बढ़ जाती है जिससे अन्तराअणुक बल कम हो जाते हैं, अत: द्रव की परतें आसानी से फिसल जाती हैं।
श्यानता के सम्बन्ध में महत्त्वपूर्ण बिन्दु:
- जिन द्रवों की श्यानता अधिक होती है उनका प्रवाह बहुत धीरे होता है।
- द्रव के अणुओं के मध्य अन्तर-आण्विक आकर्षण बल (वान्डरवाल बल) बढ़ने पर श्यानता बढ़ती है।
- हाइड्रोजन बन्ध, सामान्यतः वान्डरवाल बल से प्रबल होता है, अत: जिन यौगिकों में हाइड्रोजन बन्ध पाया जाता है उनकी श्यानता अधिक होती है जैसे सान्द्र H2SO4, ग्लिसरॉल, (ग्लिसरीन) इत्यादि।
- जल में अन्य पदार्थ मिलाने पर इसकी श्यानता में परिवर्तन होता है। जल में कोई आयनिक यौगिक जैसे NaCl इत्यादि मिलाया जाता है तो जल की श्यानता कम हो जाती है जबकि उच्च अणुभार वाले सहसंयोजी यौगिक (जैसे शर्करा) या कोई बहुलक मिलाने पर जल की श्यानता बढ़ जाती है।
- काँच एक अति चिपचिपा द्रव होता है तथा इसकी श्यानता इतनी अधिक होती है कि इसके अधिकांश गुण ठोसों से मिलते हैं। काँच के प्रवाह के इस गुण के कारण पुरानी इमारतों की खिड़कियों के पलड़े के काँच की मोटाई शीर्ष की तुलना में पेंदे पर अधिक होती है।
श्यानता का मापन:
किसी द्रव की श्यानता का मापन सामान्यतः ओस्टवाल्ड विस्कोमीटर द्वारा किया जाता है तथा इसे ज्ञात करने के लिए निम्न सूत्र प्रयुक्त किया जाता है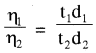
यहाँ η1 = जल की विस्कासिता
η2 = दिए गए द्रव की विस्कासिता
d1 = जल का घनत्व
d2 = द्रव का घनत्व
t1 = प्रयोग के दौरान जल के बहने में लगा समय
t2 = प्रयोग के दौरान द्रव के बहने में लगा समय
2. वाष्प दाब।
उत्तर:
वाष्प दाब (Vapour Pressure):
एक निर्वातित पात्र को जब किसी द्रव से आंशिक रूप से भरा जाता है, तो द्रव का कुछ भाग वाष्पीकृत होकर पात्र के खाली भाग को भर देता है। प्रारम्भ में द्रव का वाष्पन होता है तथा वाष्प बनती है। इस वाष्प के द्वारा द्रव की सतह पर दाब लगता है जो कि धीरे – धीरे बढ़ता है। कुछ समय पश्चात् यह स्थिर हो जाता है तथा द्रव-अवस्था एवं वाष्प – अवस्था के मध्य साम्य स्थापित हो जाता है। इस अवस्था में वाष्पदाब साम्य वाष्पदाब अथवा संतृप्त वाष्पदाब कहलाता है। अतः स्थिर ताप पर जब कोई द्रव तथा उसकी वाष्प साम्य अवस्था में होते हैं तो इस स्थिति में वाष्प द्वारा, द्रव की सतह पर लगाया गया दाब, उस द्रव का वाष्प दाब कहलाता है।![]()
संघनन की दर वाष्प के अणुओं की सान्द्रता के अनुक्रमानुपाती होती है। यह साम्य गतिक होता है। इस पर वाष्प व द्रव दोनों की सान्द्रता स्थिर होती है।
वाष्प दाब एवं तापक्रम:
जब द्रव का ताप बढ़ाया जाता है तो उच्च गतिज ऊर्जा वाले अणुओं की संख्या बढ़ जाती है जिससे वे वाष्प प्रावस्था में परिवर्तित हो जाते हैं। अतः ताप में वृद्धि के साथ वाष्प दाब बढ़ता है वाष्प दाब पर ताप के प्रभाव को दाब – ताप आरेख से प्रदर्शित करते हैं। जब द्रव को खुले पात्र में गरम किया जाता है तो वह अपनी सतह से वाष्पीकृत होता है लेकिन जब द्रव का वाष्प दाब बाह्य दाब के समान हो जाता है, तब पूरे द्रव का वाष्पीकरण होने लगता है तथा वाष्प अपने चारों ओर के वातावरण में स्वतंत्र रूप से प्रसारित होती है।
सम्पूर्ण द्रव के मुक्त वाष्पीकरण की स्थिति को ‘उबलना’ कहते हैं तथा वह ताप जिस पर किसी द्रव का वाष्प दाब, बाह्य दाब (वायुमण्डलीय दाब) के समान हो जाता है इसे उस दाब पर द्रव का क्वथनांक कहते हैं। एक वायुमण्डलीय दाब पर द्रव के क्वथनांक को सामान्य क्वथनांक तथा जब दाब एक bar होता है तो इस क्वथनांक को मानक क्वथनांक कहते हैं।
किसी द्रव का मानक क्वथनांक सामान्य क्वथनांक से कुछ कम होता है क्योंकि एक bar दाब एक वायुमण्डलीय दाब से कुछ कम होता है, अतः जल का सामान्य क्वथनांक 100°C (373K) होता है जबकि मानक क्वथनांक 99.6°C (372.6K) होता है।
क्रांतिक दाब:
जब हम द्रव को बन्द पात्र में उबालते हैं तो उसका क्वथन नहीं होता है तथा इसे लगातार गर्म करने पर वाष्प दाब बढ़ता है। प्रारम्भ में द्रव तथा वाष्प के बीच एक स्पष्ट सीमा रेखा दिखाई देती है, जैसे – जैसे ताप बढ़ाते हैं तो अधिकं वाष्प बनने के कारण घनत्व बढ़ता जाता है तथा एक स्थिति में द्रव तथा वाष्प का घनत्व समान हो जाता है तब द्रव तथा वाष्प के बीच की सीमा रेखा गायब हो जाती है। इस ताप को क्रान्तिक ताप कहते हैं।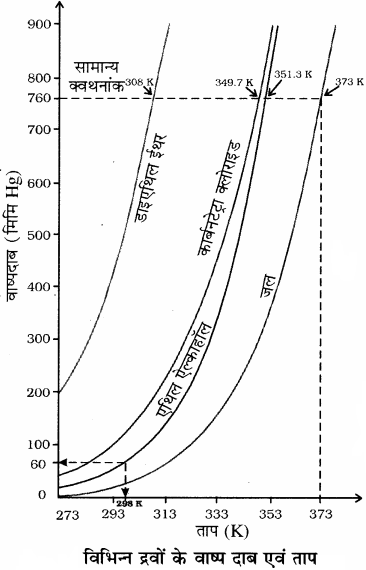
उच्च उन्नतांश (Altitudes) पर वायुमण्डलीय दाब कम होता है, अतः समुद्रतल की तुलना में उच्च उन्नतांश पर द्रव कम ताप पर ही उबल जाता है अर्थात् उसका क्वथनांक कम हो जाता है। पहाड़ों पर जल कम ताप पर उबलता है अतः भोजन को पकाने के लिए प्रेशर कुकर का इस्तेमाल करना अधिक अच्छा रहता है क्योंकि इसमें दाब अधिक होने के कारण जल का क्वथनांक बढ़ जाता है। इस कारण भोजन जल्दी पक जाता है। चिकित्सालयों में शल्य – क्रिया में प्रयुक्त किये जाने वाले उपकरणों को ऑटोक्लेव में उबालकर रोगाणुरहित किया जाता है, क्योंकि ऑटोक्लेव पर भार रखकर दाब बढ़ाने से उसमें स्थित जल का क्वथनांक बढ़ जाता है।
वाष्प दाब को प्रभावित करने वाले कारक:
- द्रव की प्रकृति: वे द्रव जो अध्रुवीय होते हैं वे अधिक वाष्पशील होते हैं अतः उनका वाष्प दाब अधिक होता है जैसे कार्बन टेट्राक्लोराइड। लेकिन ध्रुवीय द्रवों की वाष्पशीलता कम होती है, अतः उनका वाष्प दाब भी कम होता है। जैसे – जल। कुछ द्रवोंके वाष्प दाब का क्रम निम्न प्रकार होता है –

- ताप: ताप बढ़ाने पर द्रव का वाष्प दाब बढ़ता है क्योंकि अणुओं की गतिज ऊर्जा बढ़ती है अतः द्रवों का वाष्पीकरण आसानी से होता है।
- अवाष्पशील विलेय मिलाने पर: किसी द्रव में अवाष्पशील विलेय मिलाने पर उसका वाष्प दाब कम हो जाता है।
वाष्प दाब के मापन की निम्नलिखित विधियाँ होती हैं –
- स्थैतिक विधि
- गतिक विधि
- गैस संतृप्त विधि
3. हाइड्रोजन बन्ध।
उत्तर:
हाइड्रोजन आबन्ध:
हाइड्रोजन बन्ध, द्विध्रुव – द्विध्रुव आकर्षण की एक विशेष स्थिति होती है। यह बन्ध अधिक ध्रुवीय बन्धों (N – H, O – H या H – F) युक्त अणुओं में पाया जाता है। यद्यपि हाइड्रोजन बन्ध N, O तथा F युक्त अणुओं में पाया जाता है लेकिन Cl जैसे परमाणु भी O या F के साथ हाइड्रोजन बन्ध बना लेते हैं। अतः हाइड्रोजन बन्ध वह आकर्षण बल है जो एक अणु के हाइड्रोजन परमाणु को दूसरे अणु के विद्युत ऋणी परमाणु ( F, O या N ) से जोड़ता है।
उदाहरण:
H+δ – F-δ …… H+δ – F-δ …… H+δ – F-δ ……
हाइड्रोजन बन्ध एक दुर्बल आकर्षण बल है अत: इसकी ऊर्जा 10 – 100 kJ mol-1 होती है। ऊर्जा की यह मात्रा एक सार्थक मात्रा है अतः प्रोटीन तथा न्युक्लिक अम्ल जैसे महत्त्वपूर्ण यौगिकों की संरचना तथा गुणों का निर्धारण भी हाइड्रोजन बन्ध की सहायता से किया जाता है। दो अणुओं के मध्य हाइड्रोजन बन्ध बिन्दुकित रेखा (….) द्वारा प्रदर्शित किया जाता है। हाइड्रोजन बन्ध के कारण पदार्थों की भौतिक अवस्था क्वथनांक, वाष्पन की ऊष्मा आदि भौतिक गुणों में परिवर्तन हो जाता है।
हाइड्रोजन बन्ध दो प्रकार के होते हैं –
1. अन्तराण्विक हाइड्रोजन बन्ध:
यह बन्ध दो या दो से अधिक समान या भिन्न – भिन्न अणुओं के मध्य बनता है।
उदाहरण:
जंल, अमोनिया आदि।
2. अन्तःअणुक हाइड्रोजन बन्ध:
यह बन्ध एक ही आण्विक संरचना के दो परमाणुओं के मध्य बनता है।
उदाहरण: O – नाइट्रोफिनॉल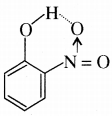
हाइड्रोजन बन्ध के कारण यौगिकों के भौतिक गुणों में बहुत अधिक परिवर्तन हो जाता है। परिवर्तित होने वाले मुख्य भौतिक गुण निम्न प्रकार है –
(अ) गलनांक व क्वथनांक: जिन अणुओं में हाइड्रोजन बन्ध पाया जाता है उनके गलनांक एवं क्वथनांक उच्च होते हैं।
(ब) विलेयता: वे यौगिक जो जल के साथ हाइड्रोजन बन्ध बनाते हैं उनकी जल में विलेयता अधिक होती है।
उदाहरण: एल्कोहल, शर्करा आदि।
(स) हाइड्रोजन बन्ध की उपस्थिति के कारण भौतिक अवस्था प्रभावित होती है। यही कारण है कि एल्कोहॉल अवाष्पशील द्रव है और ईथर वाष्पशील द्रव है।
(द) हाइड्रोजन बन्ध की उपस्थिति यौगिकों की अम्लता व क्षारकता को प्रभावित करती है।
प्रश्न 37.
गैसों के द्रवीकरण को कार्बन डाई ऑक्साइड के समतापी आरेखों द्वारा समझाइये एवं गैसों की दवीकरण की विधि लिखिये।
उत्तर:
क्रान्तिक घटनाएँ (Critical Phenomenon) तथा समतापी वक्र( Isotherms):
गैसों के अणु निरन्तर गतिशील होते हैं तथा एक – दूसरे से पर्याप्त दूरी पर होते हैं। ताप में कमी तथा दाब में वृद्धि करके सभी गैसों को द्रवित किया जा सकता है। क्योंकि इस स्थिति में गैसों की गतिज ऊर्जा कम हो जाती है। अतः अणुओं के मध्य आकर्षण बल बढ़ जाता है तथा अणु एक – दूसरे के पास आ जाते हैं तथा गैस द्रवित हो जाती है।
गैसों के द्रवीकरण में दाब की तुलना में ताप का प्रभाव अधिक महत्त्वपूर्ण होता है क्योंकि सभी गैसों को वायुमण्डलीय दाब पर तो द्रवित किया जा सकता है लेकिन कमरे के ताप पर सभी गैसों को द्रवित नहीं किया जा सकता है।
एन्ड्रज ने 1869 में CO2पर प्रयोग करके यह निष्कर्ष निकाला कि प्रत्येक गैस के लिए एक ताप होता है जिसके नीचे तो उस गैस को द्रवित किया जा सकता है लेकिन उसके ऊपर उस गैस को द्रवित नहीं किया जा सकता चाहे दाब कितना ही अधिक क्यों न लगा दिया जाए। इस ताप को गैस का क्रान्तिक ताप कहा जाता है।
- क्रान्तिक ताप (T): वह अधिकतम ताप जिस पर कोई गैस पर्याप्त दाब लगाने से द्रव अवस्था में परिवर्तित हो जाती है, उसे क्रान्तिक ताप कहते हैं। इससे अधिक ताप पर यह गैस ही होगी।
- क्रान्तिक दाब (P): किसी गैस को उसके क्रान्तिक ताप पर द्रवित करने के लिए आवश्यक न्यूनतम दाब को उस गैस का क्रान्तिक दाब कहते हैं।
- क्रान्तिक आयतन (Vc): क्रान्तिक ताप तथा क्रान्तिक दाबे पर किसी गैस के एक मोल का आयतन क्रान्तिक आयतन कहलाता है।
- क्रान्तिक स्थिरांक (Cc): क्रान्तिक ताप, क्रान्तिक दाब तथा क्रान्तिक आयतन को सम्मिलित रूप से क्रान्तिक स्थिरांक कहते हैं।
प्रत्येक गैस के लिए क्रान्तिक स्थिरांकों (Tc, Pc तथा Vc) के मान निश्चित होते हैं। क्रान्तिक ताप तथा क्रान्तिक दाब पर गैस तथा द्रव अवस्था समान हो जाती है। गैस की इस अवस्था को उसकी क्रान्तिक अवस्था कहते हैं तथा इस घटना को क्रान्तिक घटना कहा जाता है।
ऐन्ड्रज का प्रयोग:
स्थिर ताप पर दाब तथा आयतन के मध्य आरेख को समतापी आरेख कहते हैं।
थॉमस एन्ड्रज ने विभिन्न तापों पर CO2 गैस के समतापी आरेख खींचे तथा यह निष्कर्ष निकाला कि वास्तविक गैसें CO2 के समान व्यवहार दर्शाती हैं तथा उच्च ताप पर इसके समतापी आरेख आदर्श गैस के समतापी आरेख के समान होते हैं तथा उन्होंने देखा कि उच्च दाब पर भी गैस को द्रव में परिवर्तित नहीं किया जा सकता है। जब ताप कम करते हैं तो वक्र की आकृति बदल जाती है तथा आदर्श व्यवहार से विचलन दिखाई देता है। 30.98°C ताप पर 73 वायुमण्डलीय-दाब से पहले CO2 गैस द्रव अवस्था में रहती है। (चित्र में बिन्दु E) तथा 73 वायुमण्डलीय – दाब पर CO2 प्रथम बार द्रव अवस्था में दिखाई देती है। अतः 30.98°C CO2 का क्रान्तिक ताप है।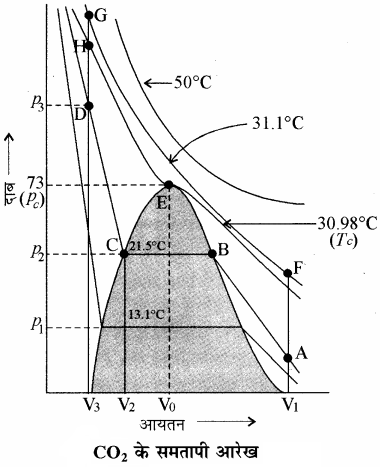
दाब को पुन: बढ़ाने पर द्रव CO2 संपीड़ित हो जाती है। चित्र में खड़ी रेखा द्रव CO2 के समतापी आरेख को दर्शाती है। अत्यधिक दाब बढ़ाने पर हल्का – सा दबाव (slight compression) द्रवों की कम संपीड्यता को प्रदर्शित करता है। 21.5°C पर बिंदु B तक CO2 गैस अवस्था में रहती है। बिंदु B पर विशिष्ट आयतन का द्रव प्राप्त होता है। इसके पश्चात् संपीडन पर दाब परिवर्तित नहीं होता है एवं द्रव तथा गैस CO2 साथ – साथ रहती हैं। दाब पुनः बढ़ाने पर गैस का अधिक संघनन होता है तथा बिंदु C प्राप्त होता है। बिंदु C पर गैस पूर्णतः संघनित हो जाती है।
तत्पश्चात् पुनः दाब बढ़ाने पर द्रव का संपीडन बहुत कम होता है। तथा एक अतिप्रवण रेखा (Steep line) प्राप्त होती है। V2 से V3 तक आयतन में सूक्ष्म संपीडन P2 से P3 दाब को अतिप्रवण बनाता है। 30.98°C (क्रांतिक ताप) से नीचे प्रत्येक वक्र इसी प्रकार की प्रवृत्ति दर्शाता है। कम ताप पर केवल क्षैतिज रेखा की लंबाई में वृद्धि होती है। क्रांतिक बिंदु पर क्षैतिज भाग एक बिंदु में विलीन हो जाता है। इस प्रकार चित्र में बिंदु A गैसीय अवस्था को प्रदर्शित करता है तथा बिन्दु D द्रव अवस्था को प्रदर्शित करती है, जबकि इस बिंदु के नीचे गुंबदनुमा आकृति में CO2 की द्रव तथा गैसीय अवस्था साम्यावस्था में होती है।
स्थिर ताप पर संपीडन पर सभी गैसों का व्यवहार CO2 के समान होता है।
इससे यह निष्कर्ष निकलता है कि द्रवीकरण के लिए गैसों को क्रान्तिक ताप से नीचे ठण्डा किया जा सकता है। स्थायी गैसों (H2 तथा N2) जिनके Z (संपीड्यता गुणांक) के मान में लगातार धनात्मक विचलन होता है, के द्रवीकरण के लिए ताप में कमी के साथ – साथ उनका पर्याप्त संपीडन करना आवश्यक होता है। संपीडन, अणुओं को पास – पास लाता है, जबकि ताप कम करने से अणुओं की गति कम हो जाती है, अर्थात् अंतराअणुक आकर्षण ही कम गतिशील अणुओं को पास – पास लाती है तथा गैस द्रवीकृत हो जाती है। अतः किसी गैस को द्रव में तथा द्रव को गैस में एक प्रावस्था में रहते हुए परिवर्तित किया जा सकता है।
उदाहरण:
ताप बढ़ाने पर हम बिंदु A से F की ओर जाते हैं, तब इस समतापी वक्र (31.1°C) के सहारे स्थिर ताप पर गैस को संपीडित करने पर बिंदु G आता है। इसके बाद हम ताप को कम करके ऊध्र्वाधर नीचे की ओर बिंदु D पर जाते हैं। जैसे ही हम बिंदु H को पार करते हैं, वैसे ही हमें द्रव प्राप्त होता है, परंतु कहीं पर भी दो प्रावस्थाएँ नहीं पायी जाती हैं। यदि यह प्रक्रिया क्रांतिक ताप पर होती है, तो पदार्थ केवल एक ही प्रावस्था में रहता है।
अवस्था सातत्य:
द्रव तथा गैसीय अवस्था में सातत्य (निरन्तरता) को अवस्था सातत्य कहते हैं। इस अवस्था में सातत्य को पहचानने के लिए गैस तथा द्रव के लिए तरल शब्दों का प्रयोग किया जाता है। अतः द्रव को गैस का संघनित रूप माना जा सकता है। जब तरल क्रान्तिक ताप से कम ताप पर होता है तो द्रव व गैस में विभेद कर सकते हैं। इस परिस्थिति में द्रव तथा गैस साम्यावस्था में होते हैं तथा दोनों प्रावस्थाओं के मध्य विभेदी परत दिखाई देती है।
इस विभेदी परत की अनुपस्थिति में किसी भी विधि द्वारा इन दो अवस्थाओं में विभेद नहीं किया जा सकता है। क्रांतिक ताप पर गैस में द्रव का परिवर्तन अप्रत्यक्ष तथा सतत होता है तथा दो परतों को पृथक् करने वाली सतह गायब हो जाती है। क्रांतिक ताप से नीचे किसी भी गैस को केवल दाब बढ़ाकर द्रव में परिवर्तित कर सकते हैं। इसे उस पदार्थ की वाष्प कहते हैं। अतः क्रांतिक ताप से नीचे कार्बन डाइऑक्साइड (गैस) को ‘कार्बन डाइऑक्साइड वाष्प’ कहा जाता है।
गैसों के द्रवीकरण की प्रायोगिक विधियाँ:
गैसों के द्रवीकरण के लिए निम्न विधियाँ उपयोग में ली जाती हैं –
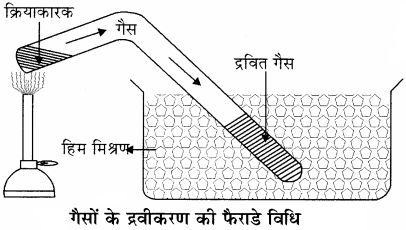
- फैराडे विधि-सर्वप्रथम 1823 में फैराडे ने हिम मिश्रण द्वारा H2O, Cl2, CO2, SO2 आदि गैसों का द्रवीकरण किया। इसके लिए उन्होंने V आकार की एक नली ली जिसकी एक भुजा में कोई पदार्थ लेकर गर्म किया तथा दूसरी भुजा को सील करके हिम मिश्रण में डुबो दिया गया। हिम मिश्रण के रूप में बर्फ तथा NOCl या बर्फ तथा NaNO3 या ठोस CO2 एवं ईथर का उपयोग किया जाता है। गैस के द्रवण के लिए दो शर्तों का पालन करना होता है – कम ताप और अधिक दाब। हिम मिश्रण में गैस ठण्डी होती जायेगी और सील बन्द नली के कारण दाब में वृद्धि होती जायेगी जिससे गैस द्रवित हो जायेगी।
थिलोरियर ने CO2 का द्रवण किया जब द्रव CO2 वाष्पीकृत होते हैं तो उनके शीतलन प्रभाव से गैसीय CO2 ठोस CO2 में बदल जाती है। जिसे शुष्क बर्फ (dry ice) कहते हैं।
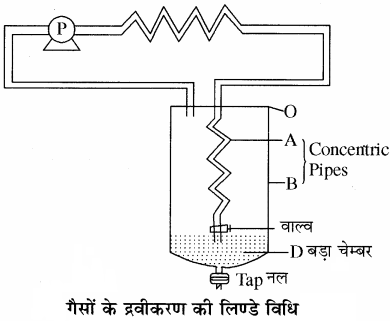
- लिण्डे विधि:
यह विधि जूल थॉमसन प्रभाव पर आधारित है। इसके अनुसार किसी गैस को उच्च दाबक्षेत्र से सरन्ध्रद्वार द्वारा कम दाब क्षेत्र की ओर प्रसारित करने पर उसके ताप में कमी आती है जिससे शीतलन प्रभाव होता है।
वायु जिसे द्रवित करता है उसे उच्च दाब लगभग 200 वायुमण्डलीय दाब पर गैस को संपीड्य द्वारा समकेन्द्रीय पादपों में से गुजारते हैं। अब वाल्व V को खोलकर गैस को बड़े चेम्बर D में प्रसारित करते हैं जिससे। गैस का दाब घटकर 50 atm हो जाता है। इस प्रकार यह प्रक्रिया तब तक दोहराते हैं जब तक गैस द्रवित न हो जाये, इस उपकरण में शीतल वायु को बाह्य नली में प्रवाहित करते हैं जिससे वायु का द्रवीकरण हो जाता है। - क्लॉड विधि:
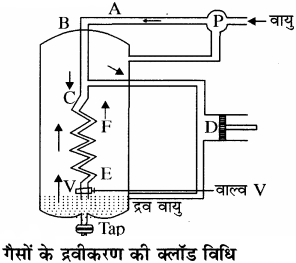
इस विधि में किसी संपीडित गैस का रुद्धोष्म परिस्थितियों में किसी परिरोधी दाब के विरुद्ध प्रसार होने दिया जाता है तो वह गैस बाह्य कार्य करती है। इस दौरान आन्तरिक ऊर्जा खर्च होती है जिससे ताप कम हो जाता है।
गैस को 200 वायुमण्डलीय दाब पर संपीडित करके पाइप में से गुजारते हैं। यह पाइप आगे जाकर दो भागों में बंट जाता है। एक भाग सिलेण्डर D से होकर निकलता है जिसमें वायुरुद्ध पिस्टन लगा हुआ होता है। गैस पिस्टन को धक्का देती है जिससे गैस को यांत्रिकी कार्य करना पड़ता है और रुद्धोष्म प्रसार के कारण अणुओं की गतिज ऊर्जा का कुछ भाग खर्च हो जाता है। गतिज ऊर्जा में कमी आते ही गैस का ताप कम हो जाता है और यह वायु द्रवित हो जाती है। इसी प्रकार पाइप का एक भाग समकेन्द्रीय नलियों में जाता है जिसके सिरे पर स्थित वाल्व V को खोल देने से दाब का मान कम होकर 50 atm हो जाता है तथा जूल थॉमसन प्रभाव के कारण गैस ठण्डी होकर द्रवीकृत हो जाती है।
प्रश्न 38.
आदर्श गैसों एवं वास्तविक गैसों में अन्तर स्पष्ट कीजिए। दाब आयतन संशोधन द्वारा वाण्डरवाल समीकरण ज्ञात कीजिए।
उत्तर:
आदर्श गैस व्यवहार से विचलन की वान्डरवाल्स अभिधारणाएँ:
वास्तविक गैसें सभी परिस्थितियों में बॉयल, चार्ल्स तथा आवोगाद्रो के नियम का पूर्ण रूप से पालन नहीं करती हैं। इससे यह प्रश्न उठना स्वाभाविक है कि गैसों में आदर्श व्यवहार से विचलन क्यों होता है तथा वे कौनसी परिस्थितियाँ हैं जो गैस को आदर्श आचरण से विचलित करती हैं। गैसों के अणु गति सिद्धान्त के अभिगृहीतों पर पुनर्विचार करने पर यह ज्ञात होता है कि इसके निम्नलिखित दो अभिगृहीत सही नहीं हैं –
- गैस के अणुओं के मध्य कोई आकर्षण बल नहीं होता है। अथवा नगण्य होता है।
- गैस के अणुओं का आयतन, गैस द्वारा घेरे गए आयतन की तुलना में नगण्य होता है।
अभिगृहीत:
1. केवल तभी सही हो सकता है जब गैस का कभी भी द्रवीकरण न हो लेकिन हम जानते हैं कि ठंडी करने पर तथा संपीडित करने पर गैस को द्रवीकृत किया जा सकता है तथा बने द्रव के अणुओं को संपीडित करना कठिन होता है, अर्थात् इसमें प्रतिकर्षण बल इतने प्रभावी होते हैं कि सूक्ष्म आयतन में अणुओं के पास-पास आने का विरोध करते हैं तथा अभिगृहीत।
2. के सही होने पर दाब आयतन आरेख में वास्तविक गैस के प्रायोगिक आँकड़े तथा बॉयल के नियम से परिकलित सैद्धान्तिक आँकड़े एक – दूसरे के समान होने चाहिए।
वास्तविक गैसों का आदर्श व्यवहार से विचलन इसलिए होता है। क्योंकि अणु आपस में अन्योन्य क्रिया (Interaction) करते हैं। आकर्षण बल अणुओं को पास-पास लाने का प्रयास करते हैं इसलिए दाब की निश्चित वृद्धि होने पर आयतन में कमी उस स्थिति से अधिक होगी जब अणुओं के मध्य कोई आकर्षण नहीं हो। इसी प्रकार ताप कम करने पर भी आयतन कम होता है। अतः अन्तराअणुक आकर्षण बलों की उपेक्षा नहीं की जा सकती, जबकि प्रतिकर्षण बल अणुओं को दूर – दूर करने का प्रयास करते हैं। उच्च दाब पर गैस के अणु पूर्ण प्रभाव के साथ पात्र की दीवार से टक्कर नहीं करते हैं क्योंकि वे पीछे की तरफ स्थित अन्य अणुओं के द्वारा आकर्षित होते हैं। इससे गैस के अणुओं द्वारा पात्र की दीवार पर उत्पन्न दाब प्रभावित होता है। अत: वास्तविक गैस के द्वारा उत्पन्न दाब आदर्श गैस के दाब से कम होता है।
इस स्थिति में प्रतिकर्षण बल भी प्रभावी हो जाते हैं। ये प्रतिकर्षण अन्योन्य क्रियाएँ अल्प परास में होती हैं तथा जब अणु एक – दूसरे के बहुत पास होते हैं, तब ये प्रभावी हो जाती हैं। यह स्थिति उच्च दाब पर उत्पन्न होती है। प्रतिकर्षण बल के कारण अणु सूक्ष्म, परन्तु अभेद्य गोले की भाँति व्यवहार करने लगते हैं तथा गैस के अणुओं के द्वारा घेरा गया आयतन भी प्रभावी हो जाता है क्योंकि साधारण ताप व दाब पर तो गैस के अणुओं का आयतन कुल आयतन की तुलना में नगण्य होता है (0.1%) लेकिन उच्च दाब पर गैस के अणुओं का आयतन गैस के आयतन की तुलना में नगण्य नहीं होता है। इन तथ्यों के आधार पर वान्डरवाल ने आदर्श गैस समीकरण में संशोधन करके एक नया समीकरण दिया जिसे वान्डरवाल समीकरण कहते हैं जो कि निम्न प्रकार होता है –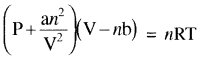
यहाँ n = गैस के मोलों की संख्या तथा a तथा b वान्डरवाल स्थिरांक हैं जो गैस की प्रकृति पर निर्भर करते हैं।
a का मान गैस के अणुओं में अंतराअणुक आकर्षण बल का परिमाण होता है। लेकिन यह ताप व दाब पर निर्भर नहीं करता है। a का मान जितना अधिक होगा अणुओं के मध्य आकर्षण उतना ही अधिक होता है तथा उन गैसों को आसानी से द्रवित किया जा सकता है, जैसे CO2, SO2 इत्यादि।
वान्डरवाल समीकरण की व्युत्पत्ति:
1873 में वान्डरवाल ने आदर्श गैस समीकरण को वास्तविक गैसों के लिए लागू करने हेतु आयतन तथा दाब में संशोधन किया तथा वान्डरवाल समीकरण की उत्पत्ति की।
1. आयतन संशोधन: वान्डरवाल ने वास्तविक गैसों के अणुओं को दृढ़ तथा गोलाकार माना जिनका आयतन निश्चित होता है,
अतः
आदर्श – गैस का आयतन = वास्तविक गैस का आयतन – गैस के अणुओं द्वारा घेरा गया आयतन
Vi = V – b
यहाँ b वास्तविक गैस के एक मोल का अपवर्जित आयतन कहलाता है।
n मोल गैस के लिए
Vi= V – nb
अर्थात् अणु V आयतन में विचरण के स्थान पर (V – nb)
आयतन में विचरण करने के लिए प्रतिबंधित हो जाते हैं, जहाँ nb गैस के अणुओं द्वारा घेरे गए वास्तविक आयतन के लगभग बराबर होता है।
नोट –
अपवर्जित आयतन (b) अणुओं के वास्तविक आयतन का चार गुना होता है।
2. दाब संशोधन:
किसी पात्र में अन्दर की तरफ स्थित एक अणु पर सभी तरफ से अन्य अणुओं का आकर्षण बल लगता है तथा ये बल एक-दूसरे को निरस्त कर देते हैं। जिससे इस अणु पर परिणामी आकर्षण बल शून्य होता है, लेकिन वह अणु जो पात्र की दीवार के पास होता है या पात्र की दीवार से टकराने जा रहा है, उस पर परिणामी आकर्षण बल पात्र के अन्दर की तरफ होता है। इस कारण पात्र की दीवार के पास स्थित अणु पर अन्दर की ओर खिंचाव होता है अतः यह अणु पात्र की दीवार से कम वेग से टकराता है तथा पात्र की दीवार पर कम दाब डालता है। इस प्रकार गैस
को वास्तविक दाब, आदर्श गैस के दाब की तुलना में राशि P जितना कम होता है।
अतः
यहाँ a (frac { { n }^{ 2 } }{ { v }^{ 2 } } ) दाब में संशोधित पद है। दाब संशोधन निम्न कारकों पर निर्भर करता है –
- गैस के उन अणुओं की संख्या जो पात्र की दीवार पर टकराने वाले अणु पर खिंचाव उत्पन्न करते हैं जो कि गैस के घनत्व पर निर्भर करते हैं।
- गैस के उन अणुओं की संख्या जो पात्र की दीवार से इकाई क्षेत्रफल पर प्रति सेकण्ड टकराते हैं तथा ये भी गैस के घनत्व पर निर्भर करते हैं।
इन दोनों प्रकार के आकर्षण बलों के कारण दाब में कमी P 1 गैस के घनत्व के वर्ग के समानुपाती होती है।
p1∝ p2
∴ (frac { n }{ v } ) = घनत्व
उपरोक्त दोनों कारकों को मिलाने पर
p ∝ (left( frac { n }{ V } right) ^{ 2 })
या
p = a (frac { { n }^{ 2 } }{ { V }^{ 2 } } ) (a = आकर्षण गुणांक)
अतः![]()
आदर्श गैस समीकरण
PiVi = nRT
P = घनत्व
n = मोलों की संख्या
a = वान्डरवाल नियतांक
Pi = आदर्श गैस का दाबे
Pr = वास्तविक गैस का दाब = P (माना)
यहाँ
Pi = pआदर्श
Pr = pवास्तविक तथा a (frac { { n }^{ 2 } }{ { V }^{ 2 } } ) संशोधित पद है।
आदर्श गैस समीकरण PiVi = nRT में Pi तथा Vi का मान रखने पर –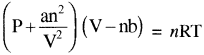
यह n मोल गैस के लिए वान्डरवाल समीकरण है।
जब n = 1 अर्थात् गैस एक मोल है तो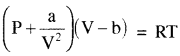
यहाँ a तथा b वान्डरवाल नियतांक हैं।
गैसीय पदार्थ का घनत्व एवं मोलर द्रव्यमान:
आदर्श गैस समीकरण को पुनर्व्यवस्थित करने पर –
PV = nRT
(frac { n }{ V } ) = (frac { p }{ R{ T } } )
चूँकि मोल (n) = (frac { m }{ M } )
अतः
(frac { m }{ M{ V } } ) = (frac { p }{ R{ T } } )
या
(frac { d }{ M } ) = (frac { p }{ R{ T } } ) (यहाँ d = घनत्व)
पुनर्व्यवस्थित करने पर –
M = (frac { d{ R }{ T } }{ P } )
इस समीकरण की सहायता से गैस के मोलर द्रव्यमान की गणना की जा सकती है।
प्रश्न 39.
आवोगादो के नियम की व्याख्या कीजिए। बॉयल व चार्ल्स के नियम को आरेख सहित समझाइये।
उत्तर:
गैसों के नियम:
सभी गैसों के लिए एक सामान्य नियम यह है कि इनके ताप या दाब में परिवर्तन करने पर इनके आयतन में भी परिवर्तन होता है। अतः ताप, दाब तथा आयतन के मध्य सम्बन्धों का विस्तृत अध्ययन विभिन्न वैज्ञानिकों द्वारा किया गया तथा गैसों के लिए कुछ नियम दिए जिन्हें गैस नियम कहते हैं, जो कि उन वैज्ञानिकों के नाम से ही प्रचलित हैं जिनके द्वारा ये दिए गए हैं।
प्रमुख गैसीय नियम –
- बॉयल नियम
- चार्ल्स नियम
- गै-लुसैक नियम
- आवोग्राद्रो परिकल्पना
1. बॉयल का नियम (दाबे आयतन सम्बन्ध):
यह नियम दाब तथा आयतन में सम्बन्ध दर्शाता है। स्थिर ताप पर किसी गैस की निश्चित मात्रा (मोलों की संख्या) का दाब, उसके आयतन के व्युत्क्रमानुपाती होता है। इसे बॉयल का नियम कहते हैं।
गणितीय रूप से
P ∝ (frac { 1 }{ V } ) (स्थिर ताप तथा n पर)
P= k (frac { 1 }{ V } )
यहाँ P = गैस का दाब
V= गैस का आयतन
k = समानुपातिक स्थिरांक
PV = k अर्थात् स्थिर ताप पर गैस की निश्चित मात्रा के आयतन तथा दाब का गुणनफल स्थिर होता है।
स्थिरांक k का मान, गैस की मात्रा, ताप तथा P वे V की इकाइयों पर निर्भर करता है।
यदि किसी गैस की निश्चित मात्रा को स्थिर ताप T पर दाब P1 तथा आयतन V1 से प्रसारित किया जाता है (जिससे आयतन V2 तथा दाब P2 हो जाए), बॉयल के नियमानुसार
P1V1 = P2V2 = स्थिरांक
(frac { { P }_{ 1 } }{ { P }_{ 2 } } ) = (frac { { V }_{ 1 } }{ { V }_{ 2 } } )
बॉयल के नियम के ग्राफीय निरूपण:
(i) विभिन्न तापों पर दाब तथा आयतन के मध्य ग्राफ (समीकरण PV = k का ग्राफ) एक वक्र की तरह प्राप्त होता है। इन्हें समतापी वक्र कहते हैं क्योंकि किसी एक ग्राफ के लिए ताप का मान निश्चित है। लेकिन प्रत्येक वक्र के लिए ताप का मान भिन्न – भिन्न है। प्रत्येक वक्र के लिए k1 का मान भिन्न – भिन्न है, क्योंकि किसी गैस के दिए गए द्रव्यमान के लिए यह केवल ताप पर ही निर्भर करता है। ऊपर वाले वक्र उच्च ताप पर हैं। यहाँ यह ध्यान देने योग्य है कि गैस का दाब आधा कर देते हैं तो इसका आयतन लगभग दुगुना हो जाता है।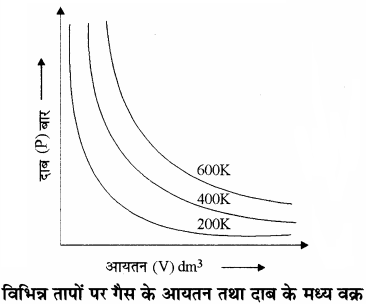
(ii) दाब (P) तथा (frac { 1 }{ V } ) के मध्य ग्राफ एक सरल रेखा के रूप में प्राप्त होता है जो कि मूल बिन्दु से गुजरती है। ग्राफ से स्पष्ट है कि उच्च दाब पर गैसों में बॉयल के नियम से विचलन होता है तथा ऐसी स्थिति में प्राप्त ग्राफ एक सीधी रेखा नहीं होता है एवं ताप बढ़ने पर यह सीधी रेखा, दाब अक्ष की ओर बढ़ती है।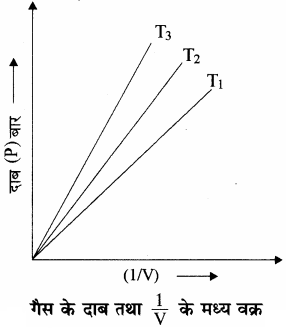
बॉयल के प्रयोग से यह सिद्ध होता है कि गैसें अत्यधिक सम्पीड्य होती हैं क्योंकि जब किसी गैस की निश्चित मात्रा को संपीडित किया जाता है तो उसके अणु बहुत कम स्थान घेरते हैं अर्थात् उच्च दाब पर गैस सघन (dense) हो जाती है। बॉयल के नियम से गैस के घनत्व तथा दाब के मध्य एक सम्बन्ध प्राप्त किया जा सकता है –
चूँकि,![]()
d = (frac { m }{ V } )
V = (frac { m }{ d } )
बॉयल के नियम से PV = k (frac { 1 }{ V } )
V का मान रखने पर
P (frac { m }{ d } ) = k1
या
d = (frac { m }{ k } )P
अर्थात् स्थिर ताप पर गैस के निश्चित द्रव्यमान का दाब घनत्व के समानुपाती होता है या एक निश्चित द्रव्यमान की गैस के घनत्व तथा दाब का अनुपात स्थिर होता है।
2. चार्ल्स का नियम (ताप – आयतन सम्बन्ध):
चार्ल्स ने स्थिर दाब पर गैस के आयतन पर ताप के प्रभाव का अध्ययन किया तथा बाद में गै-लूसैक ने इसे प्रमाणित किया तथा पाया कि स्थिर दाब पर निश्चित द्रव्यमान वाली गैस का ताप बढ़ाने पर उसका आयतन बढ़ता है तथा उन्होंने देखा कि ताप की प्रत्येक डिग्री में वृद्धि से गैस की निश्चित मात्रा के आयतन में उसके 0°C ताप के आयतन से (frac { 1 }{ 273 } ) वें भाग की वृद्धि होती है।
V α T
या
V = KT
या
(frac { V }{ T } ) = K
यहाँ
T = t + 273
T = परमताप (केल्विन में)
t = ताप (°C में)
माना किसी गैस के लिए 0°C तथा 1°C ताप पर आयतन क्रमशः V0 तथा Vt हो तो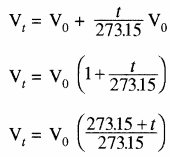
केल्विन मापक्रम या परमताप मापक्रम में 1°C के स्थान पर Tt तथा (0°C के स्थान पर T0 का प्रयोग किया जाएगा।
अतः Tt = 273.15 + t तथा T0 = 273.15 तो उपरोक्त समीकरण को इस प्रकार लिखा जाएगा –
Vt = V0 ((frac { { T }_{ t } }{ { T }_{ 0 } } ))
या
(frac { { V }_{ t } }{ { V }_{ 0 } } ) = (frac { { T }_{ t } }{ { T }_{ 0 } } )
इस समीकरण का सामान्य रूप इस प्रकार लिखा जा सकता है –
(frac { { V }_{ 2 } }{ { V }_{ 1 } } ) = (frac { { T }_{ 2 } }{ { T }_{ 1 } } )
या
(frac { { V }_{ 1 } }{ { T }_{ 1 } } ) = (frac { { V }_{ 2 } }{ { T }_{ 2 } } )
ताप को केल्विन में प्राप्त करने के लिए °C के ताप में 273.15 या 273 जोड़ा जाता है। यहाँ यह ध्यान रखने योग्य है कि केल्विन मापक्रम में ताप को लिखते समय डिग्री (°) के चिन्ह का प्रयोग नहीं किया जाता है। केल्विन मापक्रम को ताप का ऊष्मागतिक मापक्रम भी कहा जाता है। चार्ल्स के नियम को अन्य रूप में इस प्रकार व्यक्त किया जाता है –
स्थिर दाब पर किसी गैस की निश्चित मात्रा का आयतन उसके परम ताप के समानुपाती होता है।
अर्थात्
V ∝ T
V = k2T
(frac { V }{ T } ) = k2 (स्थिरांक)
स्थिरांक (k2) का मान, गैस की मात्रा, गैस के दाब तथा आयतन की इकाई पर निर्भर करता है। दो भिन्न – भिन्न आयतन तथा भिन्न – भिन्न तापों के लिए
(frac { { V }_{ 1 } }{ { T }_{ 1 } } ) = (frac { { V }_{ 2 } }{ { T }_{ 2 } } )चार्ल्स ने पाया कि स्थिर दाब पर, ताप तथा आयतन के मध्य ग्राफ एक सरल रेखा होती है जिसे समदाब कहते हैं।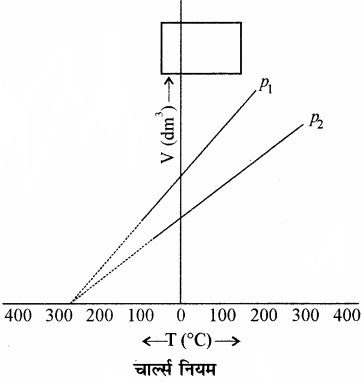
उपरोक्त ग्राफ को शून्य आयतन तक बढ़ाने पर प्रत्येक रेखा ताप अक्ष पर – 273.15°C पर अंत:खण्ड बनाती है। लेकिन विभिन्न दाबों पर रेखाओं का ढाल भिन्न – भिन्न होता है लेकिन शून्य आयतन पर प्रत्येक रेखा ताप – अक्ष पर – 273.15°C पर मिलती है।
समीकरण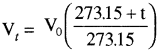
में t का मान – 273.15°C लेने पर किसी गैस का आयतन शून्य हो जाता है अर्थात् गैस का अस्तित्व ही नहीं रहता है। वास्तव में – 273.15°C ताप पहुँचने से पहले ही प्रत्येक गैस द्रवित हो जाती है। यह ताप, परम शून्य ताप कहलाता है। अतः वह न्यूनतम काल्पनिक ताप, जिस पर गैस का आयतन शून्य हो जाता है उसे परम शून्य ताप कहते हैं। बहुत कम दाब तथा उच्च दाब पर प्रत्येक गैस ‘बॉयल के नियम का पालन करती है।
3. गै-लुसैक नियम (दाब – ताप सम्बन्ध):
गै-लुसैक नियम को चार्ल्स नियम का उपप्रमेय कहा जा सकता है। गै-लुसैक नियम स्थिर आयतन पर गैस के ताप तथा दाब के मध्य सम्बन्ध दर्शाता है। इसके अनुसार स्थिर आयतन पर किसी गैस की निश्चित मात्रा का दाब, उसके परम ताप के समानुपाती होता है।
गणितीय रूप में P ∝ T
P = k3T
(frac { P }{ T } ) = k3 (स्थिरांक)
यदि ताप T1 पर किसी गैस का दाब P1 हो तथा ताप T2पर उसी गैस का दाब P2 हो तो
(frac { { P }_{ 1 } }{ { T }_{ 1 } } ) = (frac { { P }_{ 2 } }{ { T }_{ 2 } } )
(गैस का आयतन तथा द्रव्यमान स्थिर होने पर) स्थिर आयतन (मोलर आयतन) पर दाब तथा ताप के मध्य आरेख को आगे चित्र में दर्शाया गया है। दाब तथा ताप के मध्य आरेख को समआयतनी (Isochor) कहते हैं।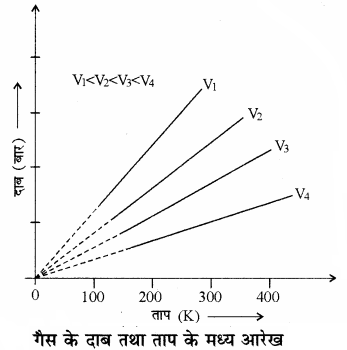
स्वचालित वाहनों के टायरों में दाब लगभग समान रहता है, परन्तु गरमी के दिनों में टायरों में दाब अत्यधिक बढ़ जाता है। यदि दाब को अच्छी तरह समायोजित नहीं किया जाए, तो टायर फट जाएगा। लेकिन सर्दी के दिनों में वाहनों के टायर में दाब काफी कम हो जाता है। ये सभी प्रेक्षण गै-लूसैक नियम के अनुरूप हैं।
4. आवोगाद्रो परिकल्पना (आयतन – मात्रा सम्बन्ध):
सन् 1811 में आवोगाद्रो ने डाल्टन के परमाणु सिद्धान्त तथा गै-लुसैक के संयुक्त आयतन सिद्धान्त के संयुक्त निष्कर्ष के आधार पर एक नियम दिया जिसे आवोगाद्रो नियम कहते हैं। इसके अनुसार समान ताप व दाब पर विभिन्न गैसों के समान आयतन में अणुओं की संख्या समान होती है। अर्थात् स्थिर ताप व दाब पर गैस का आयतन, उसके अणुओं की संख्या या गैस की मात्रा पर निर्भर करता है । गैस की मात्रा को मोल में व्यक्त किया जाता है। अतः गणितीय रूप में
V ∝ n
V = गैस का आयतन,
n = गैस के मोलों की संख्या
V = kn
किसी गैस के एक मोल में अणुओं की संख्या 6.023 × 1023 होती है जिसे आवोगाद्रो संख्या (NA) कहते हैं।
चूँकि गैस का आयतन, उसके मोलों की संख्या के समानुपाती होता है। अत: मानक ताप व दाब (STP) पर प्रत्येक गैस के एक मोल का आयतन 22.4 लीटर होता है तथा STP पर आदर्श गैस के एक मोल का आयतन (मोलर आयतन) 22.71 Lmol-1 होता है।
मानक ताप व दाब का तात्पर्य 273.15 K ताप तथा एक bar (105 Pascal) होता है। ये मान जल के हिमांक तथा समुद्र-तल पर एक वायुमण्डलीय दाब के लगभग समान हैं।
नोट –
कुछ वैज्ञानिक कार्यों के लिए मानक परिवेश ताप व दाब (SATP) की परिस्थितियाँ लागू होती हैं। 298.15 K ताप तथा 1 Bar (105 Pascal) दाब को SATP कहते हैं तथा SATP पर आदर्श गैस का मोलर आयतन 24.8 Litre mol-1 होता है। किसी गैस के मोलों की संख्या की गणना करना – यदि किसी गैस का द्रव्यमान m तथा उसका मोलर द्रव्यमान M हो तो मोलों की संख्या (n) –
n = (frac { m }{ M } )
अतः
V = k (frac { m }{ M } )
M = k (frac { m }{ V } )
चूंकि
d = (frac { m }{ V } )
या
M = kd (d = गैस का घनत्व)
अतः किसी गैस का घनत्व उसके मोलर द्रव्यमान के समानुपाती होता है।
RBSE Class 11 Chemistry Chapter 5 आंकिक प्रश्न
प्रश्न 40.
30° से. तथा 1 bar दाब पर वायु के 500 dm3 आयतन को 200 dm3 तक संपीडित करने के लिए कितने न्यूनतम दाब की आवश्यकता होगी?
उत्तर:
P1V1 = P2V2 (बॉयल के नियम के अनुसार)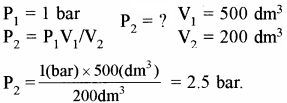
प्रश्न 41.
0°C पर तथा 2 bar दाब पर किसी गैस के ऑक्साइड का घनत्व 5 bar दाब पर डाइनाइट्रोजन के घनत्व के समान है, तो ऑक्साइड का अणु – भार क्या है?
उत्तर:
5 bar दाब पर गैस का घनत्व,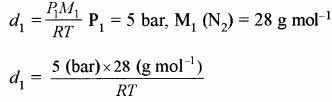
2 bar दाब पर गैस का घनत्व,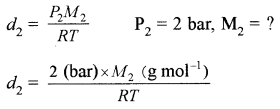
प्रश्नानुसार d1 = d2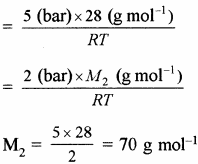
प्रश्न 42.
27° से. पर एक ग्राम आदर्श गैस का दाब 2 bar है। जब समान ताप एवं दाब पर इसमें दो ग्राम आदर्श गैस मिलाई जाती है, तो दाब 3 bar हो जाता है। इन गैसों के अणु – भार में संबंध स्थापित कीजिए।
उत्तर:
PV= nRT (आदर्श गैस समीकरण)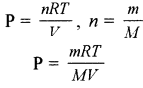
प्रथम स्थिति में –
m = 1 ग्राम P = 2 bar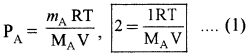
द्वितीय स्थिति में –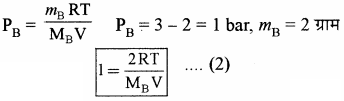
समीकरण (1) व (2) की तुलना करने पर MB = 4MA
प्रश्न 43.
किसी रसायन में एल्युमिनियम कास्टिक सोडा से क्रिया पर डाइहाइड्रोजन गैस देता है। यदि 1 bar तथा 20°C ताप पर 0.15 ग्राम ऐलुमिनियम अभिक्रिया करेगा, तो निर्गमित डाइहाइड्रोजन का आयतन क्या होगा?
उत्तर:
उपरोक्त प्रक्रम में निम्न अभिक्रिया होगी –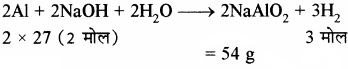
सन्तुलित समीकरण के अनुसार
हाइड्रोजन गैस का आयतन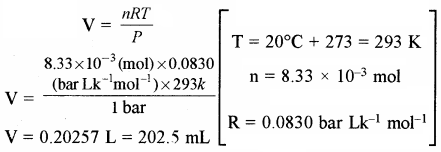
प्रश्न 44.
यदि 27°C पर 9 dm3 धारिता वाले फ्लास्क में 3.2 ग्राम मेथेन तथा 4.4 ग्राम CO2 (कार्बन डाइऑक्साइड) का मिश्रण हो, तो इसका दाब क्या होगा?
उत्तर:
प्रश्न 45.
27°C ताप पर जब 1 लीटर के फ्लास्क में 0.7 bar पर 2.0 लीटर डाइऑक्सीजन तथा 0.8 bar पर 0.5 L डाइहाइड्रोजन को भरा जाता है, तो गैसीय मिश्रण का दाब क्या होगा?
उत्तर:
बॉयल के नियम के अनुसार P1V1 = P2V2 (T = स्थिर)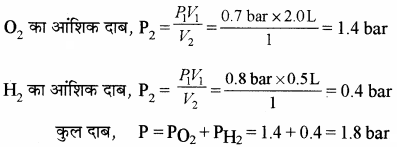
प्रश्न 46.
STP पर गैस का घनत्व क्या होगा। यदि 27°C ताप तथा 2 bar दाब पर एक गैस का घनत्व 5.46 g dm3 है?
उत्तर: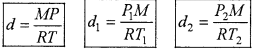
अतः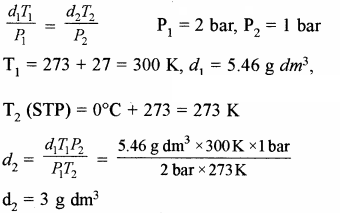
प्रश्न 47.
यदि 546°C तथा 1 bar दाब पर 34.05 mL फॉस्फोरस वाष्प का भार 0.0625 g है, तो फॉस्फोरस का मोलर द्रव्यमान क्या होगा?
उत्तर:
PV= nRT (आदर्श गैस समीकरण)
प्रश्न 48.
31.1°C तथा 1 bar दाब पर 8.8 ग्राम CO2 द्वारा घेरे गए आयतन की गणना कीजिए।
R = 0.083 bar L mol-1
उत्तर: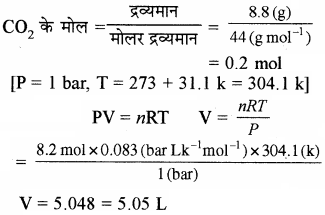
प्रश्न 49.
किसी गैस के 2.9 g द्रव्यमान का 95°C तथा 0.184 g डाइहाइड्रोजन का 17°C पर आयतन समान है। गैसों का मोलर द्रव्यमान ज्ञात कीजिए।
उत्तर:
माना गैस का मोलर द्रव्यमान = M

All Chapter RBSE Solutions For Class 11 Chemistry Hindi Medium
—————————————————————————–
All Subject RBSE Solutions For Class 11 Hindi Medium
*************************************************
————————————————————
All Chapter RBSE Solutions For Class 11 Chemistry Hindi Medium
All Subject RBSE Solutions For Class 11 Hindi Medium
Remark:
हम उम्मीद रखते है कि यह RBSE Class 11 chemistry Solutions in Hindi आपकी स्टडी में उपयोगी साबित हुए होंगे | अगर आप लोगो को इससे रिलेटेड कोई भी किसी भी प्रकार का डॉउट हो तो कमेंट बॉक्स में कमेंट करके पूंछ सकते है |
यदि इन solutions से आपको हेल्प मिली हो तो आप इन्हे अपने Classmates & Friends के साथ शेयर कर सकते है और HindiLearning.in को सोशल मीडिया में शेयर कर सकते है, जिससे हमारा मोटिवेशन बढ़ेगा और हम आप लोगो के लिए ऐसे ही और मैटेरियल अपलोड कर पाएंगे |
आपके भविष्य के लिए शुभकामनाएं!!