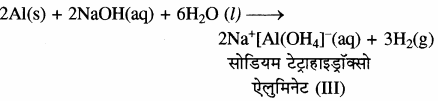हेलो स्टूडेंट्स, यहां हमने राजस्थान बोर्ड कक्षा 11वीं की रसायन विज्ञान सॉल्यूशंस को दिया हैं। यह solutions स्टूडेंट के परीक्षा में बहुत सहायक होंगे | Student RBSE solutions for Class 11 Chemistry Chapter 11 p – ब्लॉक तत्त्व pdf Download करे| RBSE solutions for Class 11 Chemistry Chapter 11 p – ब्लॉक तत्त्व notes will help you.
Table of Contents
Rajasthan Board RBSE Class 11 Chemistry Chapter 11 p – ब्लॉक तत्त्व
RBSE Class 11 Chemistry Chapter 11 पाठ्यपुस्तक के अभ्यास प्रश्न
RBSE Class 11 Chemistry Chapter 11 वस्तुनिष्ठ प्रश्न
प्रश्न 1.
निम्न में से कौनसा लुईस अम्ल है –
(अ) PCl3
(ब) AlCl3
(स) NCl3
(द) AsCl3
प्रश्न 2.
निम्न में से किस तत्त्व की +3 ऑक्सीकरण अवस्था अधिक स्थायी है –
(अ) In
(ब) Ga
(स) Al
(द) Ti
प्रश्न 3.
बोरेक्स के जलीय विलयन की प्रकृति है –
(अ) अम्लीय
(ब) उदासीन
(स) उभयधर्मी
(द) क्षारीय
प्रश्न 4.
निम्न में से कौन बोरेक्स मनका परीक्षण नहीं देगा –
(अ) मैंगनीज लवण
(ब) बेरियम लवण
(स) निकल लवण
(द) कोबाल्ट लवण
प्रश्न 5.
निम्न में से शुष्क बर्फ का सूत्र कौनसा है?
(अ) CO2
(ब) CO
(स) SiO2
(द) Al2O3
प्रश्न 6.
अर्द्ध चालक के रूप में प्रयुक्त किया जाता है –
(अ) कार्बन
(ब) सिलिकन
(स) लेड
(द) टिन
उत्तरमाला:
1. (ब)
2. (स)
3. (द)
4. (ब)
5. (अ)
6. (ब)
RBSE Class 11 Chemistry Chapter 11 अतिलघूत्तरात्मक प्रश्न
प्रश्न 7.
p – ब्लॉक तत्त्वों के बाह्यतम कोश का सामान्य इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
p – ब्लॉक तत्त्वों के बाह्यतम कोश का सामान्य इलेक्ट्रॉनिक विन्यास ns2p1-6 होता है।
प्रश्न 8.
बोरॉन का कौनसा यौगिक बुलेट प्रूफ वस्त्र बनाने में प्रयुक्त होता है?
उत्तर:
बोरॉन तन्तुओं का उपयोग बुलेटप्रूफ जैकेट बनाने में किया जाता है।
प्रश्न 9.
ऐलुमिनियम के दो वयस्कों के नाम व सूत्र दीजिए।
उत्तर:
बॉक्साइड Al2O3.2H2O
क्रायोलाइड Na3AlF6
प्रश्न 10.
AlCl3 की चतुष्फलकीय द्विलक संरचना बनाइये।
उत्तर: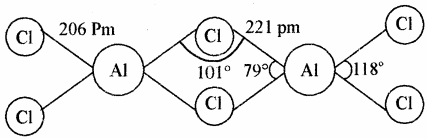
प्रश्न 11.
डाइबोरेन की संरचना दीजिए।
उत्तर: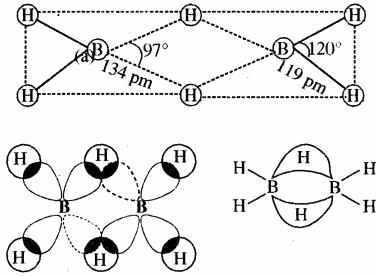
प्रश्न 12.
बोरॉन तथा ऐलुमिनियम के दो – दो उपयोग दीजिए।
उत्तर:
- बोरॉन का प्रमुख उपयोग बोरोसिलिकेट के रूप में इनेमले और कांच उद्योग में किया जाता है।
- 5B10 समस्थानिक का उपयोग नाभिकीय रेऐक्टर में प्रयुक्त नियंत्रक छडों में किया जाता है।
ऐलुमिनियम –
- ऐलुमिनियम का उपयोग विद्युत तार बनाने में किया जाता है।
- Al की मिश्र धातु ड्यूरेलुमिन हवाई जहाज के निर्माण में किया जाता है।
प्रश्न 13.
फुलरीन में उपस्थित छः सदस्य तथा पाँच सदस्यीय वलयों की संख्या बताइए।
उत्तर:
फुलरीन में छः सदस्यीय बीस वलय तथा पाँच सदस्यीय बारह वलय होती हैं।
प्रश्न 14.
उष्मागतिक रूप में कार्बन का कौनसा अपररूप सर्वाधिक स्थायी है?
उत्तर:
ग्रेफाइट सर्वाधिक होता है इसकी ΔFH° का मान शून्य मानते हैं।
प्रश्न 15.
हीरा तथा ग्रेफाइट में उपस्थित कार्बन का संकरण बताइये।
उत्तर:
हीरा में Sp3 संकरण होता है एवं इसकी ज्यामिति चतुष्फलकीय होती है जबकि ग्रेफाइट में Sp2 संकरण होता है एवं इसकी ज्यामिति षट्कोणीय होती है।
प्रश्न 16.
Ga की परमाणु त्रिज्या Al की परमाणु त्रिज्या से कम होती है, क्यों?
उत्तर:
ऐलुमिनियम से गैलियम की ओर जाने पर 10 संक्रमण तत्त्व जुड़ने के कारण नाभिकीय आवेश में +18 की वृद्धि हो जाती है। 1 Ga में उपस्थित 10 d इलेक्ट्रॉन बढ़े हुए नाभिकीय आवेश की तुलना में बाह्य इलेक्ट्रॉन पर दुर्बल परिरक्षण प्रभाव डालते हैं जिससे बाह्य इलेक्ट्रॉन एवं नाभिक के मध्य आकर्षण बढ़ जाता है जिससे गैलियम की परमाणु त्रिज्या एलुमिनियम की तुलना में कम हो जाती है।
प्रश्न 17.
बोरॉन का गलनांक असाधारण रूप से उच्च क्यों होता है? समझाइए।
उत्तर:
बोरॉन का उच्च गलनांक इसके ठोस अवस्था में परमाणुओं के मध्य प्रबल सहसंयोजक बन्ध एवं त्रिविमीय संरचना के कारण होता है।
प्रश्न 18.
समूह – 13 के तत्वों की +1 ऑक्सीकरण अवस्था के स्थायितव के बढ़ते क्रम को लिखिए।
उत्तर:
वर्ग में नीचे जाने पर +1 ऑक्सीकरण अवस्था का स्थायित्व बढ़ता जाता है – Al < Ga < In < TI
प्रश्न 19.
ऐलुमिनियम के उभयधर्मी व्यवहार दर्शाने वाली अभिक्रिया दीजिए।
उत्तर:
Al खनिज अम्लों एवं जलीय क्षारों में घुल जाता है। अतः Al उभयधर्मी गुण प्रदर्शित करता है।
प्रश्न 20.
बोरॉन BF4– बना सकता है BF6-3 नहीं, कारण समझाइए।
उत्तर:
बोरॉन में d कक्षक अनुपस्थित होता है, अतः इसकी अधिकतम संयोजकता 4 हो सकती है। इसी कारण BF4– बन सकता है। BF6-3 नहीं। परन्तु इस वर्ग के अन्य तत्त्वों में d कक्षक उपस्थिति होने के कारण उनकी संयोजकता 6 हो सकती है।
प्रश्न 21.
बोरिक अम्ल को एक दुर्बल अम्ल माना जाता है, क्यों?
उत्तर:
यह एक दुर्बल एक क्षारकीय अम्ल है लेकिन यह प्रोटोनी अम्ल नहीं है क्योंकि यह प्रोटोन नहीं देता है बल्कि जल के हाइड्राक्सिल आयन से इलेक्ट्रॉन युग्म ग्रहण करके लुइस अम्ल के समान व्यवहार करता है।
H3BO3 + 2H2O → [B(OH)4]– + H3O+
RBSE Class 11 Chemistry Chapter 11 लघूत्तरात्मक प्रश्न
प्रश्न 22.
समूह – 14 के तत्त्वों में पायी जाने वाली विभिन्न ऑक्सीकरण अवस्थाओं को समझाइये।
उत्तर:
इस समूह के तत्त्वों का सामान्य विन्यास ns2np2 होता है। अर्थात् बाह्यतम कोश में चार इलेक्ट्रॉन होते हैं अतः ये M+4 या M4- आयन बनाते हैं। प्रथम चार आयनन एन्थैल्पी का योग उच्च होने के कारण +4 ऑक्सीकरण अवस्था वाले यौगिक सहसंयोजक प्रकृति के होते हैं। ये +4 के साथ – साथ +2 ऑक्सीकरण अवस्था भी प्रदर्शित करते हैं। इस समूह में ऊपर से नीचे जाने पर Ge < Sn < Pb में +2 ऑक्सीकरण अवस्था प्रदर्शित करने की प्रवृत्ति बढ़ती जाती है C, Si एवं Ge +4 ऑक्सीकरण अवस्था प्रदर्शित करते हैं जबकि Sn की +2 ऑक्सीकरण अवस्था अपचायक तथा +4 ऑक्सीकरण अवस्था ऑक्सीकारक का कार्य करती है। कार्बन में d कक्षक अनुपस्थित होने के कारण +4 से अधिक ऑक्सीकरण अवस्था नहीं हो सकती है जबकि इस समूह के अन्य तत्त्वों में d कक्षक उपस्थित होने के कारण उनकी सहसंयोजकता 4 से अधिक हो सकती है।
प्रश्न 23.
PbI2 बनता है PbI4 नहीं। क्यों ?
उत्तर:
लेड, PbI4 नहीं बनता है क्योंकि Pb – I बन्ध जो प्रारम्भ में बनता है इतनी ऊर्जा उत्पन्न नहीं कर पाता है कि इससे 6s2 इलेक्ट्रॉन उत्तेजित होकर चार अयुग्मित इलेक्ट्रॉन प्राप्त हो सके तथा Pb+4 प्रबल ऑक्सीकारक एवं I– प्रबल अपचायक होता है अतः I– Pb+4 को Pb+2 में अपचयित कर देता है।
प्रश्न 24.
SiCl4 के जल अपघटन की प्रक्रिया को समझाइये।
उत्तर:
यदि Si के d कक्षक के जल से एकाकी इलेक्ट्रॉन युग्म ग्रहण कर SiCl4 प्रारम्भिक तौर पर जल अपघटित होता है तथा अन्त में SiCl4, Si(OH)4 में पूर्ण रूप से जल अपघटित हो जाता है।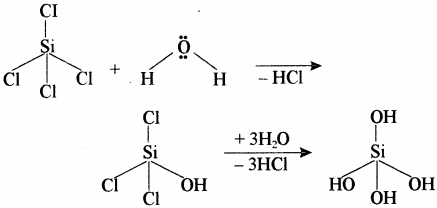
प्रश्न 25.
हीरा कठोर तथा ग्रेफाइट नर्म व मुलायम होता है, क्यों? समझाइये।
उत्तर:
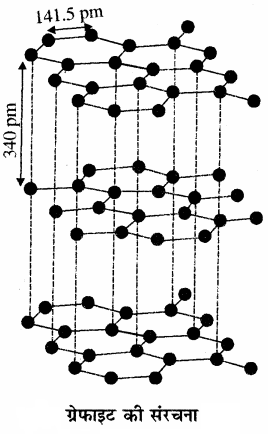
हीरा में क्रिस्टलीय जालक होता है तथा इसमें प्रत्येक कार्बन परमाणु sp3 संकरित होता है एवं चुम्बकीय ज्यामिति से अन्य चार कार्बन परमाणुओं से जुड़ा रहता है। इसमें कार्बन – कार्बन बन्ध लम्बाई 154 pm होने के कारण कार्बन परमाणुद्धिक (space) में दृढ़ त्रिविमीय जालक का निर्माण होता है अतः हीरा सर्वाधिक कठोर एवं उच्च गलनांक वाला कुचालक होता है जबकि ग्रेफाइट में परताप संरचना होती है। ये परतें वान्डरवाल बल द्वारा जुड़ी रहती हैं। इनमें दो परतों के मध्य दूरी 340 pm होती है। प्रत्येक परत के कार्बन परमाणु षट्कोणीय वलय के रूप में व्यवस्थित होते हैं। इसमें sp2 संकरित कार्बन परमाणु होते हैं अतः ग्रेफाइट की परतों को आसानी से तोड़ा जा सकता है अतः ग्रेफाइट मुलायम एवं चिकना होता है।
प्रश्न 26.
CO2 गैस है जबकि SiO2 ठोस, कारण सहित समझाइए।
उत्तर:
CO2 एक विविक्त अणु के रूप में पाया जाता है क्योंकि कार्बन के छोटे आकार के कारण यह ऑक्सीजन के साथ द्विबन्ध बना लेता है तथा CO2 के अणुओं के मध्य दुर्बल वाण्डरवाल बल पाया जाता है। अतः यह गैस है। लेकिन Si के बड़े आकार के कारण यह ऑक्सीजन के साथ द्विआबन्ध नहीं बना पाता है। अतः SiO2 की एक दीर्घ जटिल संरचना होती है जिसमें परमाणु पास – पास होते हैं इसलिए यह ठोस है।
प्रश्न 27.
CO की विषैली प्रकृति समझाइए।
उत्तर:
कार्बन मोनोऑक्साइड (CO) हीमोग्लोबिन के साथ स्थायी संकुल बनाती है जिसे कार्बोक्सी – हीमोग्लोबिन कहते हैं। यह ऑक्सीहीमोग्लोबिन से 300 गुना अधिक स्थायी होता है। अतः इस संकुल के बनने के कारण ऑक्सीजन, ऑक्सी – हीमोग्लोबिन संकुल नहीं बना पाती है। इसलिए शरीर को ऑक्सीजन की आपूर्ति नहीं होती तथा पीड़ित व्यक्ति की मृत्यु हो जाती है।![]()
प्रश्न 28.
SiCl4 को जल अपघटन हो जाता है CCl4 का नहीं, कारण सहित समझाइए।
उत्तर:
CCl4 में कार्बन के पास इलेक्ट्रॉन की कमी नहीं है तथा इसके पास रिक्त d – कक्षक भी उपलब्ध नहीं है अतः यह जल से क्रिया नहीं करता, जबकि SiCl4 में Si के संयोजी कोश में रिक्त d – कक्षक उपस्थित होने के कारण यह जल के ऑक्सीजन से एकाकी इलेक्ट्रॉन युग्म ग्रहण करके इससे क्रिया कर लेता है अर्थात् इसका जल अपघटन हो जाता है तथा SiO2 बनता है।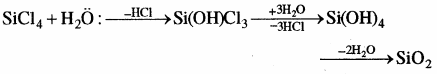
प्रश्न 29.
सिलिकॉन की एक इकाई का सूत्र लिखिए।
उत्तर:
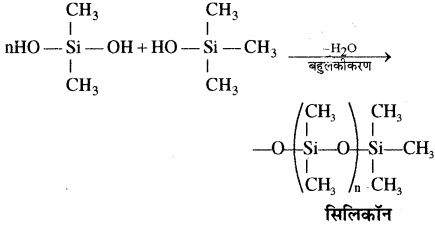
कार्बसिलिकन बहुलकों का एक वर्ग जिसमें Si – O – Si बन्ध पाया जाता है तथा एक R2SiO2 पुनरावर्ती इकाई होती है उन्हें सिलिकॉन कहा जाता है। सिलिकॉन के निर्माण में प्रयुक्त प्रारम्भिक पदार्थ ऐल्किल तथा ऐरिल प्रतिस्थापी सिलिकन क्लोराइड, [RnSiCl(4-n)] होता है। 573 K ताप पर जब मेथिल क्लोराइड, कॉपर की उपस्थिति में सिलिकन से क्रिया करता है, तो विभिन्न मेथिल प्रतिस्थापी क्लोरोसिलेन (MeSiCl3, Me2SiCl2, Me3SiCl) तथा सूक्ष्म मात्रा में Me4Si बनते हैं, यहाँ Me=CH3।
डाइमेथिल डाइक्लोरो सिलेन (CH3)2SiCl2) के जल अपघटन के पश्चात् संघनन बहुलकीकरण द्वारा श्रृंखला बहुलक बनते हैं।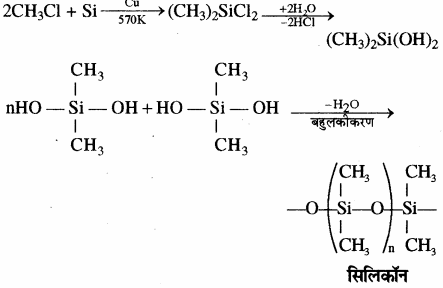
प्रश्न 30.
श्रृंखलन का गुण किस तत्त्व में अधिकतम होता है?
उत्तर:
श्रृंखलन का गुण कार्बन में अधिकतम होता है। कार्बन परमाणु परस्पर तथा अन्य परमाणु के साथ सह संयोजन बन्ध द्वारा जुड़कर लम्बी, खुली या बन्द श्रृंखलाओं का निर्माण करते हैं। कार्बन की इस प्रकार की प्रवृत्ति को श्रृंखलन कहते हैं। वर्ग में ऊपर से नीचे जाने पर आकार बढ़ने एवं विद्युत ऋणता घटती है अतः श्रृंखलना का क्रम निम्न प्रकार होता है
C >> Si > Ge = Sn
प्रश्न 31.
Be2C तथा Al4C3 में कार्बन की ऑक्सीकरण अवस्था बताइये।
उत्तर:
Be2C एवं Al4C3 में कार्बन की अवस्था -4 होती है। Be2C में Be+2 एवं कार्बाइड -4 है। इसी प्रकार Al4C3 में Al+3 एवं कार्बन की -4 है।
प्रश्न 32.
TI (+1) एवं (+3) ऑक्सीकरण अवस्था क्यों प्रदर्शित करते हैं?
उत्तर:
यह 13वाँ वर्ग का तत्त्व है जिसके बाहरी कोश का इलेक्ट्रॉनिक विन्यास ns2np1 है और यह +1 एवं +3 ऑक्सीकरण अवस्था प्रदर्शित करता है परन्तु इसमें +1 ऑक्सीकरण अवस्था +3 ऑक्सीकरण अवस्था से ज्यादा स्थायी होती है क्योंक इसमें अक्रिय युग्म प्रभाव होता है। जिसके अनुसार s कक्षक में उपस्थित इलेक्ट्रॉन युग्म अक्रिय होता है। अर्थात् यह बन्ध बनाने में प्रयुक्त नहीं होती है।
प्रश्न 33.
बोरॉन इलेक्ट्रॉन न्यून यौगिक क्यों बनाता है?
उत्तर:
बोरॉन का अपने वर्ग में सबसे छोटा आकार एवं उच्च आवेश घनत्व होता है। इस कारण यह आयनिक यौगिकों की अपेक्षा सह संयोजक यौगिकों का निर्माण करता है। इसमें 3 सहसंयोजी इलेक्ट्रॉन होने के कारण यह B+3 आयन का निर्माण करता है जो कि बहुत छोटा होने के कारण यह अष्टक की अपेक्षा षष्टक का निर्माण करता है।
प्रश्न 34.
बोरॉन के हैलाइड द्विलक नहीं बनाते जबकि AlCl3 द्विलक Al2Cl6 के रूप में संभव है क्यों?
उत्तर:
बोरॉन के हैलाइड:
- बोरॉन के छोटे आकार के कारण इसकी प्रथम तीन आयनन एन्थैल्पियों का योग बहुत अधिक होता है। अतः यह +3 ऑक्सीकरण अवस्था (B+3) नहीं दर्शाता है तथा सहसंयोजी यौगिक बनाता है।
- ऐलुमिनियम की प्रथम तीन आयनन एन्थैल्पियों का योग कम होने के कारण यह आसानी से Al+3 आयन बना लेता है।
Ga, In तथा Tl भी +3 ऑक्सीकरण अवस्था दर्शाते हैं तथा इसके साथ ही ये +1 अवस्था भी दर्शाते हैं तथा वर्ग में नीचे जाने पर भारी तत्वों में +1 अवस्था का स्थायित्व बढ़ता जाता है, इसका कारण अक्रिय युग्म प्रभाव है। d तथा f कक्षकों के दुर्बल परिरक्षण प्रभाव के कारण बढ़ा हुआ नाभिकीय आवेश ns इलेक्ट्रॉनों को प्रबलता से आकर्षित करता है जिससे s कक्षक का इलेक्ट्रॉन युग्म निष्क्रिय हो जाता है, इसे अक्रिय युग्म प्रभाव कहते हैं। यथार्थ में Ga, In एवं TI में +1 तथा +3 दोनों ऑक्सीकरण अवस्थाएँ प्रेक्षित होती हैं वर्ग में नीचे जाने पर +1 ऑक्सीकरण अवस्था को स्थायित्व बढ़ता जाता है।
Al < Ga < In < TI
- Tl में +1 ऑक्सीकरण अवस्था अधिक स्थायी होती है। जबकि T3+ प्रबल ऑक्सीकारक होता है अर्थात् इसमें इलेक्ट्रॉन ग्रहण करके +1 अवस्था में जाने की प्रवृत्ति होती है।
- +1 ऑक्सीकरण अवस्था वाले यौगिकों की आयनिक प्रकृति, +3 ऑक्सीकरण अवस्था वाले यौगिकों की तुलना में अधिक होती है।
रासायनिक अभिक्रियाशीलता की प्रवृत्ति:
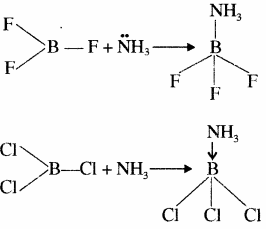
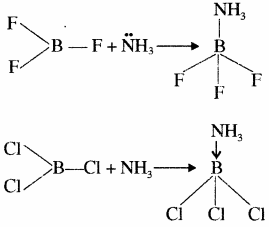
- वर्ग 13 के तत्वों की त्रिसंयोजी अवस्था में केन्द्रीय परमाणु के चारों ओर 6 इलेक्ट्रॉन होते हैं, अतः ये इलेक्ट्रॉन न्यून यौगिक होते हैं। जैसे BF3, BCl3 इत्यादि में B पर इलेक्ट्रॉन की कमी के कारण ये लूइस अम्ल की भाँति व्यवहार करते हैं। अतः ये अमोनिया से एक एकाकी इलेक्ट्रॉन युग्म ग्रहण कर उपसहसंयोजक यौगिक बनाते हैं। केन्द्रीय परमाणु पर इलेक्ट्रॉन में वृद्धि के कारण लुईस अम्लीय प्रवृत्ति कम होती है BF3 सरलता पूर्वक NH3 से एक एकाकी इलेक्ट्रॉन युग्म ग्रहण कर BF3 ← NH3 उपसहसंयोजी यौगिक बनाता है।

बोरॉन के विभिन्न ट्राइहैलाइडों की लूइस अम्ल सामर्थ्य को क्रम निम्न प्रकार होता है –
BF3 < BCl3 < BBr3< BI3
इसका कारण BF3 में F के छोटे आकार के कारण इसके एकाकी इलेक्ट्रॉन युग्म तथा B के रिक्त p – कक्षक के मध्य अधिकतम पश्च बन्धन है। - वर्ग में ऊपर से नीचे जाने पर आकार में वृद्धि होने के कारण इलेक्ट्रॉन युग्म ग्रहण करने की प्रवृत्ति कम होती है, अतः लूइस अम्ल गुण भी कम होता जाता है।
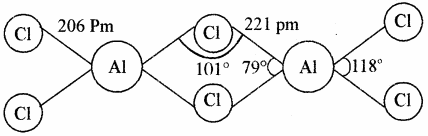
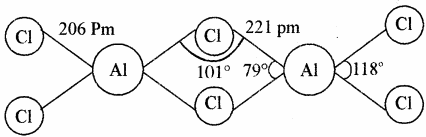
- AlCl3 में द्विलक (Dimer) बनाने की प्रवृत्ति होती है। अतः यह Al2Cl6 के रूप में पाया जाता है। AlCl3 का द्विलक चतुष्फलकीय एवं स्थायी होता है, जिसमें हैलोजेन परमाणु सेतु के रूप में उपस्थित होता है, जो धातु का अष्टक पूर्ण करता है। लेकिन B के छोटे आकार के कारण BCl3 द्विलक नहीं बनाता है।

अधिकतर त्रिसंयोजी यौगिक (MCl3) सहसंयोजी होते हैं, अतः ये आसानी से जलअपघटित हो जाते हैं तथा चतुष्फलकीय स्पीशीज [M(OH)4]– बनाते हैं जिनमें M, sp3 संकरित होता है तथा B के अतिरिक्त अन्य तत्व [M(H2O)6]3+ भी बनाते हैं। अतः AlCl3 के अम्लीय जल अपघटन से अष्टफलकीय आयन [Al(H2O)6]3+ बनता है, जिसमें Al की संकरण अवस्था sp3d2 होती है। बोरॉन में ऐसे यौगिक नहीं बनने का कारण इसमें d कक्षकों की अनुपस्थिति है।
सारणी: समूह 13 के तत्त्वों की रासायनिक अभिक्रियाशीलता रासायनिक अभिक्रिया का प्रकार सामान्य अभिक्रिया समीकरण विशिष्ट टिप्पणी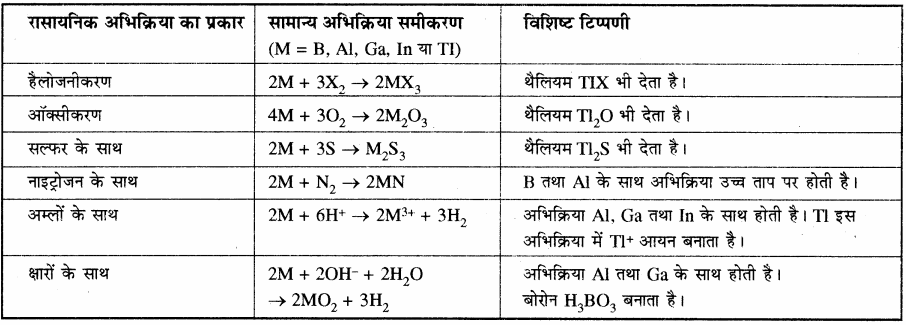
बोरॉन, अधातु के समान अभिक्रियाएँ देता है। इस प्रकार अपने समूह के अन्य सदस्यों से अलग होता है। बोरॉन अनेक धातुओं के साथ अभिक्रिया करके बोराइड बनाता है जबकि इस समूह के अन्य तत्त्व इस प्रकार की अभिक्रिया नहीं देते हैं।
वायु के प्रति अभिक्रियाशीलता:
क्रिस्टलीय बोरॉन अक्रियाशील होता है लेकिन वायु के सम्पर्क में आने पर Al की सतह पर Al2O3 की पतली परत बन जाती है, जिसके कारण आगे अभिक्रिया रुक जाती है। अक्रिस्टलीय B तथा Al को वायु के साथ गर्म करने पर ये O2 से क्रिया करके क्रमश: B2O3 तथा Al2O3 बनाते हैं। इसी प्रकार वर्ग के अन्य तत्व भी वायु की ऑक्सीजन के साथ क्रिया करके E2O3 प्रकार के ऑक्साइड बनाते हैं –![]()
13वें वर्ग के सभी तत्व उच्च ताप पर नाइट्रोजन के साथ क्रिया करके नाइट्राइड बनाते हैं –
2E (s) + N2 (g) → 2EN (s)
वर्ग में ऊपर से नीचे जाने पर ऑक्साइडों की अम्लीय प्रवृत्ति कम होती है अर्थात् क्षारीय प्रवृत्ति बढ़ती है, जैसे – B2O3 अम्लीय होता है जो क्षारीय ऑक्साइड (धातु – ऑक्साइड) से क्रिया करके धात्विक बोरेट बनाता है। ऐलुमिनियम तथा गैलियम के ऑक्साइड उभयधर्मी। होते हैं, जबकि इंडियम तथा थैलियम के ऑक्साइड क्षारीय होते हैं।
प्रश्न 35.
समूह – 14 में नीचे की ओर जाने पर श्रृंखलन की प्रवृत्ति कम हो जाती है, क्यों?
उत्तर:
वर्ग में ऊपर से नीचे जाने पर आकार बढ़ता है एवं विद्युत ऋणात्मकता घटती जाती है। इस कारण श्रृंखलन प्रवृत्ति घटती जाती है।
प्रश्न 36.
सिलिकॉन क्या है? इसका निर्माण कैसे किया जाता है?
उत्तर:
सिलिकॉन:
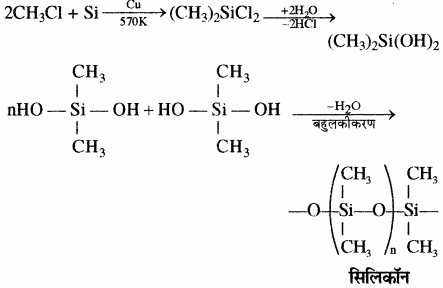
सामान्यत: सिलिकॉन![]()
श्रृंखला युक्त वे यौगिक होते हैं जिनमें ऐल्किल अथवा फेनिल समूह प्रत्येक सिलिकन परमाणु के शेष बंध स्थितियों पर होते हैं। ये जलविरोधी (Hydrophobic) प्रकृति के होते हैं। कार्बसिलिकन बहुलकों का एक वर्ग जिसमें Si – O – Si बन्ध पाया जाता है तथा एक R2SiO2 पुनरावर्ती इकाई (Repeating unit) होती है उन्हें सिलिकॉन कहा जाता है। सिलिकॉन के निर्माण में प्रयुक्त प्रारम्भिक पदार्थ ऐल्किल तथा ऐरिल प्रतिस्थापी सिलिकन क्लोराइड, [RnSiCl(4-n)] होता है। 573 K ताप पर जब मेथिल क्लोराइड, कॉपर की उपस्थिति में सिलिकन से क्रिया करता है, तो विभिन्न मेथिल प्रतिस्थापी क्लोरोसिले्न (MeSiCl3, Me2SiCl2, Me3SiCl) तथा सूक्ष्म मात्रा में Me4Si बनते हैं, यहाँ Me = CH3।
डाइमेथिल डाइक्लोरो सिलेन (CH3)2SiCl2 के जल अपघटन के पश्चात् संघनन बहुलकीकरण द्वारा श्रृंखला बहुलक बनते हैं।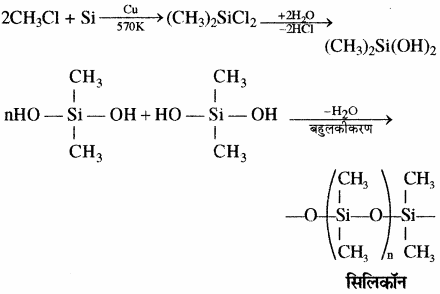
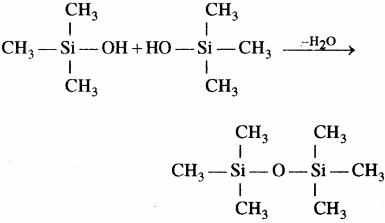
सिलिकॉन बहुलक श्रृंखला की लम्बाई को नियंत्रित करने के लिए (CH3)3SiCl मिलाया जाता है जो निम्न प्रकार सिरे को बन्द कर देता है –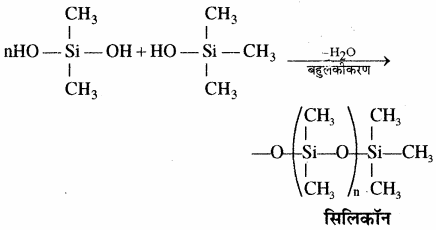
सिलिकॉन ट्राइमेथिल मोनोक्लोरोसिलेन (CH3)3SiCl के जल अपघटन से डाइसिलोक्सेन बनते हैं।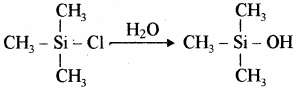
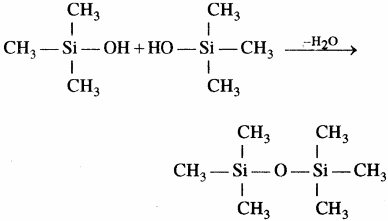
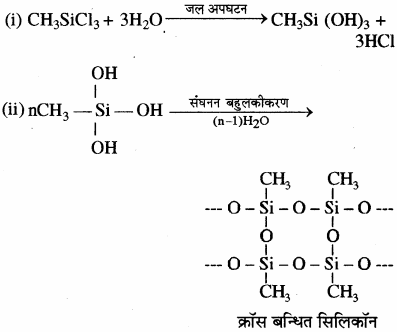
मोनोमेथिल ट्राइक्लोरोसिलेन (CH3SiCl3) के जल अपघटन से क्रास बंधित सिलिकॉन बहुलक प्राप्त होते हैं।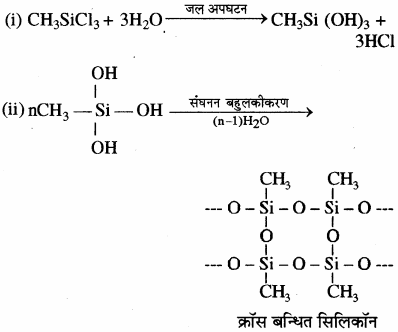
प्रश्न 37.
वाटर गैस तथा प्रोड्यूसर गैस के सूत्र दीजिए।
उत्तर:
वाटर गैस:
कोक पर भाप प्रवाहित करने पर CO तथा H2 का मिश्रण प्राप्त होता है जिसे भाप अंगार गैस (वाटर गैस) या संश्लेषण गैस कहते हैं।
C (s) + H2O (g) (underrightarrow { 472-{ 1273 } } ) CO (g) + H2 (g)
प्रोड्यूसर गैस:
इसमें भाप के स्थान पर वायु का प्रयोग भी किया जा सकता है लेकिन इस स्थिति में CO तथा N2 का मिश्रण प्राप्त होता है जिसे प्रोड्यूसर गैस कहते हैं।
2C (s) + O2 (g) + 4N2 (g) (underrightarrow { { 1273 } } ) 2CO (g) + 4N2 (g)
वाटर गैस तथा प्रोड्यूसर गैस महत्वपूर्ण औद्योगिक ईंधन हैं। इनमें उपस्थित कार्बन मोनोऑक्साइड के पुनः दहन से कार्बन डाइऑक्साइड गैस बनती है तथा इस क्रिया में ऊष्मा उत्सर्जित होती है।
प्रश्न 38.
क्या होगा जब फार्मिक अम्ल को सान्द H2SO4 की उपस्थिति में गर्म किया जाए? रासायनिक समीकरण दीजिए।
उत्तर:
फार्मिक अम्ल को सान्द्र H2SO4 की उपस्थिति में गर्म करने पर कार्बन मोनोऑक्साइड का निर्माण होता है।![]()
RBSE Class 11 Chemistry Chapter 11 निबन्धात्मक प्रश्न
प्रश्न 39.
निम्नलिखित पर टिप्पणी लिखिए –
- जीओलाइट
- सिलिकेट
- सिलिकॉन
उत्तर:
- जीओलाइट:
जब सिलिकन डाइऑक्साइड (SiO2) के त्रिविमीय जालक में से कुछ सिलिकन (Si) परमाणुओं का प्रतिस्थापन ऐलुमिनियम परमाणुओं द्वारा हो जाता है तो इससे प्राप्त सम्पूर्ण संरचना को ऐलुमिनोसिलिकेट कहते हैं जिस पर एक ऋणावेश होता है जिसका संतुलन Na+, K+ तथा Ca2+ इत्यादि धनायनों द्वारा होता है। इनके उदाहरण फेल्डस्पार तथा जीओलाइट हैं। जिओलाइट त्रिविमीय सिलिकेट होते हैं। जीओलाइट का उपयोग पेट्रोरसायन उद्योगों में हाइड्रोकार्बन के भंजन तथा समावयवीकरण में उत्प्रेरक के रूप में होता है। ZSM – 5 (जीओलाइट का एक प्रकार) का उपयोग ऐल्कोहॉल को सीधे गैसोलीन (पेट्रोल) में परिवर्तित करने में किया जाता है। जलयोजित जीओलाइट का उपयोग कठोर जल के मृदुकरण में प्रयुक्त आयन विनिमय रेजिन बनाने में किया जाता है। - सिलिकॉन:
कार्बसिलिकन बहुलकों का एक वर्ग जिसमें Si – O – Si बन्ध पाया जाता है तथा एक R2SiO2 पुनरावर्ती इकाई (Repeating unit) होती है उन्हें सिलिकॉन कहा जाता है। सिलिकॉन के निर्माण में प्रयुक्त प्रारम्भिक पदार्थ ऐल्किल तथा ऐरिल प्रतिस्थापी सिलिकन क्लोराइड, [RnSiCl(4-n)] होता है। 573 K ताप पर जब मेथिल क्लोराइड, कॉपर की उपस्थिति में सिलिकन से क्रिया करता है, तो विभिन्न मेथिल प्रतिस्थापी क्लोरोसिले्न (MeSiCl3, Me2SiCl2, Me3SiCl) तथा सूक्ष्म मात्रा में Me4Si बनते हैं, यहाँ Me = CH3।
डाइमेथिल डाइक्लोरो सिलेन (CH3)2SiCl2 के जल अपघटन के पश्चात् संघनन बहुलकीकरण द्वारा श्रृंखला बहुलक बनते हैं।
सिलिकॉन बहुलक श्रृंखला की लम्बाई को नियंत्रित करने के लिए (CH3)3SiCl मिलाया जाता है जो निम्न प्रकार सिरे को बन्द कर देता है –
सिलिकॉन ट्राइमेथिल मोनोक्लोरोसिलेन (CH3)3SiCl के जल अपघटन से डाइसिलोक्सेन बनते हैं।

मोनोमेथिल ट्राइक्लोरोसिलेन (CH3SiCl3) के जल अपघटन से क्रास बंधित सिलिकॉन बहुलक प्राप्त होते हैं।
सिलिकॉन के गुण तथा उपयोग –
(i) अध्रुवीय ऐल्किल समूहों से घिरे होने के कारण सिलिकॉन जल प्रतिकर्पि होते हैं।
(ii) सिलिकॉन्स का उष्मीय स्थायित्व तथा परावैद्युत सामर्थ्य उच्च होता है।
(iii) ये रसायनों तथा ऑक्सीकरण के प्रति, प्रतिरोधक होते हैं।
(iv) सिलिकॉन का उपयोग सीलित ग्रीस (Sealent grease), विद्युतरोधी (Electricinsulater), जलसह – वस्त्र (Waterproof fabrics) तथा शल्यक्रिया व प्रसाधन में भी किया जाता है।उदाहरण – सिलिकॉन क्या है?
हल –
सामान्यत: सिलिकॉन श्रृंखला युक्त वे यौगिक होते हैं जिनमें ऐल्किल अथवा फेनिल समूह प्रत्येक सिलिकन परमाणु के शेष बंध स्थितियों पर होते हैं। ये जलविरोधी (Hydrophobic) प्रकृति के होते हैं।
श्रृंखला युक्त वे यौगिक होते हैं जिनमें ऐल्किल अथवा फेनिल समूह प्रत्येक सिलिकन परमाणु के शेष बंध स्थितियों पर होते हैं। ये जलविरोधी (Hydrophobic) प्रकृति के होते हैं। - सिलिकेट:
सिलिकन डाइ ऑक्साइड को क्षार, क्षारीय ऑक्साइड तथा कार्बोनेटों के साथ उच्च ताप पर गर्म करने पर सिलिकेट का निर्माण होता है। ये सिलिकन – ऑक्सीजन बन्ध युक्त जटिल ठोस होते हैं।
SiO2 + CaO → CaSiO3
SiO2 + Na2CO3 → Na2SiO3 + CO2
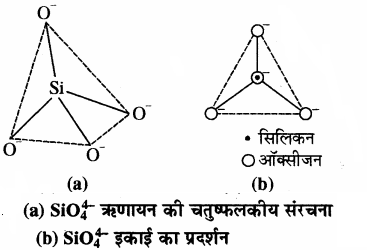
सोडियम तथा पोटेशियम के सिलिकेट जल में विलेय होते हैं, जल कांच कहलाते हैं। प्रकृति में बड़ी संख्या में सिलिकेट खनिज पाए जाते हैं। इसके कुछ महत्त्वपूर्ण उदाहरण हैं – फेल्डस्पार (feldspar), जीओलाइट (zeolite), श्वेत अभ्रक (mica) तथा ऐस्बेस्टस (asbestos)। मानव निर्मित दो महत्त्वपूर्ण सिलिकेट काँच तथा सीमेन्ट हैं। सिलिकेट की मूल संरचनात्मक इकाई SiO44- है जिसमें एक सिलिकॉन परमाणु चार ऑक्सीजन परमाणुओं से चतुष्फलकीय रूप में जुड़ा होता है। सिलिकेट में या तो एक विविक्त (Discrete) इकाई उपस्थित होती है अथवा कई सिलिकेट इकाइयाँ आपस में मिलती हैं। जिनमें प्रत्येक सिलिकेट इकाई के 1, 2, 3 अथवा 4 ऑक्सीजन परमाणु कोनों के द्वारा आपस में साझा करती है। सिलिकन ऑक्सीजन बन्ध युक्त ठोस यौगिकों को सिलिकेट कहते हैं। ये सिलिकन के ऑक्सी लवण होते हैं। इस आधार पर सिलिकेट कई प्रकार के होते हैं, जैसे – श्रृंखला (Chain), वलय (Ring), परत (layer) तथा त्रिविमीय (Three Dimensional) सिलिकेट। सिलिकेट की संरचना पर स्थित ऋणावेश, धनावेशित धातु – आयनों द्वारा उदासीन होता है। सिलिकेट में जब चारों कोने अन्य चतुष्फलकीय इकाइयों के साथ साझित होते हैं, तो त्रिविम जालक का निर्माण होता है।
प्रश्न 40.
निम्नलिखित से आप क्या समझते हैं –
- श्रृंखलन
- अक्रिय युग्म प्रभाव
- अपररूपता
उत्तर:
रासायनिक अभिक्रियाशीलता की प्रवृत्ति:
- वर्ग 13 के तत्वों की त्रिसंयोजी अवस्था में केन्द्रीय परमाणु के चारों ओर 6 इलेक्ट्रॉन होते हैं, अतः ये इलेक्ट्रॉन न्यून यौगिक होते हैं। जैसे BF3, BCl3 इत्यादि में B पर इलेक्ट्रॉन की कमी के कारण ये लूइस अम्ल की भाँति व्यवहार करते हैं। अतः ये अमोनिया से एक एकाकी इलेक्ट्रॉन युग्म ग्रहण कर उपसहसंयोजक यौगिक बनाते हैं। केन्द्रीय परमाणु पर इलेक्ट्रॉन में वृद्धि के कारण लुईस अम्लीय प्रवृत्ति कम होती है BF3 सरलता पूर्वक NH3 से एक एकाकी इलेक्ट्रॉन युग्म ग्रहण कर BF3 ← NH3 उपसहसंयोजी यौगिक बनाता है।

बोरॉन के विभिन्न ट्राइहैलाइडों की लूइस अम्ल सामर्थ्य को क्रम निम्न प्रकार होता है –
BF3 < BCl3 < BBr3 < BI3
इसका कारण BF3 में F के छोटे आकार के कारण इसके एकाकी इलेक्ट्रॉन युग्म तथा B के रिक्त p – कक्षक के मध्य अधिकतम पश्च बन्धन है। - वर्ग में ऊपर से नीचे जाने पर आकार में वृद्धि होने के कारण इलेक्ट्रॉन युग्म ग्रहण करने की प्रवृत्ति कम होती है, अतः लूइस अम्ल गुण भी कम होता जाता है।
- AlCl3 में द्विलक (Dimer) बनाने की प्रवृत्ति होती है। अतः यह Al2Cl6 के रूप में पाया जाता है। AlCl3 का द्विलक चतुष्फलकीय एवं स्थायी होता है, जिसमें हैलोजेन परमाणु सेतु के रूप में उपस्थित होता है, जो धातु का अष्टक पूर्ण करता है। लेकिन B के छोटे आकार के कारण BCl3 द्विलक नहीं बनाता है।

- अधिकतर त्रिसंयोजी यौगिक (MCl3) सहसंयोजी होते हैं, अतः ये आसानी से जलअपघटित हो जाते हैं तथा चतुष्फलकीय स्पीशीज [M(OH)4]– बनाते हैं जिनमें M, sp3 संकरित होता है तथा B के अतिरिक्त अन्य तत्व [M(H2O)6]3+ भी बनाते हैं। अतः AlCl3 के अम्लीय जल अपघटन से अष्टफलकीय आयन [Al(H2O)6]3+ बनता है, जिसमें Al की संकरण अवस्था sp33d2 होती है। बोरॉन में ऐसे यौगिक नहीं बनने का कारण इसमें d कक्षकों की अनुपस्थिति है।
सारणी: समूह 13 के तत्त्वों की रासायनिक अभिक्रियाशीलता रासायनिक अभिक्रिया का प्रकार सामान्य अभिक्रिया समीकरण विशिष्ट टिप्पणी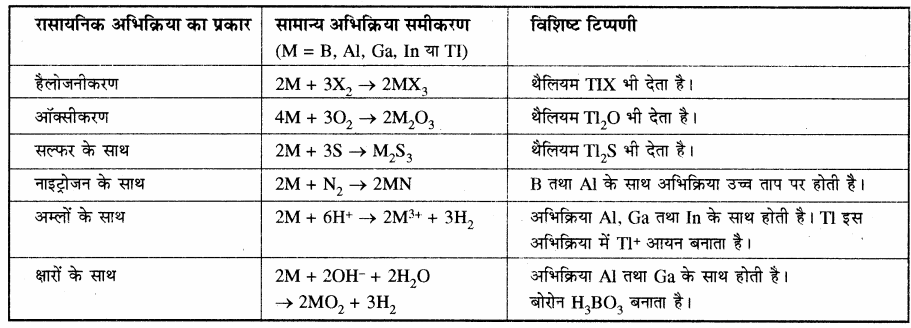 बोरॉन, अधातु के समान अभिक्रियाएँ देता है। इस प्रकार अपने समूह के अन्य सदस्यों से अलग होता है। बोरॉन अनेक धातुओं के साथ अभिक्रिया करके बोराइड बनाता है जबकि इस समूह के अन्य तत्त्व इस प्रकार की अभिक्रिया नहीं देते हैं।
बोरॉन, अधातु के समान अभिक्रियाएँ देता है। इस प्रकार अपने समूह के अन्य सदस्यों से अलग होता है। बोरॉन अनेक धातुओं के साथ अभिक्रिया करके बोराइड बनाता है जबकि इस समूह के अन्य तत्त्व इस प्रकार की अभिक्रिया नहीं देते हैं।
वायु के प्रति अभिक्रियाशीलता:
क्रिस्टलीय बोरॉन अक्रियाशील होता है लेकिन वायु के सम्पर्क में आने पर Al की सतह पर Al2O3 की पतली परत बन जाती है, जिसके कारण आगे अभिक्रिया रुक जाती है। अक्रिस्टलीय B तथा Al को वायु के साथ गर्म करने पर ये O2 से क्रिया करके क्रमश: B2O3 तथा Al2O3 बनाते हैं। इसी प्रकार वर्ग के अन्य तत्व भी वायु की ऑक्सीजन के साथ क्रिया करके E2O3 प्रकार के ऑक्साइड बनाते हैं –![]()
13वें वर्ग के सभी तत्व उच्च ताप पर नाइट्रोजन के साथ क्रिया करके नाइट्राइड बनाते हैं –
2E (s) + N2 (g) → 2EN (s)
वर्ग में ऊपर से नीचे जाने पर ऑक्साइडों की अम्लीय प्रवृत्ति कम होती है अर्थात् क्षारीय प्रवृत्ति बढ़ती है, जैसे – B2O3 अम्लीय होता है जो क्षारीय ऑक्साइड (धातु – ऑक्साइड) से क्रिया करके धात्विक बोरेट बनाता है। ऐलुमिनियम तथा गैलियम के ऑक्साइड उभयधर्मी। होते हैं, जबकि इंडियम तथा थैलियम के ऑक्साइड क्षारीय होते हैं।
कार्बन (Allotropes): कार्बन में अपररूपता दर्शाने का गुण पाया जाता है।
अपररूपता:
अधात्विक तत्वों का वह गुण जिसमें कोई तत्व प्रकृति में दो या दो से अधिक भिन्न रूपों में पाया जाता है। इन रूपों को अपररूप कहते हैं तथा यह गुण अपररूपता कहलाता है। अपररूपों के भौतिक गुण भिन्न – भिन्न होते हैं, परन्तु इनकी अधिकांश रासायनिक अभिक्रियाएँ समान होती हैं। कार्बन के दो प्रकार के अपररूप होते हैं – क्रिस्टलीय तथा अक्रिस्टलीय।
हीरा तथा ग्रेफाइट कार्बन के दो प्रमुख क्रिस्टलीय अपररूप हैं। कार्बन का तीसरा क्रिस्टलीय अपररूप फुलरीन है जिसकी खोज एच.डब्ल्यू. क्रोटो; ई. स्मैले तथा आर.एफ. कर्ल ने 1985 में की थी, जिसके कारण इन्हें 1996 में नोबेल पुरस्कार दिया गया था।
हीरा:
हीरा में क्रिस्टलीय जालक होता है। इसमें प्रत्येक कार्बन परमाणु sp3 संकरित अवस्था में होता है तथा अन्य चार कार्बन परमाणुओं से चतुष्फलकीय ज्यामिति में जुड़ा होता है। इसमें कार्बन – कार्बन बंध लम्बाई 154 pm होती है तथा कार्बन परमाणु द्विक् (space) में दृढ़ त्रिविमीय जालक (rigid three dimensional network) का निर्माण करते हैं। हीरे की संरचना में सम्पूर्ण जालक में दिशात्मक सहसंयोजक बंध पाए जाते हैं। अतः इस विस्तृत सहसंयोजक बंधन को तोड़ना कठिन होता है, इसलिए हीरा पृथ्वी पर पाया जाने वाला सर्वाधिक कठोर ठोस पदार्थ है। इसका घनत्व, गलनांक तथा अपवर्तनांक उच्च होता है। हीरे में मुक्त इलेक्ट्रॉन अनुपस्थित होने के कारण यह विद्युत का कुचालक होता है। यह अक्रिय होता है लेकिन उच्च ताप (975K) पर ऑक्सीजन में जल कर CO2 बनाता है। हीरे का उपयोग धार तेज करने के लिए अपघर्षण (Abrasive) के रूप में, रूपदा (Dies) बनाने में तथा प्रकाश विद्युत लैम्प में टंग्स्टन तंतु बनाने में किया जाता है।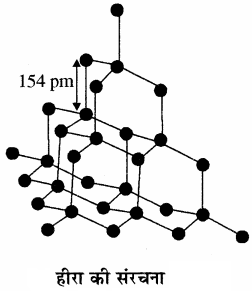
ग्रेफाइट:
ग्रेफाइट गहरे धूसर रंग का होता है तथा इसकी परतीय संरचना (layered structure) होती है। ये परतें वान्डरवाल बलों द्वारा जुड़ी होती हैं तथा दो परतों के बीच की दूरी 340 pm होती है। प्रत्येक परत में कार्बन परमाणु षट्कोणीय वलय के रूप में व्यवस्थित होते हैं, जिसमें C – C बंध लम्बाई 141.5 pm होती है। इसमें प्रत्येक कार्बन परमाणु sp2 संकरित होता है तथा तीन निकटवर्ती कार्बन परमाणुओं से तीन सिग्मा बंध बनाता है। जबकि चौथा इलेक्ट्रॉन -बंध बनाता है। ये इलेक्ट्रॉन परतों के मध्य विस्थानीकृत तथा गतिशील होते हैं, अतः ग्रेफाइट विद्युत का सुचालक होता है तथा ग्रेफाइट को आसानी से तोड़ा जा सकता है। इसी कारण ग्रेफाइट मुलायम (soft) तथा चिकना (slippery) होता है।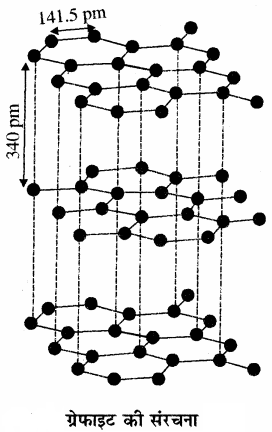
ग्रेफाइट में धात्विक चमक होती है तथा यह कार्बन का स्थायी अपररूप है। उच्च ताप पर जिन मशीनों में स्नेहक के रूप में तेल का प्रयोग नहीं हो सकता उनमें ग्रेफाइट को शुष्क स्नेहक के रूप में प्रयुक्त किया जाता है।
फुलरीन्स:
एच.डब्ल्यू. क्रोटो, ई स्मैले तथा आर.एफ. कर्ल ने सन् 1985 में कार्बन के एक अन्य रूप फुलरीन की खोज की। इस खोज के कारण इन्हें सन् 1996 में नोबेल पुरस्कार प्रदान किया गया। हीलियम, आर्गन आदि उत्कृष्ट गैसों की उपस्थिति में ग्रेफाइट को विद्युत आर्क (Electric arch) में गर्म करने पर फुलरीन का निर्माण होता है। वाष्पित तथा छोटे Cn अणुओं को संघनित करने पर एक कज्जली पदार्थ प्राप्त होता है जिसमें मुख्यत: C60, कुछ मात्रा में C70 तथा अतिसूक्ष्म मात्रा में 350 या अधिक समसंख्या (even number) में कार्बन फुलरीन में पाए जाते हैं। फुलरीन कार्बन का शुद्धतम रूप है, क्योंकि फुलरीन में किसी प्रकार का झूलता बंध (dangling bonds) नहीं होता है। फुलरीन की संरचना पिंजरानुमा होती है। (C60) अणु की आकृति सॉकर बॉल (फुटबॉल) के समान होती है। अतः इसे बकमिन्स्टर फुलरीन (Buckminster) या बकी बॉल (Bucky ball) भी कहा जाता है।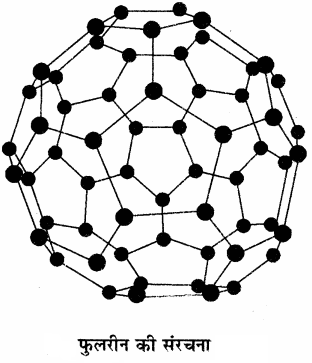
फुलरीन की संरचना फुलरीन में बीस वलय, छः सदस्यीय (षट्कोणीय) तथा बारह वलय, पाँच सदस्यीय (पंचकोणीय) होती हैं। एक छः सदस्यीय वलय छः अथवा पाँच सदस्यीय वलय के साथ संगलित (Fused) होती है, जबकि पाँच सदस्यीय वलय केवल छः सदस्यीय वलय के साथ संगलित होती है। फुलरीन के सभी कार्बन परमाणु समान होते हैं तथा ये sp2 संकरित होते हैं। इसका प्रत्येक कार्बन परमाणु अन्य तीन कार्बन परमाणुओं के साथ तीन बंध बनाता है तथा चौथा इलेक्ट्रॉन पूरे अणु पर विस्थानीकृत रहता है, अत: फुलरीन में ऐरोमैटिक गुण होता है। फुलरीन के गेंदनुमा अणु में 60 उदग्र (vertices) होते हैं तथा प्रत्येक उदग्र पर एक कार्बन परमाणु होता है जिस पर एकल तथा द्विबंध दोनों होते हैं, जिनकी C – C बन्ध लम्बाई क्रमशः 143.5 pm तथा 138.3 pm होती है। फुलरीन एक सममित अणु है तथा इसके यौगिक विद्युत का चालन करते हैं। ऊष्मागतिक रूप से कार्बन का सर्वाधिक स्थायी अपररूप ग्रेफाइट है, अतः इसकी मानक संभवन ऊष्मा (ΔfH⊝) को शून्य माना जाता है तथा हीरा व फुलरीन के लिए ये मान क्रमशः 1.90 तथा 38.1 kJ mol-1 होते हैं। कार्बन के अन्य रूप कार्बन ब्लैक, कोक तथा चारकोल हैं। जो कि ग्रेफाइट तथा फुलरीन के अशुद्ध रूप होते हैं। जब हाइड्रोकार्बन को वायु की सीमित मात्रा में जलाया जाता है तो कार्बन ब्लैक प्राप्त होता है तथा लकड़ी या कोयला को वायु की अनुपस्थिति में गर्म करने पर चारकोल तथा कोक प्राप्त होते हैं।
प्रश्न 41.
निम्नलिखित समीकरणों को पूर्ण करते हुए सन्तुलित कीजिए –
(i) ZnO+ CO →
(ii) C + H2O →
(iii) B2H6+ O2 →
(iv) H3BO3 (underrightarrow { Delta } )
(v) Al + NaOH →
(vi) BF3 + NH3 →
उत्तर: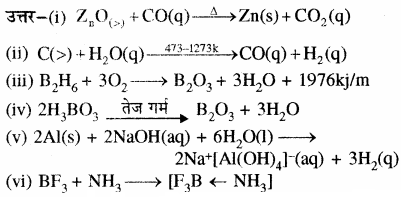
प्रश्न 42.
इलेक्ट्रॉन न्यून यौगिक क्या होते हैं? क्या BCl3 तथा SiCl4 इलेक्ट्रॉन न्यून यौगिक हैं? समझाइये।
उत्तर:
वे सहसंयोजक यौगिक जिनमें केन्द्रीय परमाणु में इलेक्ट्रॉन की कमी होती है अर्थात् वे लूइस अम्ल की भाँति व्यवहार प्रदर्शित करते हैं। इनके अपूर्ण अष्टक के कारण इनका एक रिक्त P2 कक्षक हैलोजन परमाणु के आबन्धी इलेक्ट्रॉन युग्म युक्त P2 कक्षक के साथ अतिव्यापन कर लेती है उन्हें इलेक्ट्रॉन न्यून यौगिक कहते हैं। BCl3 एवं SiCl4 इलेक्ट्रॉन न्यून यौगिक होते हैं। BCl3 में बोरोन परमाणु पर रिक्त P कक्षक एवं अष्टक अपूर्ण होने के कारण यह इलेक्ट्रॉन न्यून होता है। अतः इलेक्ट्रॉन को ग्रहण करने की प्रवृत्ति बहुत प्रदत्त होती है। इस कारण यह प्रबल इलेक्ट्रॉन ग्राही के रूप में कार्य करता है। इसी प्रकार SiCl4 हैलाइड आयनों के साथ हेक्सा हेलो संकुल बनाते हैं जिससे Si की उपसहसंयोजन संख्या 4 से बढ़कर 6 हो जाती है अर्थात् SiCl4 हैलाइड आयनों से इलेक्ट्रॉन युग्म ग्रहण करके इलेक्ट्रॉन न्यून यौगिक एवं प्रबल लूइस अम्ल के समान व्यवहर प्रदर्शित करता है।
प्रश्न 43.
निम्नलिखित को कारण सहित समझाइए –
- लेड (+2) क्लोराइड Cl2 से क्रिया कर PbCl4 देता है।
- लेड (+4) क्लोराइड उष्मा के प्रति अत्यधिक स्थाई है।
- सान्द HNO3 का परिवहन ऐलुमिनियम के पात्र द्वारा किया जा सकता है।
- ग्रेफाइट शुष्क स्नेहक के रूप में प्रयुक्त होता है।
उत्तर:
- लेड (+2) क्लोराइड Cl2 से क्रिया कर PbCl4 देता है –
Be2C एवं Al4C3 में कार्बन की अवस्था -4 होती है। Be2C में Be+2 एवं कार्बाइड -4 है। इसी प्रकार Al4C3 में Al+3 एवं कार्बन की -4 है। - लेड (+4) क्लोराइड उष्मा के प्रति अत्यधिक स्थाई है –
बोरॉन का अपने वर्ग में सबसे छोटा आकार एवं उच्च आवेश घनत्व होता है। इस कारण यह आयनिक यौगिकों की अपेक्षा सह संयोजक यौगिकों का निर्माण करता है। इसमें 3 सहसंयोजी इलेक्ट्रॉन होने के कारण यह B+3 आयन का निर्माण करता है जो कि बहुत छोटा होने के कारण यह अष्टक की अपेक्षा षष्टक का निर्माण करता है। - सान्द HNO3 का परिवहन ऐलुमिनियम के पात्र द्वारा किया जा सकता है –
ऐलुमिनियम की रासायनिक अभिक्रियाशीलता बहुत कम होती है। क्योंकि इसकी सतह पर अक्रिय ऑक्साइड की परत का निर्माण हो जाता है। इसी कारण ऐलुमिनियम सान्द्र नाइट्रिक अम्ल के प्रति निष्क्रिय होता है, अमलगमित ऐलुमिनियम तल पर ऑक्साइड परत नहीं चढ़ती है अतः अमलगमित ऐलुमिनियम कमरे के ताप पर शीघ्रता से वायुमण्डलीय ऑक्सीजन तथा जल द्वारा ऑक्सीकृत हो जाते हैं। ऐलुमिनियम खनिज अम्लों तथा जलीय क्षारों से क्रिया करके उनमें घुल जाता है, अतः यह उभयधर्मी होता है। यह तनु HCl से क्रिया करके हाइड्रोजन उत्सर्जित करता है।
2Al (s) + 6HCl (aq) → 2Al3+(aq) + 6Cl–(aq) + 3H2
सान्द्र नाइट्रिक अम्ल, ऐलुमिनियम की सतह पर ऑक्साइड की परत बनाकर उसे निष्क्रिय बना देता है। लेकिन ऐलुमिनियम तनु H2SO4 से क्रिया करके हाइड्रोजन गैस मुक्त करता है। 2Al (s) + 3H2SO4 (aq) →Al2(SO4)3 (aq) + 3H2 (g)
तनु
Al सान्द्र H2SO4 को SO2 में अपचयित कर देते हैं।
2Al (s) + 6H2SO4 (l) → Al2(SO4)3 + 3SO2 (g) + 6H2O (l)
सान्द्र ऐलुमिनियम जलीय NaOH (क्षार) के साथ क्रिया करके हाइड्रोजन गैस देता है तथा एक संकुल यौगिक बनाता है।
- ग्रेफाइट शुष्क स्नेहक के रूप में प्रयुक्त होता है –
ग्रेफाइट गहरे धूसर रंग का होता है तथा इसकी परतीय संरचना (layered structure) होती है। ये परतें वान्डरवाल बलों द्वारा जुड़ी होती हैं तथा दो परतों के बीच की दूरी 340 pm होती है। प्रत्येक परत में कार्बन परमाणु षट्कोणीय वलय के रूप में व्यवस्थित होते हैं, जिसमें C – C बंध लम्बाई 141.5 pm होती है। इसमें प्रत्येक कार्बन परमाणु sp2 संकरित होता है तथा तीन निकटवर्ती कार्बन परमाणुओं से तीन सिग्मा बंध बनाता है। जबकि चौथा इलेक्ट्रॉन -बंध बनाता है। ये इलेक्ट्रॉन परतों के मध्य विस्थानीकृत तथा गतिशील होते हैं, अतः ग्रेफाइट विद्युत का सुचालक होता है तथा ग्रेफाइट को आसानी से तोड़ा जा सकता है। इसी कारण ग्रेफाइट मुलायम (soft) तथा चिकना (slippery) होता है।
ग्रेफाइट में धात्विक चमक होती है तथा यह कार्बन का स्थायी अपररूप है। उच्च ताप पर जिन मशीनों में स्नेहक के रूप में तेल का प्रयोग नहीं हो सकता उनमें ग्रेफाइट को शुष्क स्नेहक के रूप में प्रयुक्त किया जाता है।
All Chapter RBSE Solutions For Class 11 Chemistry Hindi Medium
—————————————————————————–
All Subject RBSE Solutions For Class 11 Hindi Medium
*************************************************
————————————————————
All Chapter RBSE Solutions For Class 11 Chemistry Hindi Medium
All Subject RBSE Solutions For Class 11 Hindi Medium
Remark:
हम उम्मीद रखते है कि यह RBSE Class 11 chemistry Solutions in Hindi आपकी स्टडी में उपयोगी साबित हुए होंगे | अगर आप लोगो को इससे रिलेटेड कोई भी किसी भी प्रकार का डॉउट हो तो कमेंट बॉक्स में कमेंट करके पूंछ सकते है |
यदि इन solutions से आपको हेल्प मिली हो तो आप इन्हे अपने Classmates & Friends के साथ शेयर कर सकते है और HindiLearning.in को सोशल मीडिया में शेयर कर सकते है, जिससे हमारा मोटिवेशन बढ़ेगा और हम आप लोगो के लिए ऐसे ही और मैटेरियल अपलोड कर पाएंगे |
आपके भविष्य के लिए शुभकामनाएं!!
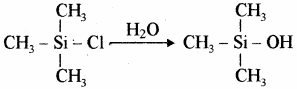
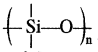 श्रृंखला युक्त वे यौगिक होते हैं जिनमें ऐल्किल अथवा फेनिल समूह प्रत्येक सिलिकन परमाणु के शेष बंध स्थितियों पर होते हैं। ये जलविरोधी (Hydrophobic) प्रकृति के होते हैं।
श्रृंखला युक्त वे यौगिक होते हैं जिनमें ऐल्किल अथवा फेनिल समूह प्रत्येक सिलिकन परमाणु के शेष बंध स्थितियों पर होते हैं। ये जलविरोधी (Hydrophobic) प्रकृति के होते हैं।