हेलो स्टूडेंट्स, यहां हमने राजस्थान बोर्ड कक्षा 11वीं की रसायन विज्ञान सॉल्यूशंस को दिया हैं। यह solutions स्टूडेंट के परीक्षा में बहुत सहायक होंगे | Student RBSE solutions for Class 11 Chemistry Chapter 12 कुछ मूल सिद्धान्त और तकनीकें pdf Download करे| RBSE solutions for Class 11 Chemistry Chapter 12 कुछ मूल सिद्धान्त और तकनीकें notes will help you.
Table of Contents
Rajasthan Board RBSE Class 11 Chemistry Chapter 12 कार्बनिक रसायन: कुछ मूल सिद्धान्त और तकनीकें
RBSE Class 11 Chemistry Chapter 12 पाठ्यपुस्तक के अभ्यास प्रश्न
RBSE Class 11 Chemistry Chapter 12 वस्तुनिष्ठ प्रश्न
प्रश्न 1.
निम्नलिखित में से किस विधि द्वारा नाइट्रोजन का निर्धारण किया जाता है?
(अ) लीबिंग विधि
(ब) लैसे विधि
(स) जैल्डाल विधि
(द) केरियस विधि
प्रश्न 2.
नाइट्रोजन युक्त कार्बनिक यौगिक को सोडियम धातु के साथ संगलित करने पर बना सोडियम लवण है –
(अ) NaNO2
(ब) NaNO3
(स) NaCN
(द) NaNH2
प्रश्न 3.
आइसोब्यूटेन का IUPAC नाम है –
(अ) 2 – मेथिल ब्यूटेन
(ब) 2 – मेथिल प्रोपेन
(स) 2 – ऐथिल ब्यूटेन
(द) 2 – ब्यूटाइन
प्रश्न 4.
– COOR क्रियात्मक समूह का पूर्वलग्न है –
(अ) कार्बोमायल
(ब) कार्बोनिल
(स) कार्बोक्सी
(द) ऐल्कॉक्सीकार्बोनिल
प्रश्न 5.
निम्नलिखित में से कौनसा प्रतिस्थापी समूह +1 प्रभाव नहीं दर्शाता है –
(अ) – CHO
(ब) – CH3
(स) – CH2R
(द) – CHR2
प्रश्न 6.
निम्नलिखित में कौनसा अभिकर्मक नाभिकस्नेही है –
(अ) Br+
(ब) R – OH
(स) FeCl3
(द) CO2
प्रश्न 7.
निम्नलिखित में सबसे स्थायी कार्बधनायन है –
प्रश्न 8.
समांश विदलन से बनता है –
(अ) कार्बधनायन
(ब) कार्बन
(स) नाइट्रीन
(द) मुक्तमूलक
प्रश्न 9.
निम्नलिखित में कौनसा समूह योगात्मक अभिक्रिया नहीं देता है –
(अ) C ≡ C
(ब) C = C
(स) C = O
(द) CH3 – CH3 (C – C)
उत्तरमाला:
1. (स)
2. (स)
3. (ब)
4. (द)
5. (अ)
6. (ब)
7. (द)
8. (द)
9. (द)
RBSE Class 11 Chemistry Chapter 12 अतिलघूत्तरात्मक प्रश्न
प्रश्न 10.
– I प्रेरणिक प्रभाव के दो उदाहरण दीजिये।
उत्तर:
– CN तथा – COOH समूह – I प्रभाव दर्शाते हैं।
प्रश्न 11.
दो उदासीन एवं दो ऋणात्मक आवेश के नाभिक स्नेही के नाम लिखिये।
उत्तर:
उदासीन नाभिक स्नेही –![]()
तथा![]()
ऋणात्मक आवेश युक्त नाभिक स्नेही – (bar { C } )l तथा R(bar { O } )।
प्रश्न 12,
हेलोजनों का निर्धारण की जाने वाली विधि का नाम बताइये।
उत्तर: कैरियस विधि।
प्रश्न 13.
जेल्डाल (केल्डाल) विधि में नाइट्रोजन प्रतिशतता का समीकरण लिखो।
उत्तर:
नाइट्रोजन की प्रतिशतता![]()
N1 = अम्ल की नार्मलता,
V1 = प्रयुक्त अम्ल का आयतन
W = कार्बनिक यौगिक का द्रव्यमान
प्रश्न 14.
कार्बन एवं हाइड्रोजन का निर्धारण किस विधि से किया जाता है, नाम लिखिए।
उत्तर: लीबिंग की दहन विधि।
प्रश्न 15.
अनुनाद को परिभाषित कीजिए।
उत्तर:
किसी यौगिक की एक से अधिक संरचनाएँ होने पर उनमें से किसी एक संरचना द्वारा उस यौगिक के सभी गुणों को नहीं समझाया जा सकता तो इन संरचनाओं को अनुनादी संरचनाएँ कहते हैं तथा वास्तविक यौगिक इन सभी संरचनाओं के मिश्रित रूप (अनुनाद संकर) के समान व्यवहार करता है तो इस गुण को अनुनाद कहते हैं।
प्रश्न 16.
कार्बऋणायन में कार्बन परमाणु का संकरण बताइए।
उत्तर:
कार्बऋणायन में कार्बन परमाणु sp3 संकरित होता है।
प्रश्न 17.
प्राथमिक, द्वितीयक एवं तृतीयक कार्बधनायनों के स्थायित्व का क्रम लिखिए।
उत्तर:
प्राथमिक < द्वितीयक < तृतीयक
प्रश्न 18.
कार्बान को परिभाषित कीजिए।
उत्तर:
किसी अभिक्रिया में एक ही कार्बन परमाणु से समॉश विखण्डन द्वारा दो समूह निकलने पर प्राप्त मध्यवर्ती को कार्बान कहते हैं। इस कार्बन पर दो अयुग्मित इलेक्ट्रॉन होते हैं।
प्रश्न 19.
ट्राई मेथिल मेथेन का IUPAC नाम लिखिये।
उत्तर: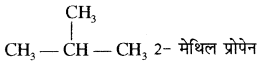
प्रश्न 20.
OHC – CH2 – CH2 – COOH का IUPAC नाम लिखिये।
उत्तर:
4 – ऑक्सो ब्यूटेनोइक अम्ल।
प्रश्न 21.
– OH समूह का पूर्व लग्न और अनुलग्न नाम लिखिये।
उत्तर:
– OH समूह का पूर्वलग्न हाइड्रॉक्सी तथा अनुलग्न ऑल होता है।
प्रश्न 22.
CH3 – CH2 – C ≡ C – CH2 – CH2 का व्युत्पन्न प्रणाली में नाम लिखिये।
उत्तर: डाइएथिल एसीटिलीन।
प्रश्न 23.
दो निकटतम सजात अणुसूत्र के अणुभार में कितना अन्तर होता है?
उत्तर: 14 का।
प्रश्न 24.
दो एरोमैटिक विषम चक्रीयों के नाम एवं संरचना लिखिये।
उत्तर: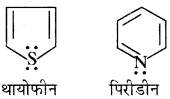
RBSE Class 11 Chemistry Chapter 12 लघूत्तरात्मक प्रश्न
प्रश्न 25.
नाइट्रोजन, सल्फर तथा हैलोजनों का परीक्षण किस विधि के द्वारा किया जाता है?
उत्तर:
- नाइट्रोजन का परीक्षण – यौगिक के लैसे विलयन को आयरन (II) सल्फेट (FeSO4) तथा NaOH विलयन के साथ उबालकर विलयन में FeCl3 की कुछ बूंदें मिलाते हैं। अब इसमें 3 – 4 बूंद सान्द्र HCl या H2SO4 मिलाने पर प्रशियन ब्लू रंग आता है। इससे नाइट्रोजन की उपस्थिति निश्चित होती है।
- सल्फर का परीक्षण – लैसे विलयन में 3 – 4 बूंदें सोडियम नाइट्रोप्रसाइड विलयन की मिलाने पर बैंगनी रंग आता है तो यौगिक में सल्फर उपस्थित है।
- हैलोजनों का परीक्षण – सोडियम संगलन निष्कर्ष लैसे विलयन को नाइट्रिक अम्ल द्वारा अम्लीकृत करके उसमें सिल्वर नाइट्रेट (AgNO3) विलयन मिलाते हैं तो अमोनियम हाइड्रॉक्साइड में विलेय श्वेत अवक्षेप क्लोरीन की उपस्थिति को, अमोनियम हाइड्रॉक्साइड में अल्प – विलेय पीला अवक्षेप ब्रोमील की उपस्थिति को तथा अमोनियम हाइड्रॉक्साइड में अविलेय पीला अवक्षेप आयोडीन की उपस्थिति को सिद्ध करता है।
प्रश्न 26.
निम्नलिखित यौगिकों के संरचना सूत्र तथा IUPAC नाम दीजिए –
- फॉर्मिक अम्ल
- ऐथिल ऐसीटेट
- ऐथिलमेथिल ईथर।
उत्तर:
1. फॉमिक अम्ल – HCOOH मेथेनोइक अम्ल
2. ऐथिल ऐसीटेट –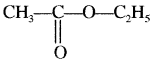
एथिल एथेनोएट
3. एथिल मेथिल ईथर – CH3 – CH2 – O – CH3 मेथॉक्सी एथेन।
प्रश्न 27.
समांश एवं विषमांश विखण्डन में क्या अन्तर है?
उत्तर:
- समांश विखण्डन में विदलित होने वाले बन्ध के साझित इलेक्ट्रॉन युग्म के एक – एक इलेक्ट्रॉन दोनों परमाणुओं पर चले जाते हैं। तथा मुक्त मूलक बनते हैं जबकि विषमांश विखण्डन में बन्ध के दोनों इलेक्ट्रॉन एक ही परमाणु पर चले जाते हैं जिससे आयन बनते हैं।
- समांश विखण्डन उच्च ताप, प्रकाश तथा अध्रुवीय माध्यम द्वारा होता है जबकि विषमांश विखण्डन निम्न ताप तथा ध्रुवीय माध्यम द्वारा होता है।
प्रश्न 28.
– I प्रेरणिक प्रभाव दर्शाने वाले दो उदाहरण लिखिए।
उत्तर:
– NO2 तथा – CN, – I प्रेरणिक प्रभाव दर्शाते हैं।
प्रश्न 29.
किन्हीं चार उदासीन इलेक्ट्रानस्नेही के उदाहरण दीजिये।
उत्तर:
SO3, AlCl3, BF3 तथा FeCl3 ऐसे उदासीन यौगिक हैं। जो इलेक्ट्रॉन स्नेही के समान व्यवहार करते हैं।
प्रश्न 30.
निम्नलिखित में +1 प्रभाव के घटते हुए क्रम में व्यवस्थित कीजिए – (CH3)2CH -, CH3 -, (CH3)3C -,CH3 CH2 -.
उत्तर:
(CH3)3 C – > (CH3)2CH – > CH3 – CH2 – > CH3 –
+1 प्रभाव का घटता क्रम
प्रश्न 31.
एल्केन, एल्कीन एवं एल्केनोन की तृतीय समजात के नाम एवं संरचना लिखिए।
उत्तर:
1. एल्केन – CH3 – CH2 – CH3 प्रोपेन
2. एल्कीन – CH3 – CH2 – CH = CH2 ब्यूट – 1 – ईन
3.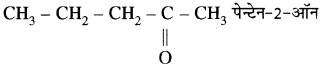
प्रश्न 32.
एल्केनों को पेराफिन्स क्यों कहते हैं?
उत्तर:
एल्केनों को पेराफिन्स भी कहा जाता है, क्योंकि ये बहुत कम क्रियाशील होते हैं तथा लैटिन भाषा में Para का अर्थ है कम तथा affins का अर्थ है क्रियाशीलता। इस कम क्रियाशीलता का कारण इनमें प्रबल σ बन्धों का पाया जाना है।
प्रश्न 33.
क्लोरोफार्म, फार्मिक अम्ल एवं आइसो पेन्टेन के IUPAC नाम लिखिए।
उत्तर: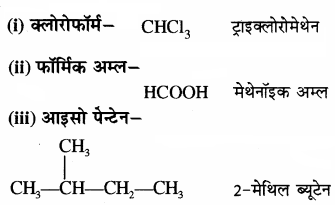
प्रश्न 34.
आइसोब्यूटिल एल्कोहॉल एवं ब्यूटिल क्लोराइड के सूत्र लिखिये।
उत्तर:
1. आइसोब्यूटिल एल्कोहॉल –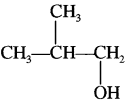
2. ब्यूटिल क्लोराइड –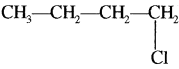
प्रश्न 35.
निम्नलिखित को इलेक्ट्रॉनस्नेही एवं नाभिकस्नेही में विभेदित कीजिए – NH3, BF3, H2O, FeCl3, (bar { O } )H, H3(overset { + }{ O } ), SO3, :CCl2.
उत्तर:
1. इलेक्ट्रॉनस्नेही – BF3, FeCl3, H3(overset { + }{ O } ), SO3, :CCl2
2. नाभिकस्नेही – NH3, H2O, (bar { O } )H
प्रश्न 36.
इलेक्ट्रॉनस्नेही योगात्मक अभिक्रियाएँ किन यौगिकों में पायी जाती हैं? समझाइये।
उत्तर:
इलेक्ट्रॉनस्नेही योगात्मक अभिक्रिया एल्कीनों तथा एल्काइनों में पायी जाती है। ये निम्न प्रकार होती हैं –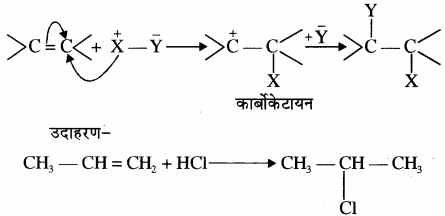
प्रश्न 37.
पुनर्विन्यास अभिक्रिया उदाहरण सहित समझाइए।
उत्तर:
वह अभिक्रिया जिसमें किसी यौगिक में उत्प्रेरक, ताप तथा दाब के द्वारा परमाणु या समूहों की स्थिति बदल जाती है, जिससे एक नया यौगिक बनता है इसे पुनर्विन्यास अभिक्रिया कहते हैं। उदाहरण: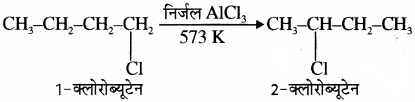
प्रश्न 38.
संमांश एवं विषमांश विखण्डन में अन्तर कीजिए।
उत्तर:
- समांश विखण्डन में विदलित होने वाले बन्ध के साझित इलेक्ट्रॉन युग्म के एक – एक इलेक्ट्रॉन दोनों परमाणुओं पर चले जाते हैं। तथा मुक्त मूलक बनते हैं जबकि विषमांश विखण्डन में बन्ध के दोनों इलेक्ट्रॉन एक ही परमाणु पर चले जाते हैं जिससे आयन बनते हैं।
- समांश विखण्डन उच्च ताप, प्रकाश तथा अध्रुवीय माध्यम द्वारा होता है जबकि विषमांश विखण्डन निम्न ताप तथा ध्रुवीय माध्यम द्वारा होता है।
प्रश्न 39.
मुक्तमूलक अभिक्रिया समझाइए।
उत्तर:
वे अभिक्रियाएँ जिनमें मुक्तमूलक, मध्यवर्ती के रूप में बनता है उन्हें मुक्त मूलक अभिक्रिया कहते हैं। इन अभिक्रियाओं में समांश विखण्डन होता है।
उदाहरण:
1. मुक्तमूलक प्रतिस्थापन अभिक्रिया – CH +Cl2 (underrightarrow { hv } ) CH3Cl+HCl
2. मुक्त मूलक योगात्मक अभिक्रिया –![]()
मुक्तमूलक अभिक्रियाएँ श्रृंखला अभिक्रियाएँ कहलाती हैं।
प्रश्न 40.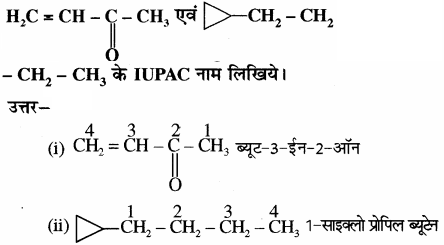
प्रश्न 41.
2 – मेथॉक्सी – 2 – मेथिल प्रोपेन का संरचना सूत्र दीजिये।
उत्तर:
प्रश्न 42.
थायोफीन एवं पिरीडीन में उपस्थित विषम परमाणु बताइये।
उत्तर:
थायोफीन तथा पिरीडीन के संरचना सूत्र निम्नलिखित हैं –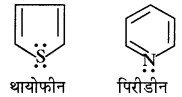
अतः इनमें विषम परमाणु सल्फर (S) तथा नाइट्रोजन हैं।
प्रश्न 43.
निम्नलिखित में से किसमें अधिक अतिसंयुग्मन होगा? कारण सहित बताइये –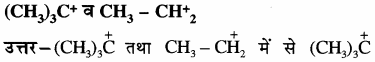
में अतिसंयुग्मन अधिक होगा क्योंकि इसमें α – H परमाणुओं की संख्या 9 है जबकि CH3 – C(overset { + }{ { H }_{ 2 } } ) में केवल 3α – H है, तथा α – H परमाणुओं की संख्या अधिक होने पर अतिसंयुग्मन भी अधिक होता है। इसी कारण (CH3)3(overset { + }{ C } ), CH3 – C(overset { + }{ { H }_{ 2 } } ) से अधिक स्थायी है।
प्रश्न 44.
निम्नलिखित अभिक्रियाओं को वर्गीकृत कीजिए –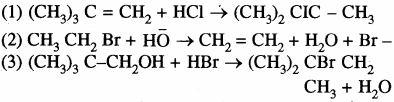
उत्तर:
(1) यह एक इलेक्ट्रॉनस्नेही योगात्मक अभिक्रिया है।
(2) यह एक विलोपन अभिक्रिया है।
(3) यह पुनर्विन्यास के साथ नाभिकस्नेही प्रतिस्थापन अभिक्रिया का उदाहरण है।
प्रश्न 45.
विलोपन अभिक्रिया को उचित उदाहरण से समझाइये।
उत्तर:
विलोपन अभिक्रिया में किसी यौगिक में से एक या अधिक अणु का विलोपन होता है अर्थात् ये यौगिक में से पृथक् हो जाते हैं। इनमें नया बंध बनता है तथा ये अभिक्रियाएँ एक या दो पदों में सम्पन्न होती हैं।
उदाहरण – एकपदीय –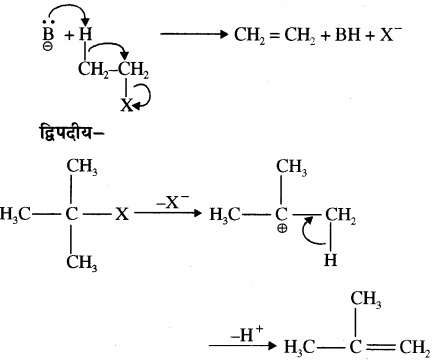
प्रश्न 46.
बैलेस्टाइन परीक्षण समझाइये।
उत्तर:
बैलेस्टाइन परीक्षण द्वारा हैलोजन का परीक्षण किया जाता है। इसमे कॉपर के तार को ऑक्सीकारक बुन्सन ज्वाला में गर्म करके इस पर थोड़ा सा पदार्थ लगाकर पुनः गर्म करते हैं तो ज्वाला का रंग हरा हो जाता है। इससे यौगिक में हैलोजन की उपस्थिति सिद्ध होती है। इस परीक्षण में कॉपर हैलाइड बनता है।
प्रश्न 47.
ग्लिसरॉल एवं क्रोटोनिक अम्ल के IUPAC नाम लिखिये।
उत्तर:
RBSE Class 11 Chemistry Chapter 12 निबन्धात्मक प्रश्न
प्रश्न 48.
संक्षिप्त टिप्पणियाँ लिखिये –
(अ) केकुले की चतुःसंयोजकता का नियम
(ब) वान्टहॉफ एवं ली बेल का सिद्धान्त
(स) सजातीय श्रेणी।
उत्तर:
(अ) केकुले की चतुःसंयोजकता का नियम:
केकुले (1858) ने कार्बन तथा इसके यौगिकों के विषय में एक सिद्धान्त दिया जिसके महत्त्वपूर्ण बिन्दु निम्न हैं –
1. कार्बन परमाणु चतु:संयोजी होता है अर्थात् इसकी संयोजकता चार होती है।
2. कार्बन परमाणु अन्य कार्बन परमाणुओं से बन्धित होकर विभिन्न विवृत श्रृंखला (Open Chain) तथा संवृत श्रृंखला (Closed Chain) यौगिक बना सकता है। कार्बन के इस गुण को श्रृंखलन कहते हैं।
3. कार्बन परमाणु अन्य कार्बन परमाणुओं या दूसरे तत्त्व के परमाणुओं के साथ एकल बन्ध, द्विबन्ध या त्रिबन्ध द्वारा बन्धित हो सकता है। इस आधार पर कार्बन परमाणु की चार संयोजकताएँ निम्नलिखित चार प्रकार से पूर्ण हो सकती है –
(a) चार एकल बंधों द्वारा – जैसे –
(b) दो एकल बंध तथा एक द्विबन्ध द्वारा – जैसे –
(c) एक एकल बन्ध तथा एक त्रिबन्ध द्वारा – जैसे –![]()
(d) दो द्विबन्धों द्वारा – जैसे –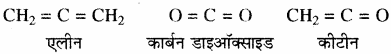
(ब) वान्टहॉफ एवं ली बेल का सिद्धान्त:
ले बैल तथा वान्ट हॉफ के अनुसार कार्बन की चारों संयोजकताएं एक समचतुष्फलक (Tetrahedron) के चारों शीर्षों की ओर इंगित होती है तथा कार्बन परमाणु इस चतुष्फलक के केन्द्र पर स्थित होता है। कार्बन के चारों बन्ध एक – दूसरे के साथ 109°28′ का कोण बनाते हैं। जिसे बंध कोण (Bond angle) कहते हैं। कार्बन की चारों संयोजकताएँ समान होती हैं।
कार्बन परमाणु की चतुष्फलकीय ज्यामिति के पक्ष में प्रमाण:
मेथेन के एक हाइड्रोजन परमाणु को जब किसी अन्य परमाणु या समूह द्वारा प्रतिस्थापित किया जाता है तो केवल एक ही प्रकार का उत्पाद प्राप्त होता है। इसी प्रकार जब इसमें से दो हाइड्रोजन परमाणुओं का प्रतिस्थापन किया जाए तो भी एक ही प्रकार का द्विप्रतिस्थापी उत्पाद बनता है। जैसे – CH3 – Cl तथा CH2Cl2।
कार्बन परमाणु की ज्यामिति को चतुष्फलकीय न मानकर वर्गाकार समतलीय या वर्गाकार पिरैमिडी माना जाए तो मेथेन के द्विप्रतिस्थापी उत्पाद CH2Cl2 (Ca2b2) की दो प्रकार की संरचनाएं संभव हैं जबकि वास्तव में इसकी केवल एक ही संरचना होती है। वर्गाकार समतलीय ज्यामिति में कार्बन परमाणु तथा चारों प्रतिस्थापी एक ही तल में स्थित होते हैं जबकि वर्गाकार पिरैमिडी ज्यामिति में चारों प्रतिस्थापी एक ही तल में वर्ग के चारों कोनों पर स्थित होते हैं तथा कार्बन परमाणु इस वर्गाकार तल के ऊपर या नीचे स्थित होता है।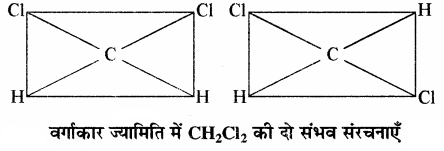
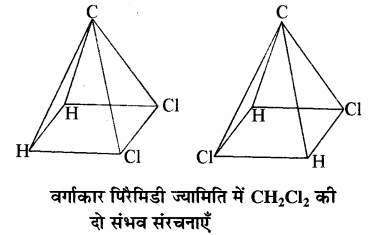
CH2Cl2 की केवल एक संरचना की व्याख्या चतुष्फलकीय ज्यामिति द्वारा ही की जा सकती है, इससे कार्बन परमाणु की चतुष्फलकीय ज्यामिति की पुष्टि होती है। इससे यह स्पष्ट होता है कि कार्बन की चारों संयोजकताएँ एक ही तल में स्थित नहीं होती हैं।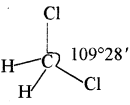
कार्बनिक यौगिकों की पुष्टि इलेक्ट्रॉन विवर्तन तथा अन्य प्रयोगों द्वारा हो चुकी है तथा लै बैल तथा वान्ट हाफ का सिद्धान्त कार्बनिक यौगिकों में त्रिविम समावयवता को समझने में बहुत सहायक सिद्ध हुआ है। कार्बन उत्तेजित अवस्था में ही चतु:संयोजकता दर्शाता है तथा कार्बनिक यौगिकों में तीन प्रकार का संकरण पाया जाता है –
1. sp3 संकरण
2. sp2 संकरण तथा
3. sp संकरण
जिनमें क्रमश: चतुष्फलकीय, त्रिकोणीय समतल तथा रेखीय ज्यामिति होती है तथा सहसंयोजी बन्ध का निर्माण दो परमाणु कक्षकों के अतिव्यापन से होता है जिनमें अयुग्मित इलेक्ट्रॉन उपस्थित होते हैं।
(स) सजातीय श्रेणी:
संरचनात्मक गुणों में समानता रखने वाले कार्बनिक यौगिकों के समूह के सदस्यों को बढ़ते हुए अणुभार के क्रम में लिखा जाता है, तो उस श्रेणी को सजातीय श्रेणी कहते हैं। कार्बनिक यौगिकों के समूह अथवा ऐसी श्रेणी, जिसमें एक विशिष्ट क्रियात्मक समूह उपस्थित हो, सजातीय श्रेणी बनाते हैं। सजातीय श्रेणी के सदस्य जिनके अणु सूत्रों में एक या अधिक > CH2 का अन्तर होता है को सजात अथवा समजात कहते हैं तथा इस गुण को सजातीयता कहते हैं। सजात कभी समावयवी नहीं होते तथा समावयी कभी सजात नहीं होते हैं क्योंकि सजातों के अणु सूत्र में > CH2 का अन्तर होता है। जबकि समावयवियों का अणुसूत्र हमेशा समान होता है।
सजातीय श्रेणी के अभिलक्षण (विशेषताएँ) – सजातीय श्रेणी की निम्न विशेषताएँ होती हैं –
1. सजातीय श्रेणी के दो क्रमागत सदस्यों के मध्य – CH2 का अन्तर होता है। अतः उनके अणुभार में 14 का अन्तर होता है।
2. किसी सजातीय श्रेणी के सदस्यों को एक सामान्य सूत्र द्वारा प्रदर्शित किया जा सकता है।
3. इस श्रेणी के यौगिकों के भौतिक गुणों में क्रमिक परिवर्तन होता है क्योंकि भौतिक गुण अणुभार पर निर्भर करते हैं।
4. सजातीय श्रेणी के सभी सदस्यों के रासायनिक गुण सामान्यतः समान होते हैं क्योंकि रासायनिक गुण मुख्यतः क्रियात्मक समूह पर निर्भर करते हैं।
5. किसी सजातीय श्रेणी के सभी सदस्यों को एक सामान्य विधि द्वारा बनाया जा सकता है।
सजातीय श्रेणियों के कुछ मुख्य वर्ग निम्नलिखित हैं –

नोट – एक से अधिक सजातीय श्रेणियों के सामान्य सूत्र समान हो सकते हैं।
अत: इन श्रेणियों के यौगिक आपस में क्रियात्मक समूह समावयवी होते हैं। जैसे –
1. एल्कीन तथा साइक्लोऐल्केन
2. ऐल्कोहॉल तथा ईथर
3. ऐल्डिहाइड तथा कीटोन
4. कार्बोक्सिलिक अम्ल तथा एस्टर इत्यादि।
कार्बन परमाणुओं के प्रकार – कार्बन परमाणु चार प्रकार के होते हैं –
1. प्राथमिक (Primary) p या 1°
2. द्वितीयक (Secondary) s या 2°
3. तृतीयक (Tertiary) t या 3°
4. चतुष्क (Quaternary) q या 4°
किसी कार्बनिक यौगिक में उपस्थित वह कार्बन परमाणु जो एक कार्बन परमाणु से जुड़ा होता है उसे 1°, जो दो कार्बन परमाणुओं से जुड़ा होता है उसे 2°, जो तीन कार्बन परमाणुओं से जुड़ा होता है उसे 3° तथा चार कार्बन परमाणुओं से जुड़े कार्बन को 4° कार्बन कहते हैं।
उदाहरण: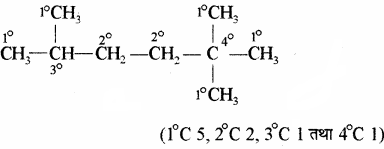
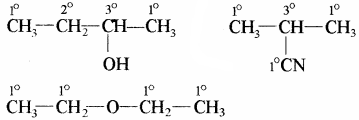
हाइड्रोजन परमाणुओं के प्रकार – हाइड्रोजन परमाणु तीन प्रकार के होते हैं –
1. प्राथमिक (Primary) p या 1°
2. द्वितीयक (Secondary) s या 2°
3. तृतीयक (Tertiary) t या 3°
वे हाइड्रोजन परमाणु जो प्राथमिक (1°), द्वितीयक (2°) तथा तृतीयक (3°) कार्बन परमाणुओं से जुड़े होते हैं, उन्हें क्रमशः 1°, 2° तथा 3° हाइड्रोजन परमाणु कहते हैं।
प्रश्न 49.
निम्नलिखित की व्याख्या कीजिए –
(अ) प्रेरणिक प्रभाव
(ब) इलेक्ट्रोमेरिक प्रभाव
(स) मीसोमेरिक प्रभाव
(द) अतिसंयुग्मन।
उत्तर:
(अ) प्रेरणिक प्रभाव:
प्रेरणिक प्रभाव एक स्थायी प्रभाव है तथा इसके बारे में इन्गोल्ड नामक वैज्ञानिक ने बताया था। कार्बनिक यौगिकों में परमाणुओं की विद्युत ऋणता में अन्तर के कारण साझे का इलेक्ट्रॉन युग्म अधिक विद्युत ऋणी परमाणु या समूह की ओर आंशिक रूप से विस्थापित हो जाता है जिससे बन्ध में ध्रुवता उत्पन्न हो जाती है। इसके कारण समीप का σ बन्ध भी ध्रुवीय हो जाता है। इस प्रकार धुवीय सहसंयोजक बंध की उपस्थिति के कारण किसी समूह या परमाणु द्वारा कार्बन श्रृंखला में निकटवर्ती बंधों में इलेक्ट्रॉनों के विस्थापन को प्रेरणिक प्रभाव कहते हैं।
उदाहरण –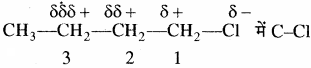
बंध ध्रुवीय है। इसके कारण कार्बन -1 पर आंशिक धनावेश (δ+) तथा क्लोरीन पर आंशिक ऋणावेश (δ–) उत्पन्न हो जाता है। आंशिक आवेशों को दर्शाने के लिए δ (डेल्टा) चिह्न का प्रयोग किया जाता है। तथा इलेक्ट्रॉनों के विस्थापन को तीर के निशान (δ+ से δ–) द्वारा दर्शाया जाता है। कार्बन -1 आंशिक धनावेश के कारण समीप के C – C बंध के इलेक्ट्रॉनों को अपनी ओर आकर्षित करता है जिससे C1 पर इलेक्ट्रॉन घनत्व में कमी की आंशिक पूर्ति हो जाती है तथा कार्बन – 2 पर भी कुछ धनावेश (δδ+) उत्पन्न हो जाता है लेकिन यह धनावेश C – 1 पर स्थित धनावेश की तुलना में कम होता है अर्थात् C – Cl बन्ध की ध्रुवता के कारण पास के बंध में ध्रुवता उत्पन्न हो जाती है। यह प्रभाव कार्बन श्रृंखला के द्वारा आगे बढ़ता जाता है लेकिन बंधों की संख्या बढ़ने के साथ-साथ यह प्रभाव कम होता जाता है तथा तीन बंधों के बाद प्रेरणिक प्रभाव नगण्य हो जाता है। प्रेरणिक प्रभाव हाइड्रोजन के सापेक्ष देखा जाता है तथा इसका प्रेरणिक प्रभाव शून्य माना जाता है। प्रेरणिक प्रभाव कार्बन श्रृंखला से जुड़े प्रतिस्थापी समूह की इलेक्ट्रॉनों को अपनी ओर आकर्षित करने या प्रतिकर्षित करने (इलेक्ट्रॉन प्रदान करना) की क्षमता पर निर्भर करता है। इस आधार पर प्रेरणिक प्रभाव को दो प्रकारों में वर्गीकृत किया जाता है –
(1) ऋणात्मक प्रेरणिक प्रभाव या इलेक्ट्रॉन आकर्षी प्रभाव (- I):
यह प्रभाव उन परमाणुओं या समूहों द्वारा दर्शाया जाता है जिनकी विद्युत ऋणता हाइड्रोजन से अधिक होती है। इसी कारण यह इलेक्ट्रॉन आकर्षी प्रभाव होता है। इसमें प्रतिस्थापी समूह पर ऋणात्मक चिह्न आता है अतः इसे – I प्रभाव कहते हैं। निम्नलिखित समूह – I प्रभाव दर्शाते हैं। तथा इनके -1 प्रभाव का क्रम निम्नलिखित है –
– NO > SO3R > – CN > – COOH > F > CI > Br > I > OAr > COOR > OH > OAr > – COR > C6H5
(2) धनात्मक प्रेरणिक प्रभाव या इलेक्ट्रॉन प्रतिकर्षी प्रभाव (+I प्रभाव):
परमाणुओं के समूह जिनकी विद्युतऋणता हाइड्रोजन से कम होती है वे + I प्रभाव दर्शाते हैं। इसमें प्रतिस्थापी पर धनावेश आ जाता है अतः इसे + I प्रभाव कहते हैं। यह एक इलेक्ट्रॉन प्रतिकर्षी प्रभाव है। सामान्यतः ऐल्किल समूह + I प्रभाव दर्शाते हैं जिसका कारण अतिसंयुग्मन है लेकिन – I प्रभाव की तुलना में + I प्रभाव दुर्बल होता है। ऐल्किल समूह का आकार बढ़ने पर + I प्रभाव बढ़ता है लेकिन समान कार्बन परमाणुओं युक्त ऐल्किल समूहों में शाखन (Branching) बढ़ने पर + 1 प्रभाव बढ़ जाता है। अतः विभिन्न ऐल्किल समूहों के + I प्रभाव का क्रम निम्नलिखित है –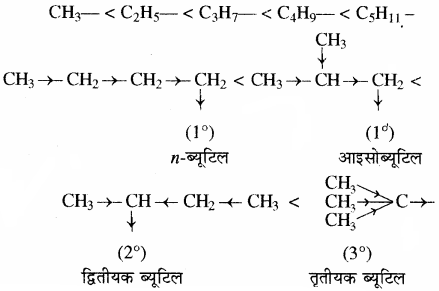
प्रेरणिक प्रभाव के अनुप्रयोग – प्रेरणिक प्रभाव की सहायता से अम्लों तथा क्षारों के सामर्थ्य (प्रबलता) की व्याख्या की जा सकती है –
(1) कार्बोक्सिलिक अम्लों की अम्लीय प्रबलताकार्बोक्सिलिक अम्लों की अम्लीय प्रबलता:
– COOH से जुड़े समूह की प्रकृति पर निर्भर करती है। जब – COOH समूह से जुड़ा समूह + I प्रभाव दर्शाता है तो इसके इलेक्ट्रॉन प्रतिकर्षी गुण के कारण – COOH के – O – H समूह के ऑक्सीजन पर इलेक्ट्रॉन घनत्व बढ़ जाता है जिससे अम्ल का आयनन कम हो जाता है अत: इसकी H+ देने की प्रवृत्ति कम हो जाती है अर्थात् अम्लीय गुण में कमी हो जाती है। इसी कारण + I प्रभाव बढ़ने पर अम्लीय गुण कम होता है –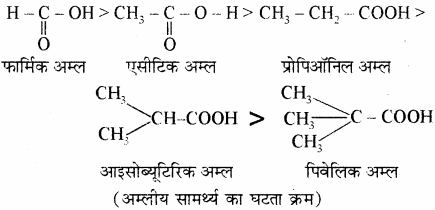
जब कार्बोक्सिलिक अम्लों में -1 प्रभाव दर्शाने वाला समूह उपस्थित होता है तो इसके इलेक्ट्रॉन आकर्षी गुण के कारण – COOH के – O – H समूह के ऑक्सीजन पर इलेक्ट्रॉन घनत्व कम हो जाता है। जिससे अम्ल का आयनन बढ़ जाता है अत: इसकी H+ देने की प्रवृत्ति बढ़ जाती है अर्थात् अम्लीय गुण में वृद्धि हो जाती है। इसी कारण – I प्रभाव बढ़ने पर अम्लीय गुण बढ़ता है।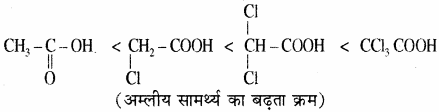
इस उदाहरण में – Cl की संख्या में वृद्धि हो रही है जिससे – 1 प्रभाव बढ़ रहा है अतः अम्लीय गुण में वृद्धि हो रही है।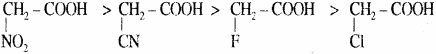
इस उदाहरण में अम्ल से जुड़े समूह का – 1 प्रभाव कम हो रहा है अतः अम्लीय गुण में कमी हो रही है।
नोट – कार्बोक्सिलिक अम्लों के समान फीनॉल में भी – I प्रभाव दर्शाने वाले समूह उपस्थित होने पर अम्लीय गुण में वृद्धि होती है।
(2) ऐमीनों की क्षारीय प्रबलता-सामान्यतयाः
+ I प्रभाव बढ़ने पर ऐमीनों के क्षारीय गुण में वृद्धि होती है तथा – I प्रभाव बढ़ने पर क्षारीय गुण में कमी होती है लेकिन प्रेरणिक प्रभाव के साथ अन्य कारक भी होते हैं जो ऐमीनों के क्षारीय गुण को प्रभावित करते हैं जिनका विस्तृत विवेचन आगे की कक्षाओं में किया जाएगा।
(ब) इलेक्ट्रोमेरिक प्रभाव:
(1) इलेक्ट्रोमरी प्रभाव एक अस्थायी प्रभाव है। अर्थात् यह प्रभाव आक्रमणकारी अभिकर्मक की उपस्थिति में ही होता है तथा आक्रमणकारी अभिकर्मक के हटते ही यह प्रभाव समाप्त हो जाता है।
(2) यह प्रभाव![]()
समूह युक्त यौगिकों द्वारा दर्शाया जाता है।
(3) आक्रमणकारी अभिकर्मक की माँग पर साझित इलेक्ट्रॉन युग्म का बहुबंध (C = C, C ≡ C) से बंधित एक परमाणु पर पूर्णरूप से विस्थापित होना इलेक्ट्रोमरी प्रभाव कहलाता है।
(4) इस प्रभाव में इलेक्ट्रॉन के संचलन को मुड़े हुए तीर के निशान (↷) द्वारा दर्शाया जाता है।
(5) इलेक्ट्रोमरी प्रभाव दो प्रकार का होता है –
(a) + E प्रभाव
(b) – E प्रभाव
(a) धनात्मक इलेक्ट्रोमेरी प्रभाव (+ E प्रभाव): इसमें बहुआबंध के π – इलेक्ट्रॉनों का विस्थापन उस परमाणु पर होता है, जिससे आक्रमणकारी अभिकर्मक जुड़ता है। जैसे –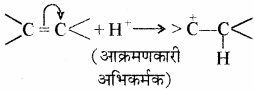
(b) ऋणात्मक इलेक्ट्रोमेरी प्रभाव (- E प्रभाव): इस प्रभाव में बहु-आबंध के π – इलेक्ट्रॉनों का विस्थापन उस परमाणु पर होता है, जिससे आक्रमणकारी अभिकर्मक बंधित नहीं होता है। जैसे –
(स) मीसोमेरिक प्रभाव:
दो – आबंधों की अन्योन्य क्रिया अथवा – बंध एवं समीप के परमाणु पर उपस्थित एकाकी इलेक्ट्रॉन युग्म के मध्य अन्योन्य क्रिया के कारण किसी अणु में उत्पन्न ध्रुवता को अनुनाद प्रभाव’ या ‘मेसोमरी प्रभाव’ कहते हैं। यह प्रभाव श्रृंखला में संचरित होता है। अनुनाद प्रभाव दो प्रकार के होते हैं –
(1) + M या + R प्रभाव
(2) – M या – R प्रभाव
(1) धनात्मक अनुनाद प्रभाव (+ R या + M प्रभाव) + R प्रभाव में इलेक्ट्रॉन का विस्थापन संयुग्मित अणु में बंधित परमाणु या प्रतिस्थापी समूह से दूर होता है अर्थात् इलेक्ट्रॉन बेन्जीनवलय की ओर विस्थापित होते हैं अर्थात् + M प्रभाव दर्शाने वाले समूहों में इलेक्ट्रॉन प्रदान (प्रतिकर्षित) करने की क्षमता होती है। अतः इस इलेक्ट्रॉनविस्थापन के कारण अणु में ऑर्थों व पैरा स्थितियों पर इलेक्ट्रॉन घनत्व बढ़ जाता है। उदाहरण ऐनिलीन –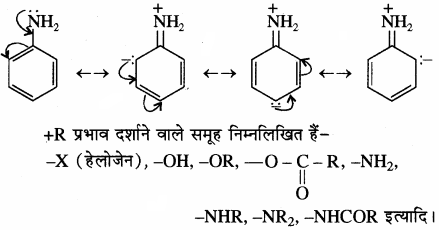
अतः धनात्मक अनुनाद प्रभाव तभी होता है जब बेन्जीन चलय से जुड़े परमाणु पर एकाकी इलेक्ट्रॉन युग्म उपस्थित हो।
संयुग्मित निकाय:
किसी विवृत श्रृंखला अथवा चक्रीय निकाय में एकान्तर एकल तथा द्विबन्ध उपस्थित होने पर इसे ‘संयुग्मित निकाय’ कहते हैं। 3 – ब्यूटाडाइईन, ऐनिलीन, नाइट्रोबेन्जीन इत्यादि इसके उदाहरण हैं। ऐसे निकायों में π – इलेक्ट्रॉन विस्थापित होते हैं जिससे अणु में ध्रुवता उत्पन्न होती है।
(2) ऋणात्मक अनुनाद प्रभाव (- R या – M प्रभाव) – R प्रभाव में इलेक्ट्रॉन का विस्थापन संयुग्मित अणु में बंधित परमाणु अथवा प्रतिस्थापी समूह की ओर होता है, अर्थात् इलेक्ट्रॉन बेन्जीन वलय से बाहर की ओर विस्थापित होते हैं अर्थात् – M प्रभाव दर्शाने वाले समूहों में इलेक्ट्रॉन क्षमता आकर्षित करने की क्षमता होती है जिससे बेन्जीन वलय में इलेक्ट्रॉन घनत्व कम हो जाता है। उदाहरण – नाइट्रोबेन्जीन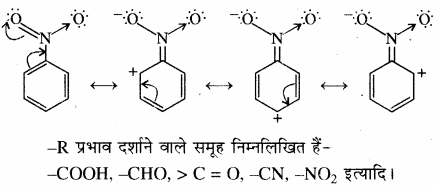
अतः ऋणात्मक अनुनाद प्रभाव तब होता है जब बेन्जीन वलय से जुड़े परमाणु की विद्युत ऋणता कार्बन से अधिक हो तथा उस पर बन्ध की ध्रुवता के कारण धनावेश आ जाता है। जैसे –
(द) अतिसंयुग्मन:
कार्बनिक यौगिकों के प्रतिस्थापी समूह के σ बंधों तथा निकटवर्ती π तंत्र के मध्य σ – π अस्थायीकरण को अतिसंयुग्मन कहते हैं। अतिसंयुग्मन को आबन्ध रहित अनुनाद भी कहते हैं। क्योंकि इसमें 1 – कार्बन परमाणु तथा H+ के मध्य कोई वास्तविक बंध नहीं होता है। अतिसंयुग्मन एक सामान्य स्थायीकरण प्रभाव है, जिसमें σ इलेक्ट्रॉनों का अनुनाद होता है। अतः यह σ बन्ध अनुनाद भी कहलाता है। इसमें किसी असंतृप्त निकाय के परमाणु से सीधे बंधित ऐल्किल समूह के C – H आबंध अथवा असहभाजित p कक्षक वाले परमाणु के σ इलेक्ट्रॉनों का विस्थानीकरण होता है। अतः ऐल्किल समूह के C – H आबंध के σ इलेक्ट्रॉन निकटवर्ती असंतृप्त निकाय अथवा असहभाजित p कक्षक के साथ आंशिक संयुग्मन दर्शाते हैं। अतिसंयुग्मन एक स्थायी प्रभाव है।
अतिसंयुग्मन को CH3(overset { + }{ C } )H2 (एथिल कार्बधनायन) द्वारा समझाया जा सकता है जिसमें धनावेशित कार्बन पर एक रिक्त p कक्षक है। मेथिल समूह का एक C – H आबंध, रिक्त p कक्षक के तल के संरेखण में हो जाता है, जिसके कारण C – H आबंध के इलेक्ट्रॉन रिक्त p कक्षक में विस्थानीकृत हो जाते हैं, जैसा कि चित्र में दर्शाया गया है।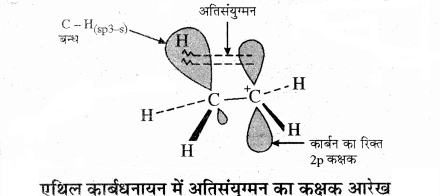
अतः इस अतिव्यापन से कार्बधनायन का स्थायित्व बढ़ जाता है, क्योंकि निकटवर्ती σ आबंध के कारण धनावेश का विस्थानीकरण हो जाता है।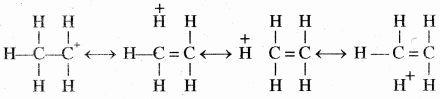
सामान्यतया धनावेशित कार्बन से जुड़े ऐल्किल समूहों की संख्या बढ़ने पर अतिसंयुग्मन अधिक होता है, जिससे कार्बधनायन का स्थायित्व बढ़ता है। अतः विभिन्न कार्बधनायनों के स्थायित्व का क्रम निम्न प्रकार होता है।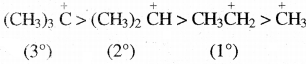
अतिसंयुग्मन ऐल्कीनों तथा ऐल्किलऐरीनों द्वारा भी प्रदर्शित किया जाता है। इसके द्वारा एल्कीनों के आपेक्षिक स्थायित्व को समझाया जा सकता है। प्रोपीन में अतिसंयुग्मन द्वारा इलेक्ट्रॉनों का विस्थानीकरण निम्न प्रकार होता है –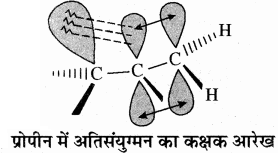
ऐसा माना जाता है कि अतिसंयुग्मन के कारण C – H आबंध में आंशिक आयनिक गुण आ जाता है।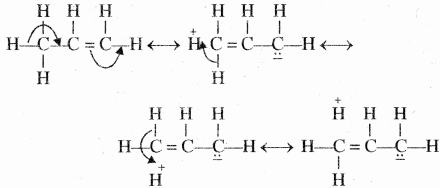
प्रश्न 50.
निम्नलिखित तत्त्वों, नाइट्रोजन, सल्फर एवं ब्रोमीन के गुणात्मक विश्लेषण का रसायन लिखिए।
उत्तर:
(1) नाइट्रोजन का परीक्षण:
लैसे विलयन की थोड़ी सी मात्रा को एक परखनली में लेकर उसमें बराबर मात्रा में फेरस सल्फेट (FeSO4) का ताजा बना संतृप्त विलयन मिला देते हैं। इसमें एक – दो बूंद सोडियम हाइड्रॉक्साइड विलयन की डाल देते हैं (यहाँ प्राप्त हरा अवक्षेप किसी भी स्थिति में नाइट्रोजन की उपस्थिति का संकेत नहीं देता है)। अब इस मिश्रण को गर्म करके ठण्डा कर लेते हैं और इसमें फेरिक क्लोराइड की। कुछ बूंदें मिलाते हैं। इसके पश्चात् इसमें 3 – 4 बूंद सान्द्र हाइड्रोक्लोरिक या सान्द्र सल्फ्यूरिक अम्ल की मिलाने पर यदि विलयन का रंग हरा नीला (प्रशियन ब्लू) हो जाए तो यौगिक में नाइट्रोजन उपस्थित होता है। इसमें प्रयुक्त अभिक्रियाएँ निम्न हैं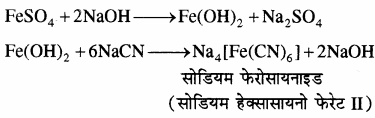

(2) सल्फर का परीक्षण:
यह निम्नलिखित दो विधियों द्वारा किया जाता है –
1. एक परखनली में लैसे विलयन (सोडियम निष्कर्ष) लेकर उसमें 3 – 4 बूंदें सोडियम नाइट्रोसाइड विलयन की मिलाते हैं। यदि विलयन का रंग बैंगनी हो जाता है तो यौगिक में सल्फर उपस्थित हैं। सोडियम निष्कर्ष में उपस्थित सोडियम सल्फाइड, सोडियम नाइट्रोनुसाइड से अभिक्रिया करके बैंगनी रंग का सोडियम थायो नाइट्रोनुसाइड बना देता है।![]()
2. सोडियम निष्कर्ष को एक परखनली में लेकर उसे ऐसीटिक अम्ल द्वारा अम्लीकृत करके उसमें लेड एसीटेट विलयन डालने पर लेड सल्फाइड का काला अवक्षेप प्राप्त होता है।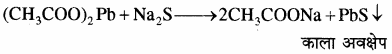
(3) हैलोजनो का परीक्षण:
1. सोडियम निष्कर्ष में 50 प्रतिशत नाइट्रिक अम्ल डालकर उबालते हैं। विलयन को ठण्डा करके उसमें सिल्वर नाइट्रेट के ताजा बने विलयन की कुछ बूंदें डालने पर श्वेत अवक्षेप आता है जो कि अमोनियम हाइड्रॉक्साइड विलयन के आधिक्य में घुल जाता है तथा तनु नाइट्रिक अम्ल डालने पर पुनः अवक्षेप आ जाता है, क्लोरीन की उपस्थिति दर्शाता है।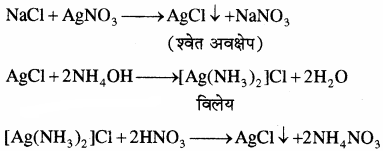
हल्के पीले रंग का अवक्षेप जो कि अमोनियम हाइड्रॉक्साइड विलयन में आंशिक रूप से विलेय होता है, ब्रोमीन की उपस्थिति दर्शाता है।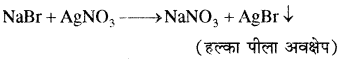
गहरे पीले रंग का अवक्षेप जो कि अमोनियम हाइड्रॉक्साइड विलयन में पूर्णतया अविलेय होता है, आयोडीन की उपस्थिति दर्शाता है।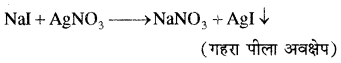
2. सोडियप निष्कर्ष की थोड़ी सी मात्रा को तनु नाइट्रिक अम्ल द्वारा अम्लीकृत करके कुछ बूंदें क्लोरोफार्म या कार्बन टेट्राक्लोराइड की डालकर बूंद – बूंद करके ताजा क्लोरीन जल डालकर हिलाते हैं –
क्लोरोफॉर्म की परत का रंग लाल – भूरा या नारंगी हो जाता है, जो कि ब्रोमीन की उपस्थिति दर्शाता है।
2NaBr + Cl2 → 2NaCl + Br2
Br2 + क्लोरोफार्म → ब्रोमीन का क्लोरोफार्म में लाल – भूरा विलयन
क्लोरोफार्म की परत का रंग गुलाबी या बैंगनी हो जाता है, जो कि आयोडीन की उपस्थिति दर्शाता है।
2NaI + Cl2 → 2NaCl + I2
I2 + क्लोरोफार्म → आयोडीन का क्लोरोफार्म में बैंगनी विलयन
प्रश्न 51.
ड्यूमा एवं जेल्डाल (केल्डाल) विधि का वर्णन कीजिए। नाइट्रोजन प्रतिशतता की गणना समझाइए।
उत्तर:
नाइट्रोजन का आकलन निम्नलिखित दो विधियों द्वारा किया जाता है –
(1) ड्यूमा विधि (Duma Method)
(2) जेल्डाल विधि या कैल्टॉल विधि (Kjeldahl Method)
(1) ड्यूमा विधि: इस विधि द्वारा सभी प्रकार के यौगिकों में उपस्थित नाइट्रोजन की प्रतिशतता का निर्धारण किया जाता है।
सिद्धान्त:
कार्बनिक यौगिक और क्यूप्रिक ऑक्साइड के मिश्रण को कार्बन डाइऑक्साइड के वातावरण में तेज गर्म करने पर यौगिक में उपस्थित कार्बन और हाइड्रोजन क्रमशः कार्बन डाइऑक्साइड और जल (वाष्प) में ऑक्सीकृत हो जाते हैं तथा नाइट्रोजन गैस मुक्त होती है।
अल्प मात्रा में बने नाइट्रोजन के ऑक्साइडों को कॉपर. के गर्म तार पर प्रवाहित करके इन्हें नाइट्रोजन में अपचयित कर दिया जाता है। उत्पन्न गैसों के मिश्रण को एक नाइट्रोमीटर में KOH के जलीय विलयन के ऊपर एकत्रित करते हैं जिससे CO2 गैस KOH के विलयन में अवशोषित हो जाती है।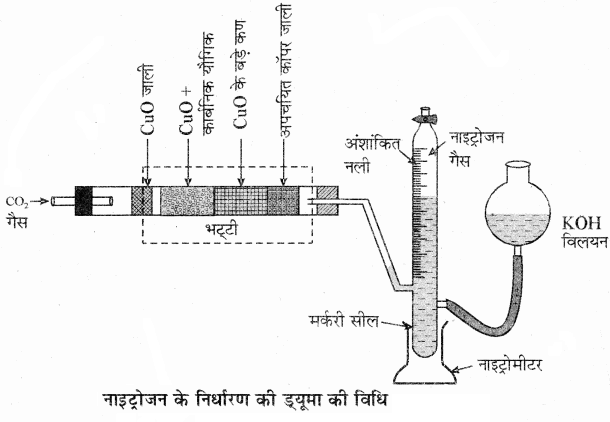
गणना – माना कि ड्यूमा के प्रयोग में कार्बनिक पदार्थ की मात्रा m ग्राम, एकत्रित N2 का आयतन V1ml तथा कक्ष तापमान T1K है।
अतः मानक ताप व दाब (S.T.P) पर N2 का आयतन (V) =![]()
P1 तथा V1 क्रमशः N2 के दाब तथा आयतन हैं। P1 वह दाब जिस पर नाइट्रोजन एकत्रित की गई है, जो कि वायुमण्डलीय दाब से भिन्न है।
P1 = वायुमण्डलीय दाब – जलीय तनाव
∴ S.T.P पर 22400 mL N2 (1 मोल) का द्रव्यमान = 28 ग्राम
∵ S.T.P पर V ml N2 का भार = (frac { 28times { V } }{ 22400 } ) ग्राम
अतः m ग्राम यौगिक में नाइट्रोजन की % मात्रा
अंशांकित नली में एकत्रित नाइट्रोजन गैस का आयतन माप लेते हैं। प्रयोग के ताप और दाब पर मापित नाइट्रोजन के आयतन को गैस समीकरण द्वारा मानक ताप व दाब (S.T.P) पर बदल कर उससे नाइट्रोजन की मात्रा की गणना कर लेते हैं। कार्बनिक यौगिक और नाइट्रोजन की मात्राओं से यौगिक में नाइट्रोजन की प्रतिशतता की गणना की जाती है।
(2) जेल्डॉल विधि: नाइट्रोजन के निर्धारण की यह एक अच्छी एवं व्यावहारिक विधि है, लेकिन यह विधि
(i) विषम चक्रीय यौगिकों (जैसे पिरीडीन, पायरोल, क्विनोलीन आदि) के लिए प्रयुक्त नहीं की जा सकती है।
(ii) नाइट्रो एवं एजो समूह युक्त यौगिकों के लिए भी यह विधि अनुपयुक्त है, क्योंकि दी गयी प्रायोगिक परिस्थितियों में ये यौगिक नाइट्रोजन को अमोनियम सल्फेट में परिवर्तित नहीं करते हैं।
सिद्धान्त – इस विधि में नाइट्रोजन युक्त यौगिक को सान्द्र H2SO4 के साथ क्युप्रिंक सल्फेट तथा पोटेशियम सल्फेट उत्प्रेरक की उपस्थिति में गरम करते हैं जब तक कि विलयन पारदर्शी न हो जाए जिससे इसमें उपस्थित नाइट्रोजन, अमोनियम सल्फेट [(NH4)2SO4] में परिवर्तित हो जाती है जिसे NaOH के आधिक्य में गरम करने पर अमोनिया गैस निकलती है। प्राप्त गैस को मानक H2SO4 HCl विलयन के ज्ञात आयतन में अवशोषित कर लिया जाता है। इसके पश्चात् बचे हुए H2SO4 का अनुमापन NaOH के मानक विलयन द्वारा करके (उदासीनीकरण) इसकी मात्रा ज्ञात कर लेते हैं। अम्ल (H2SO4) की प्रारम्भिक मात्रा तथा अभिक्रिया के पश्चात् बची हुई मात्रा का अन्तर, अमोनिया के साथ अभिकृत, अम्ल की मात्रा के बराबर होगी।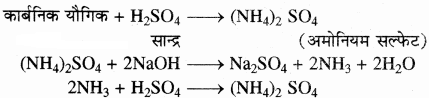
कैल्डॉल विधि में प्रयुक्त होने वाला उपकरण नीचे दिए गए चित्र में दर्शाया गया है।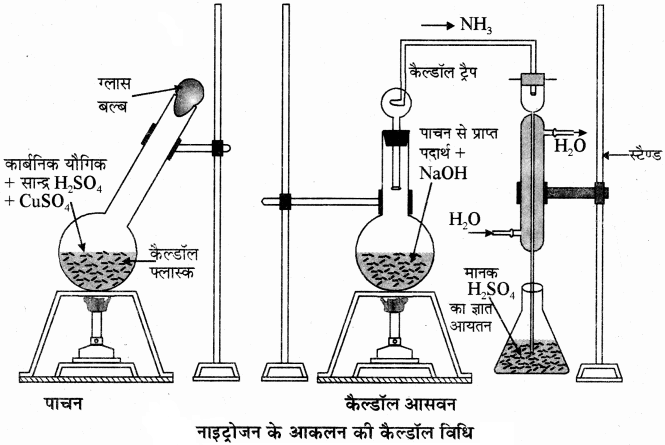
गणना – कार्बनिक यौगिक तथा अमोनिया की मात्राओं की सहायता से यौगिक में नाइट्रोजन की प्रतिशतता की गणना की जा सकती है।
माना कार्बनिक यौगिक का द्रव्यमान = W ग्राम,
प्रयुक्त अम्ल का आयतन = V1 मिली,
अम्ल की नार्मलता = N1
नार्मलता की परिभाषा के अनुसार 1N NH3 विलयन के 1000 मिली = 17 ग्राम अमोनिया तथा 14 ग्राम नाइट्रोजन
∴ 1N NH3 विलयन के V1 मिली में नाइट्रोजन =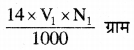
यौगिक में नाइट्रोजन का भार =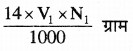
अतः यौगिक में नाइट्रोजन की प्रतिशतता
प्रश्न 52.
निम्नलिखित मध्यवर्तियों का निर्माण, संरचना, स्थायित्व एवं ज्यामिति का संक्षिप्त वर्णन कीजिये – कार्बऋणायन, कान, नाइट्रीन।
उत्तर:
कार्बऋणायन:
वह मध्यवर्ती अस्थायी स्पीशीज जिसमें कार्बन पर ऋणावेश होता है, उसे कार्बऋणायन कहते हैं। इसमें ऋणावेशित कार्बन पर एक एकाकी इलेक्ट्रॉन युग्म सहित इलेक्ट्रॉनों का अष्टक पूर्ण होता है। कार्बऋणायन भी सहसंयोजी बन्ध के विषमांश विखण्डन से बनता है। कार्बधनायन के समान कार्बऋणायन भी अस्थायी तथा क्रियाशील स्पीशीज होती है तथा ये नाभिक – स्नेही या लुइस क्षार (इलेक्ट्रॉन युग्मदाता) के समान व्यवहार करती है, क्योंकि इसमें इलेक्ट्रॉनों की प्रचुरता होती है।
उदाहरण: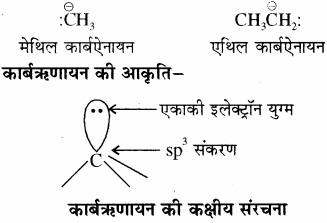
कार्बऋणायन में ऋणावेशित कार्बन परमाणु sp3 संकरित अवस्था में होता है। इसमें ऋणावेशित कार्बन परमाणु तीन sp3 संकरित कक्षकों के द्वारा अन्य तीन परमाणुओं के साथ σ बंध बनाता है और चौथे sp3 संकरित कक्षक में एकाकी इलेक्ट्रॉन युग्म उपस्थित होता है। अतः इसकी संरचना पिरामिडीय होती है।
कार्बऋणायन का बनना –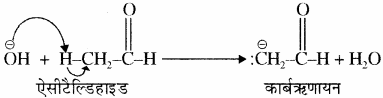
कार्बनऋणायनों का स्थायित्व –
कार्बऋणायन भी तीन प्रकार के होते हैं – प्राथमिक (1)°, द्वितीयक (2)° तथा तृतीयक (3)° एवं इनके स्थायित्व का क्रम
कार्बधनायन के विपरीत होता है –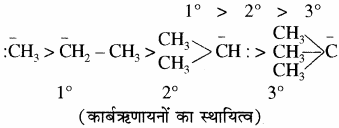
धनात्मक प्रेरणिक प्रभाव (+ I प्रभाव) बढ़ने पर कार्बऋणायनों का स्थायित्व कम होता है क्योंकि + 1 प्रभाव के कारण ऋणावेशित कार्बन पर इलेक्ट्रॉन घनत्व बढ़ जाता है अतः कार्बऋणायनों की क्रियाशीलता बढ़ जाती है। इसके विपरीत ऋणात्मक प्रेरणिक प्रभाव (- I प्रभाव) के कारण कार्बऋणायनों का स्थायित्व बढ़ता है क्योंकि इससे ऋणावेशित कार्बन पर इलेक्ट्रॉन घनत्व कम हो जाता है। इसी कारण क्लोरोमेथिल कार्बऋणायन का स्थायित्व, मेथिल कार्बऋणायन से अधिक होता है।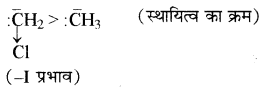
कार्बीन:
जब किसी अभिक्रिया में एक ही कार्बन परमाणु से समांश विखण्डन द्वारा दो समूह निकलते हैं तो एक विशेष प्रकार का मध्यवर्ती बनता है। जिसे कान कहा जाता है। यहाँ दोनों बंध समांश विखण्डन द्वारा टूटते हैं, जिसके कारण कार्बन परमाणु पर दो अयुग्मित इलेक्ट्रॉन रह जाते हैं। ये दोनों इलेक्ट्रॉन अलग – अलग बंधों के समांश विखंडन से प्राप्त होते हैं।
उदाहरण:
:CH2 अथवा :CCl2
कार्बान में एक कार्बन परमाणु दो संयोजक बंधों द्वारा दो परमाणुओं से जुड़ा रहता है और इस कार्बन परमाणु पर दो अयुग्मित इलेक्ट्रॉन होते हैं। कार्बान इलेक्ट्रॉन न्यून होते हैं क्योंकि इसके कार्बन परमाणु के बाह्यतम कक्ष में केवल 6 इलेक्ट्रॉन होते हैं।
कार्बन के प्रकार –
कार्बीन मध्यवर्ती दो प्रकार के होते हैं –
एकक (Singlet) कार्बन – इसमें दोनों अयुग्मित इलेक्ट्रॉन एक ही कक्षक में होते हैं और उनका चकण एक – दूसरे के विपरीत होता है, जिससे इसका चुम्बकीय आघूर्ण शून्य हो जाता है।
त्रिक (Triplet) कार्बीन – इस कार्बान में दोनों अयुग्मित इलेक्ट्रॉन दो अलग – अलग कक्षकों में उपस्थित होते हैं और उनका चक्रण भी विपरीत नहीं होता है, जिसके कारण इसमें स्थायी चुम्बकीय आघूर्ण होता है।
कार्बान का बनना –
नाइट्रीन:
नाइट्रीन, कार्बन के समान ही एक उदासीन इलेक्ट्रॉन न्यून स्पीशीज होती है, जिसमें नाइट्रोजन परमाणु पर चार अयुग्मित इलेक्ट्रॉन और एक सहसंयोजक बंध होता है।
नाइट्रीन भी दो प्रकार के हो सकते हैं –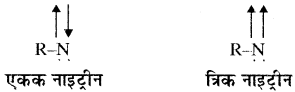
रासायनिक अभिक्रियाओं में एकक नाइट्रीन एक इलेक्ट्रॉन स्नेही के समान और त्रिक नाइट्रीन एक द्विमूलक की भाँति व्यवहार करती हैं।
नाइट्रीन का निर्माण –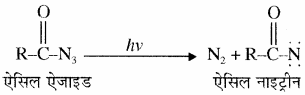
उदाहरण – नाइट्रीन हॉफमॉन अभिक्रिया में मध्यवर्ती के रूप में बनता है।
प्रश्न 53.
(अ) मुक्तमूलकों के स्थायित्व एवं अभिक्रियाओं पर प्रकाश डालिये।
(ब) कार्बधनायनों के प्राप्त करने की विधियाँ, अभिक्रियाएँ एवं स्थायित्व की विवेचना कीजिए।
उत्तर:
(अ) मुक्तमूलकों के स्थायित्व एवं अभिक्रियाओं पर प्रकाश डालिये:
उदासीन मध्यवर्ती स्पीशीज (परमाणु या समूह) जिनमें विषम संख्या में इलेक्ट्रॉन होते हैं उन्हें मुक्त मूलक कहते हैं। मुक्त मूलक समांश विखण्डन से बनते हैं। अन्य मध्यवर्ती स्पीशीज के समान मुक्त मूलक भी अस्थायी तथा क्रियाशील होते हैं। मुक्त मूलक अनुचुम्बकीय होते हैं क्योंकि इनमें अयुग्मित इलेक्ट्रॉन उपस्थित होता है। इनमें अयुग्मित इलेक्ट्रॉन को युग्मित करने की प्रबल प्रवृत्ति होती है अतः ये शीघ्रता से एक – दूसरे के साथ या अन्य अणुओं के साथ अभिक्रिया करके अपने अयुग्मित इलेक्ट्रॉन को युग्मित कर लेते हैं।
मुक्त मूलकों का बनना –![]()
मुक्त मूलक की कक्षीय संरचना –
कार्बनिक मुक्त मूलक (जैसे CH3) में अयुग्मित इलेक्ट्रॉन युक्त कार्बन परमाणु sp2 संकरित अवस्था में होते हैं (इसे sp3 संकरित भी मानते हैं) अतः मेथिल मुक्त मूलक की त्रिकोणीय समतल ज्यामिति होती है। अयुग्मित इलेक्ट्रॉन असंकरित p कक्षक में रहता है।
मुक्त मूलकों का स्थायित्व –
मुक्त मूलकों को तीन प्रकारों में वर्गीकृत किया जाता है – प्राथमिक, द्वितीयक और तृतीयक, जब अयुग्मित इलेक्ट्रॉन क्रमशः प्राथमिक, द्वितीयक और तृतीयक कार्बन परमाणु पर उपस्थित होता है।
मुक्त मूलकों के स्थायित्व का क्रम भी कार्बधनायनों के समान ही होता है अर्थात् इनके स्थायित्व का क्रम निम्न है जिसका कारण बढ़ता हुआ अतिसंयुग्मन तथा धनात्मक प्रेरणिक प्रभाव है।
मुक्त मूलक – π बन्ध के अनुनाद के कारण मुक्त मूलकों का स्थायित्व भी बढ़ता है, अतः π बन्ध युक्त मुक्त मूलकों के स्थायित्व का बढ़ता क्रम निम्न प्रकार है –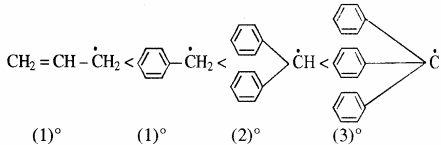
मुक्त मूलक प्रतिस्थापन – ये अभिक्रियाएँ मुक्त मूलक द्वारा सम्पन्न होती हैं जिसमें प्रकाश (hv) या परऑक्साइड की उपस्थिति आवश्यक है।
उदाहरण:![]()
ये अभिक्रियाएँ लगातार चलती रहती हैं अतः इन्हें श्रृंखला अभिक्रियाएँ कहते हैं।
मुक्त मूलक योगात्मक अभिक्रियाएँ – इस प्रकार की अभिक्रियाओं में![]()
पर मुक्त मूलक, जो कि प्रकाश की उपस्थिति में अभिकर्मक के समांश विखण्डन द्वारा बनता है का योग होकर एक मध्यवर्ती मुक्त मूलक बनता है। यह मध्यवर्ती किसी अन्य परमाणु या यौगिक या मुक्त मूलक से अभिक्रिया कर उत्पाद बनाता है। यह भी एक श्रृंखला अभिक्रिया है तथा खराश के नियम द्वारा होती है।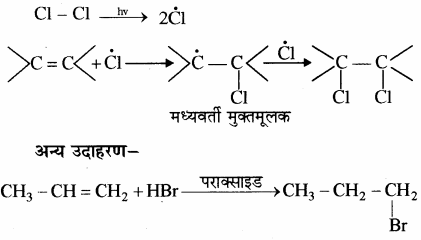
(ब) कार्बधनायनों के प्राप्त करने की विधियाँ, अभिक्रियाएँ एवं स्थायित्व:
कार्बधनायन:
वह मध्यवर्ती अस्थायी स्पीशीज जिसमें कार्बन पर धनावेश होता है, उसे कार्बधनायन कहते हैं। पहले इसे कार्बोनियम आयन भी कहा जाता था। कार्बधनायन में धनावेशित कार्बन पर इलेक्ट्रॉनों का षष्टक (6 इलेक्ट्रॉन) (Sextet) होता है अतः यह कार्बन इलेक्ट्रॉन न्यून होता है। तथा इस पर sp2 संकरण होता है एवं इसकी आकृति त्रिकोणीयसमतल होती है। कार्बधनायन अत्यधिक अस्थायी तथा क्रियाशील होते हैं।
कार्बधनायन का बनना – कार्बधनायन सहसंयोजक बंध के विषमांश विखण्डन द्वारा कुछ अभिक्रियाओं में मध्यवर्ती के रूप में बनते हैं।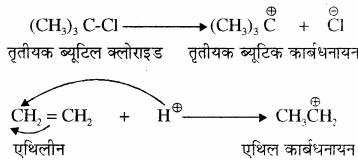
कार्बधनायन की आकृति – कार्बधनायन की आकृति त्रिकोणीय समतल होती है, जिसमें धनावेशित कार्बन sp2 संकरित होता है (बन्ध कोण 120°) अत: (overset { + }{ C } )H3 में कार्बन के तीन sp2 संकरित कक्षक हाइड्रोजन के 1s कक्षकों के साथ अतिव्यापन करके C(sp2) – H(1s) सिग्मा बन्ध बनाते हैं तथा असंकरित रिक्त p कक्षक इस तल के लंबवत् होता है।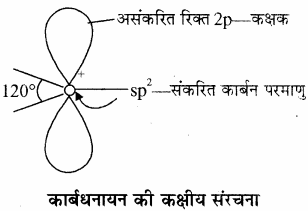
कार्बधनायनों को तीन प्रकारों में वर्गीकृत किया जाता है – प्राथमिक (1°), द्वितीयक (2°) तथा तृतीयक (3°) जिनमें धनावेशित कार्बन क्रमशः प्राथमिक, द्वितीयक तथा तृतीयक होता है।
उदाहरण – (overset { + }{ C } )H3 को मेथिल धनायन या मेथिल कार्बधनायन कहते हैं। इसी प्रकार CH3(overset { + }{ C } )H2 को एथिल कार्बधनायन (एक प्राथमिक कार्बधनायन), (CH3)3(overset { + }{ C } )H को आइसोप्रोपिल कार्बधनायन (एक द्वितीयक कार्बधनायन) एवं (CH3)3(overset { + }{ C } ) को तृतीयक ब्यूटिलकार्बधनायन (एक तृतीयक कार्बधनायन) कहा जाता है।
कार्बधनायनों का स्थायित्व – कार्बधनायनों के स्थायित्व का क्रम निम्न प्रकार होता है –
तृतीयक > द्वितीयक > प्राथमिक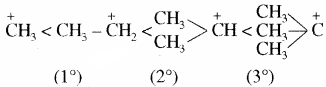
ऐल्किल कार्बधनायनों के स्थायित्व की व्याख्या अतिसंयुग्मन तथा प्रेरणिक प्रभाव द्वारा की जा सकती है। अतिसंयुग्मन बढ़ने पर, धनात्मक प्रेरणिक प्रभाव (+ I प्रभाव) में भी वृद्धि होती है जिससे कार्बधनायन के धनावेश का विस्थानीकरण होता है। इसलिए कार्बधनायन का स्थायित्व बढ़ जाता है। अतः धनावेशित कार्बन से जुड़े एल्किल समूहों की संख्या बढ़ने पर कार्बधनायन के स्थायित्व में वृद्धि होती है क्योंकि एल्किल समूह के इलेक्ट्रॉन प्रतिकर्षी गुण के कारण ये इलेक्ट्रॉन न्यून कार्बन की इलेक्ट्रॉन न्यूनता में कमी कर देते हैं। लेकिन ऋणात्मक प्रेरणिक प्रभाव (- I प्रभाव) के कारण कार्बधनायन के स्थायित्व में कमी होती है। वे कार्बधनायन जिनमें π इलेक्ट्रॉनों का अनुनाद होता है। उनका स्थायित्व ऐल्किल कार्बधनायनों से अधिक होता है तथा अनुनाद के बढ़ने पर इनका स्थायित्व बढ़ता है।
उदाहरण –
इलेक्ट्रॉनस्नेही प्रतिस्थापन – इसमें एक इलेक्ट्रॉनस्नेही का प्रतिस्थापन अन्य इलेक्ट्रॉनस्नेही द्वारा होता है।
उदाहरण – ऐरोमैटिक यौगिकों में वाक्य में प्रतिस्थापन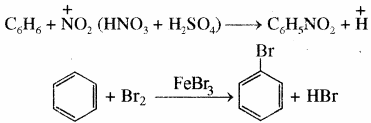
इलेक्ट्रॉनस्नेही योगात्मक अभिक्रियाएँ – ये ऐल्कीन और ऐल्काइन के द्विबंध एवं त्रिबंध पर निम्नलिखित प्रकार से दर्शायी जा सकती हैं –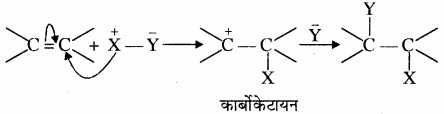
उदाहरण –
CH2 = CH2 + HBr → CH3 – CH2 – Br
प्रश्न 54.
नामकरण की रूढ़ प्रणाली को उदाहरण सहित समझाइए, इसकी सीमाएँ क्या हैं?
उत्तर:
रूढ़ पद्धति या सामान्य नाम पद्धति:
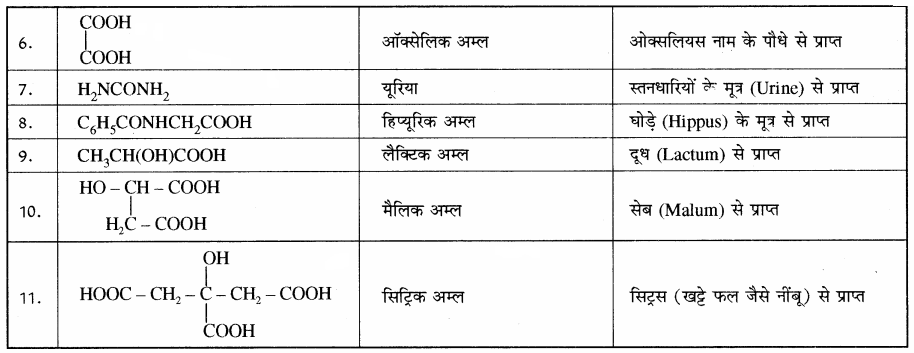
कार्बनिक यौगिकों के नामकरण की यह सबसे पुरानी पद्धति है। इस पद्धति में यौगिकों का नाम उनके स्रोत, स्थान, विशिष्ट गुण, आविष्कार तथा उपयोग इत्यादि के आधार पर दिया जाता है। इस प्रकार के नाम सरल तथा छोटे होते हैं लेकिन नियमबद्ध न होने के कारण अलग-अलग याद रखना पड़ता है तथा इनका यौगिक की संरचना से कोई सम्बन्ध नहीं होता है। कुछ महत्त्वपूर्ण यौगिकों के रूढ़ नाम सारणी में दिए गए हैं –
सारणी: कार्बनिक यौगिकों के रूढ़नाम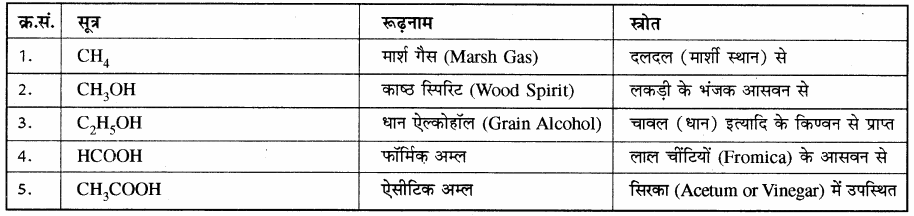
कुछ वर्ष पूर्व प्राप्त कार्बन के एक नवीन क्रिस्टलीय अपररूप C60 का नाम ‘बकमिन्स्टर फुलरीन’ रखा गया, क्योंकि इसकी आकृति अल्पांतरी गुंबदों से मिलती है। इसे प्रसिद्ध अमेरिकी वास्तुकार आर. बुक मिन्स्टर फुलर ने लोकप्रिय बनाया।
कार्बनिक यौगिकों के नाम के साथ नार्मल, आइसो तथा नियो प्रयुक्त करने के नियम
1. नार्मल (n): सीधी श्रृंखला युक्त ऐल्केन तथा इनके व्युत्पन्नों के नाम में n का प्रयोग करते हैं लेकिन IUPAC पद्धति में n का प्रयोग नहीं किया जाता है।
CH3 – CH2 – CH2 – CH3 n – ब्यूटेन
CH3 – CH2 – CH2 – CH2 – CH3 n – पेन्टेन
2. आइसो (iso): एल्केन, एल्कीन तथा इनके व्युत्पन्नों में जब यौगिक के एक सिरे पर एक कार्बन से दो मेथिल समूह जुड़े हों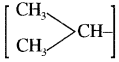
तथा शेष कार्बन श्रृंखला सीधी हो तब आइसो का प्रयोग करते हैं।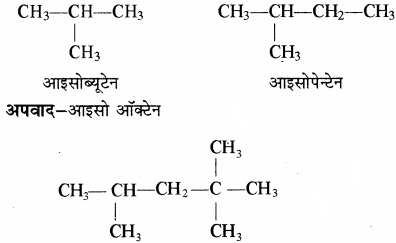
3. निर्या (Neo): एल्केन तथा इनके व्युत्पन्नों में यौगिक के एक सिरे की तरफ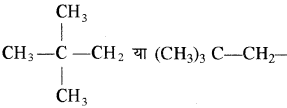
समूह हो तथा शेष कार्बन श्रृंखला सीधी हो तो नियो का प्रयोग किया जाता है।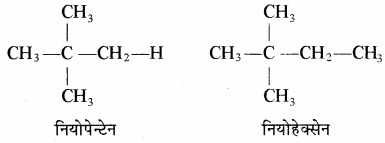
कुछ कार्बनिक यौगिकों के सामान्य अथवा रूढ़ नाम निम्नलिखित हैं –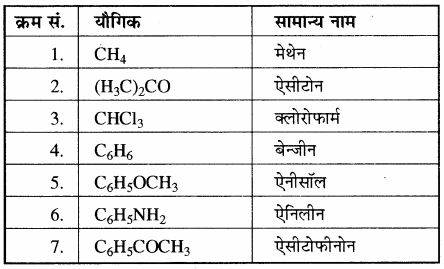
एल्केन के एकसंयोजी मूलक: ऐल्केन में से एक हाइड्रोजन परमाणु हटाने पर प्राप्त मूलक को ऐल्किल मूलक कहते हैं। ऐल्किल समूह का नाम प्राप्त करने के लिए संबंधित ऐल्केन के नाम से ऐन (ane) को इल (yl) द्वारा प्रतिस्थापित किया जाता है।
उदाहरण –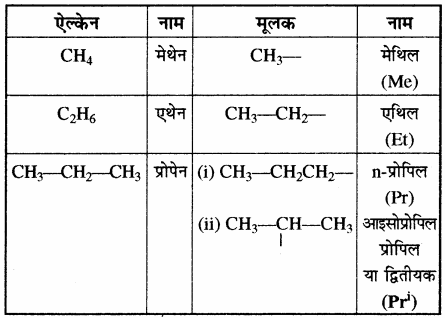
ब्यूटेन के मूलक – ब्यूटेन (C4H10) के दो समावयवी होते हैं – n – ब्यूटेन तथा आइसोब्यूटेन। n – ब्यूटेन से दो तथा आइसोब्यूटेन से भी दो ऐल्किल मूलक प्राप्त होते हैं। अतः ब्यूटेन के एकसंयोजी मूलक [ब्यूटिल (Bu)] चार होते हैं।
(1) n – ब्यूटेन (C4H10):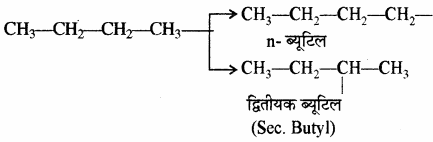
(2) आइसोब्यूटेन (C4H10):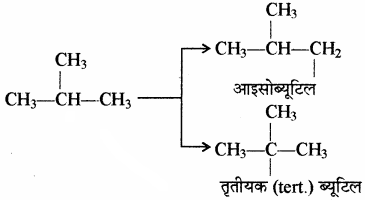
पेन्टेन के मूलक – पेन्टेन (C5H2) के तीन समावयवी होते हैं – n – पेन्टेन, आइसोपेन्टेन तथा नियोपेन्टेन जिनसे क्रमशः 3, 4 तथा 1 एकसंयोजी मूलक बनते हैं। अतः पेन्टेन के एकसंयोजी मूलक (पेन्टिल) आठ होते हैं। पेन्टिल मूलक को एमिल भी कहा जाता है।
(1) n – पेन्टेन:
CH3 – CH2 – CH – CH2 – CH3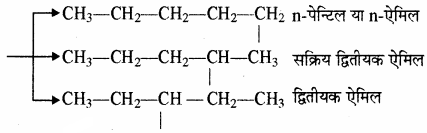
(2) आइसोपेन्टेन: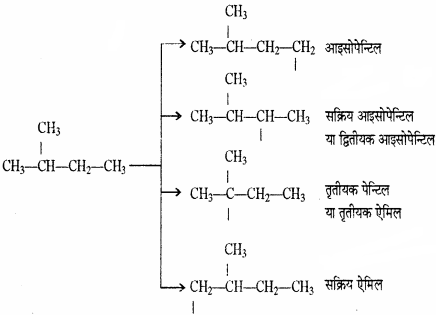
(3) नियोपेन्टेन: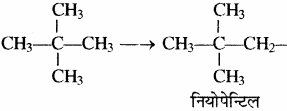
कुछ महत्वपूर्ण असंतृप्त हाइड्रोकार्बन के मूलक निम्नलिखित हैं –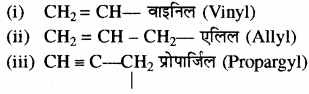
कुछ महत्वपूर्ण ऐरोमैटिक मूलक निम्नलिखित हैं –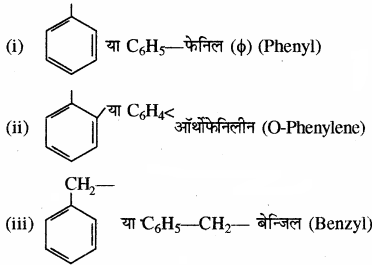
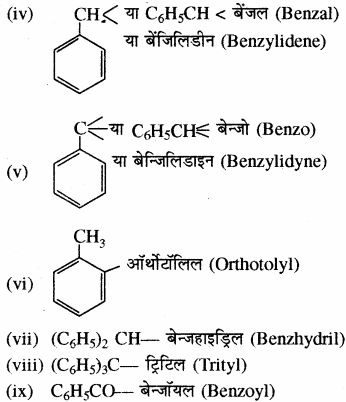
सामान्य नाम पद्धति में विभिन्न सजातीय श्रेणियों के कार्बनिक यौगिकों का नामकरण
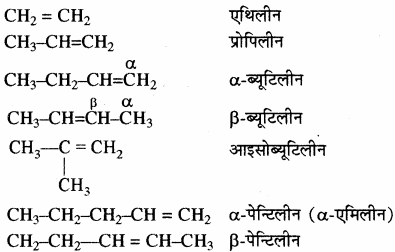
(i) एल्कीन – ऐल्कीनों को सामान्य नाम ऐल्किलीन होता है तथा द्विबन्ध की स्थिति के आधार पर इनमें α (1), β (2) इत्यादि का प्रयोग किया जाता है।
उदाहरण:
(ii) एल्काइन – कुछ एल्काइनों के सामान्य नाम निम्नलिखित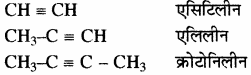
निम्नलिखित सजातीय श्रेणियों को सामान्य नाम ऐल्किल या अन्य मूलकों के नाम के आधार पर दिया जाता है।
![]()
उदाहरण –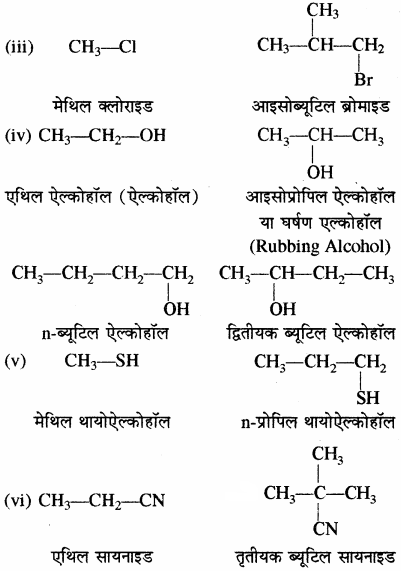

दो या दो से अधिक मूलकों युक्त यौगिकों के सामान्य नाम –
(viii) ईथर (R – O – R1) जब R = R1 डाइएल्किल ईथर (सरल ईथर) R ≠ R1 ऐल्किल ऐल्किल1 ईथर (मिश्रित ईथर)
जब ऐल्किल समूह भिन्न – भिन्न होते हैं तो उन्हें अंग्रेजी वर्णमाला क्रम में लिखा जाता है।
उदाहरण – अंग्रेजी वर्णमाला क्रम देखते समय Iso तथा Neo का पहला अक्षर देखा जाता है लेकिन n -, sec., tert. इत्यादि का नहीं।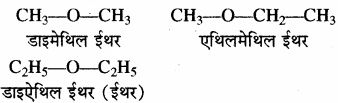
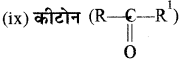
जब R = R1 डाइऐल्किल कीटोन (सरल कीटोन)
R ≠ R1 ऐल्किल ऐल्किल1 कीटोन (मिश्रित कीटोन)।
उदाहरण –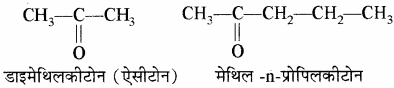
(x) ऐमीन (Amines):
ऐमीन तीन प्रकार के होते हैं-प्राथमिक (1°), द्वितीयक (2°) तथा तृतीयक (3°) ऐमीन जिनके क्रियात्मक समूह क्रमशः – NH2 (ऐमीनो) – NH -(इमीनो) तथा![]()
(नाइट्रिलो या तृतीयक नाइट्रोजन) हैं। ऐमीनों को सामान्य नाम निम्न प्रकार दिया जाता है –
प्राथमिक ऐमीन (R – NH2) – ऐल्किलऐमीन
उदाहरण –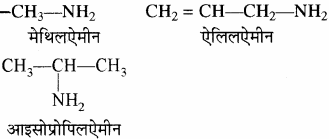
द्वितीयक ऐमीन (R – NH – R1)
जब R = R1 डाइऐल्किलऐमीन
R ≠ R1 ऐल्किल ऐल्किल1 ऐमीन (अंग्रेजी वर्णमाला क्रम में)
उदाहरण –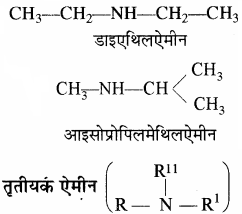
जब R = R1 = R11 ट्राइऐल्किलऐमीन
लेकिन जब ऐल्किल समूह भिन्न-भिन्न होते हैं तो इन्हें अंग्रेजी वर्णमाला क्रम में लिखा जाता है।
उदाहरण –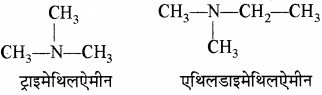
संतृप्त ऐलिफैटिक (खुली श्रृंखलायुक्त) ऐल्डिहाईड, कार्बोक्सिलिक अम्ल तथा अम्ल के व्युत्पन्नों के सामान्य नाम इन श्रेणियों के यौगिकों के सामान्य नाम के लिए निम्नलिखित पूर्वलग्न प्रयुक्त किए जाते हैं –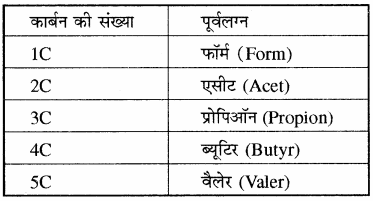
(xi) ऐल्डिहाइड (R – CHO): ऐल्डिहाइडों के सामान्य नाम में उपरोक्त पूर्वलग्नों के साथ ऐल्डिहाइड शब्द लगाया जाता है।
उदाहरण –
(xii) कार्बोक्सिलिक अम्ल (RCOOH): कार्बोक्सिलिक अम्लों का सामान्य नाम लिखने के लिए पूर्वलग्न के साथ इकअम्ल लगाया जाता है।
उदाहरण –
(xiii) कार्बोक्सिलिक अम्लों के व्युत्पन्न – कार्बोक्सिलिक अम्लों के व्युत्पन्न चार प्रकार के होते हैं। जब कार्बोक्सिलिक अम्लों (RCOOH) का – OH समूह एक भिन्न समूह (Z) द्वारा प्रतिस्थापित होता है तो इनके व्युत्पन्न प्राप्त होते हैं।
जब Z = X (हैलोजन) तो प्राप्त व्युत्पन्न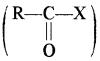
को अम्ल के हैलाइड, Z= NH2 तो अम्ल के ऐमाइड (RCONH2), Z = OR1 ता अम्ल क एस्टर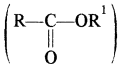
तथा Z = – OCOR1 होने पर इन्हें अम्ल के ऐन्हाइड्राइड [(RCO)2] कहते हैं।
• अम्ल के हैलाइड (R – COX): यौगिक का नाम = पूर्वलग्न + इल हैलाइड (yl Halide)
उदाहरण –
• अम्ल के ऐमाइड (RCONH2)
• अम्ल के एस्टर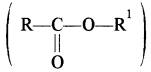
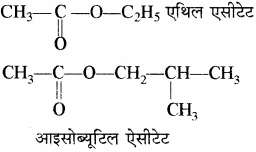
एस्टरों का सामान्य नाम देने के लिए सर्वप्रथम ऑक्सीजन से जुड़े हुए मूलक का नाम तथा उसके पश्चात् अम्ल (जिससे वह बना है) के सामान्य नाम के अनुसार फॉर्मेट, ऐसीटेट इत्यादि लिखा जाता है।
उदाहरण –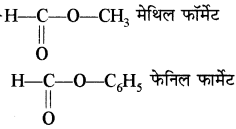
• अम्ल के ऐन्हाइड्राइड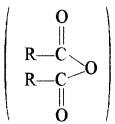
ऐन्हाइड्राइड का अर्थ है जल का निकलना, अतः दो – COOH समूहों में से एक जल का अणु निकलने पर ऐन्हाइड्रोइड प्राप्त होते हैं।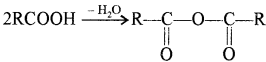
ऐन्हाइड्राइडों का नाम देने के लिए अम्ल के सामान्य नाम (जिससे यह बना है) के साथ ऐन्हाइड्राइड लिखा जाता है।
उदाहरण –
दो भिन्न – भिन्न अम्लों से ऐन्हाइड्राइड बनने पर उन्हें अंग्रेजी वर्णमाला क्रम में लिखा जाता है।
प्रश्न 55.
IUPAC नामकरण के नियमों की व्याख्या उदाहरण सहित कीजिए।
उत्तर:
आई.यू.सी. (IUC) / आई.यू.पी.ए.सी. (IUPAC) / सुव्यवस्थित (Systematic) / जेनेवा प्रणाली:
सामान्य या रूढ़ नामों में निम्नलिखित कमियाँ पाई गईं –
(1) किसी एक यौगिक के एक से अधिक होना जैसे मेथिल ऐल्कोहॉल को काष्ठ स्पिरिट (Wood sprit) तथा कार्बिनॉल भी कहा गया।
(2) जब यौगिक में कार्बन श्रृंखला लम्बी होती है तो उनके समावयवों की संख्या बढ़ जाती है जैसे हैप्टेन के नौ (9) समावयवी तथा नोनेन के 35 समावयवी होते हैं जिनके नाम रूढ़ प्रणाली में देना अत्यन्त मुश्किल था। अतः किसी भी यौगिक का अविवादित एवं स्वीकार्य नाम देने के लिए वैज्ञानिकों ने IUPAC प्रणाली को अपनाया।
नामकरण की IUPAC पद्धति एक सुव्यवस्थित पद्धति है जिसमें लाखों यौगिकों का नाम आसानी से दिया जा सकता है तथा उनकी स्पष्ट रूप से पहचान की जा सकती है क्योंकि इसमें यौगिक का नाम उसकी संरचना के अनुसार दिया जाता है। अतः यौगिक के नाम के आधार पर उसकी संरचना आसानी से बनायी जा सकती है। कुछ यौगिकों के IUPAC नाम लंबे तथा जटिल होते हैं अतः उनके सामान्य (रूढ़) नामों को ही अधिक महत्व दिया जाता है। किसी कार्बनिक यौगिक का IUPAC नाम लिखने के लिए सर्वप्रथम मूल हाइड्रोकार्बन तथा उससे जुड़े क्रियात्मक समूहों की पहचान करनी होती है। जनक हाइड्रोकार्बन के नाम में उपयुक्त पूर्वलग्न (Prefix) तथा अनुलग्न (Suffix) जोड़कर यौगिक का नाम दिया जाता है।
उदाहरण –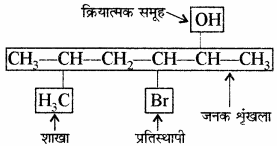
ऐल्केनों का IUPAC नामकरण:
I. सीधी श्रृंखलायुक्त ऐल्केन:
कार्बन – कार्बन एकल बन्ध युक्त हाइड्रोकार्बनों (संतृप्त हाइड्रोकार्बन) को ऐल्केन कहते हैं। पहले इन्हें पैराफिन (Paraffins) भी कहा जाता था क्योंकि ये बहुत कम क्रियाशील होते हैं तथा लैटिन भाषा में Para का अर्थ है कम तथा affins का अर्थ है क्रियाशीलता। ऐल्केनों में मेथेन (CH4), एथेन (C2H6), प्रोपेन (C3H8) तथा ब्यूटेन (C4H10) सामान्य नाम है लेकिन IUPAC पद्धति में इन्हीं नामों को मान लिया गया है। ब्यूटेन के पश्चात् शेष एल्केनों के नाम उनकी सीधी श्रृंखला की संरचना पर आधारित होते हैं तथा उनका नाम देते समय कार्बन परमाणुओं की संख्या के आधार पर पूर्वलग्न एवं इसके पश्चात् अनुलग्न ऐन (ane) का प्रयोग किया जाता है।
कुछ सीधी श्रृंखलायुक्त ऐल्केनों के पूर्व लग्न, नाम तथा उदाहरण निम्नलिखित हैं –
सारणी – सीधी श्रृंखलायुक्त ऐल्केनों के नाम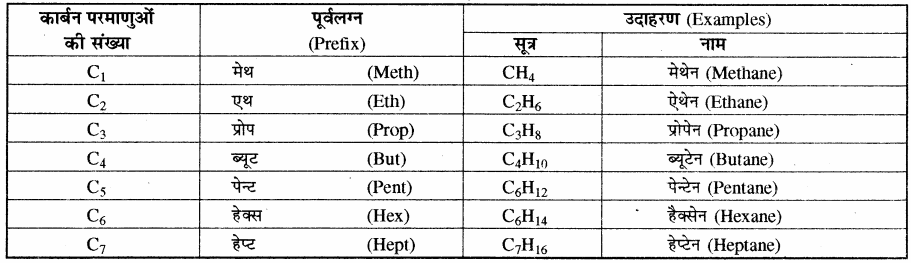
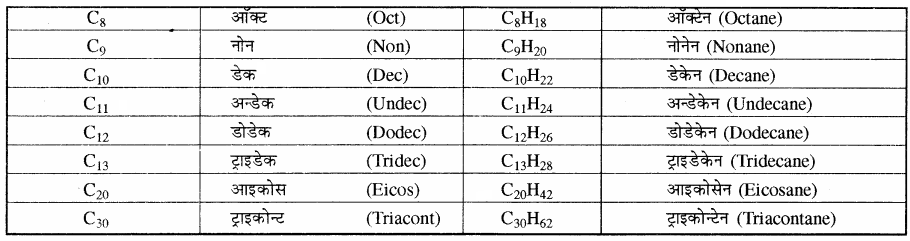
II. शाखित श्रृंखलायुक्त एल्केन:
शाखित श्रृंखलायुक्त ऐल्केनों में कार्बन परमाणुओं की एक या एक से अधिक छोटी श्रृंखलाएँ जनक श्रृंखला के कई कार्बन परमाणुओं के साथ जुड़ी होती हैं। इन शाखाओं को ऐल्किन मूलक या ऐल्किल समूह कहा जाता है जो कि शाखित तथा अशाखित दोनों प्रकार की होती हैं। ऐल्किल मूलकों के नामों का अध्ययन इसी अध्याय में पूर्व में किया जा चुका है।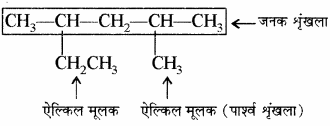
शाखित श्रृंखला युक्त ऐल्केनों का नाम देने के लिए ऐल्किल समूह का नाम पूर्वलग्न के रूप में तथा जनक श्रृंखला ऐल्केन का नाम अनुलग्न के रूप में प्रयुक्त किया जाता है।
शाखित श्रृंखलायुक्त ऐल्केनों के IUPAC नामकरण में प्रयुक्त नियम निम्न प्रकार हैं –
(1) दीर्घतम कार्बन श्रृंखला का चयन:
सर्वप्रथम यौगिक में दीर्घतम कार्बन श्रृंखला का चयन किया जाता है, जिसे जनक श्रृंखला या मूल श्रृंखला (Root Chain) या मुख्य श्रृंखला (Main Chain) कहते हैं। संरचना (I) में जनक श्रृंखला में नौ कार्बन हैं। इसी यौगिक की संरचना II में प्रदर्शित जनक श्रृंखला का चयन सही नहीं है, क्योंकि इसमें आठ कार्बन हैं।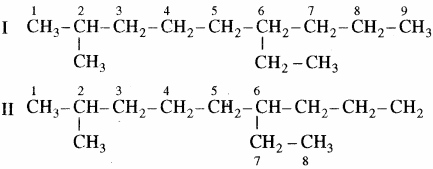
(2) वरीय कार्बन श्रृंखला का चयन (अधिकतम प्रतिस्थापी चयन नियम):
किसी ऐल्केन में यदि सबसे लम्बी श्रृंखला (समान कार्बन युक्त) की दो या दो से अधिक सम्भावनाएँ हैं तो उस कार्बन श्रृंखला का मुख्य श्रृंखला के रूप में चयन किया जाता है, जिसमें प्रतिस्थापियों या पाश्र्व श्रृंखला की संख्या अधिकतम हो।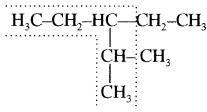
इस यौगिक में सीधी श्रृंखला में कार्बन परमाणुओं की संख्या 5 है। परन्तु इसमें केवल एक ही प्रतिस्थापी (आइसो प्रोपिल) जुड़ा है जबकि अंकित मुख्य श्रृंखला में 5 कार्बन परमाणुओं के साथ दो प्रतिस्थापी (एथिल तथा मेथिल) जुड़े हैं।
(3) कार्बन परमाणुओं की श्रृंखला का क्रमांकन (लघुसंख्यक नियम):
जनक ऐल्केन को ज्ञात करने के लिए चयनित मुख्य श्रृंखला के कार्बन परमाणुओं का अंकन किया जाता है। यह क्रमांकन यौगिक के उस सिरे से प्रारम्भ करते हैं, जिधर से शाखा के रूप में उपस्थित ऐल्किल समूहों को न्यूनतम अंक मिले।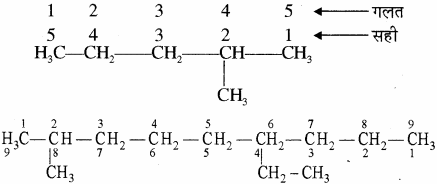
उपर्युक्त उदाहरण में क्रमांकन बाईं ओर से होना चाहिए (कार्बन संख्या 2 तथा 6 पर शाखा), न कि दाईं ओर से (कार्बन संख्या 4 तथा 8 पर शाखा)।
(4) न्यूनतम प्रतिस्थापी योग नियम:
यदि किसी यौगिक में समान प्रतिस्थापी दोनों सिरों से समान अंक पर स्थित हैं तथा इनके अतिरिक्त कोई अन्य प्रतिस्थापी भी उपस्थित है तो कार्बन श्रृंखला का क्रमांकन उस सिरे से किया जाता
है जिधर से प्रतिस्थापियों की स्थिति के अंकों का योग न्यूनतम हो।
उदाहरणार्थ: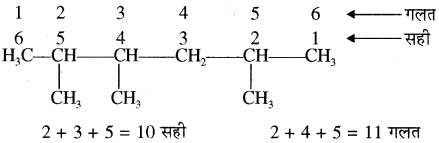
(5) प्रतिस्थापियों का नामोल्लेख करने के नियम:
शाखा के रूप में स्थित ऐल्किल समूहों के नाम एल्केन के नाम से पहले पूर्वलग्न के रूप में लिखे जाते हैं तथा इन ऐल्किल समूहों (प्रतिस्थापियों) की स्थिति को संख्या द्वारा दर्शाया जाता है। भिन्न – भिन्न प्रकार के ऐल्किल – समूहों के नामों को अंग्रेजी वर्णमाला क्रम में लिखा जाता है चाहे श्रृंखला में उनकी स्थिति कुछ भी हो। ऐल्किल समूह तथा संख्या के मध्य संयोजक – रेखा एवं ऐल्किल समूह तथा जनक श्रृंखला ऐल्केन को मिलाकर लिखा जाता है।
उदाहरण: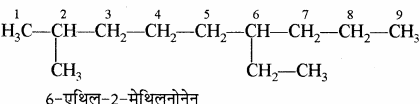
(6) जब यौगिक में दो या दो से अधिक समान प्रतिस्थापी उपस्थित होते हैं तो उनकी संख्याओं के मध्य अल्पविराम (कोमा) लगाते हैं तथा इन प्रतिस्थापी समूहों के नाम को दुबारा न लिखकर इन्हें उचित पूर्वलग्न, जैसे – डाई, ट्राई, टेट्रा इत्यादि द्वारा दर्शाया जाता है। लेकिन इन्हें (डाई, ट्राई) अंग्रेजी वर्णमाला क्रम में नहीं लिया जाता है। तथा यौगिक का नाम लिखते समय प्रतिस्थापी समूहों के नामों को ही अंग्रेजी वर्णमाला के क्रम में लिया जाता है।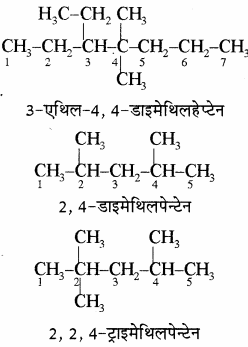
(7) अंग्रेजी वर्णमाला क्रम नियम:
जब किसी यौगिक में दो असमान प्रतिस्थापियों की स्थिति समान होती है तो अंग्रेजी वर्णमाला क्रम में पहले आने वाले प्रतिस्थापी को न्यूनतम अंक दिया जाता है। अतः निम्नलिखित यौगिक का सही नाम 3 – एथिल – 6 – मेथिलऑक्टेन है, न कि 6 – एथिल – 3 – मेथिलऑक्टेन।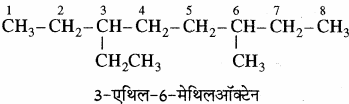
(8) जब प्रतिस्थापी (ऐल्किल समूह) बड़ा एवं जटिल होता है। तथा जिसका कोई सामान्य नाम नहीं होता तो उसका भी IUPAC नाम दिया जाता है जिसमें शाखित श्रृंखला के उस कार्बन को प्रथम अंक दिया जाता है जो जनक श्रृंखला से जुड़ा होता है एवं ऐसे जटिल प्रतिस्थापी का नाम कोष्ठक में लिखा जाता है। जैसे –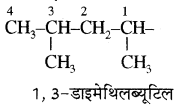
जब प्रतिस्थापियों का सामान्य नाम लिखा जाता है तो उनका अंग्रेजी वर्णमाला क्रम देखते समय आइसो (iso) तथा नियो (ne0) पूर्वलग्नों को मूल ऐल्किल समूह के नाम का भाग माना जाता है। अतः इनका प्रथम अक्षर अंग्रेजी वर्णमाला क्रम में देखा जाता है। परन्तु पूर्वलग्न द्वितीयक (sec -) तथा तृतीयक (tert -) को मूल ऐल्किल समूह के नाम का भाग नहीं माना जाता अतः इनका प्रथम अक्षर अंग्रेजी वर्णमाला क्रम में नहीं देखा जाता है। आइसो तथा अन्य पूर्वलग्नों का प्रयोग आई.यू.पी.ए.सी. पद्धति में भी किया जाता है।
उदाहरण –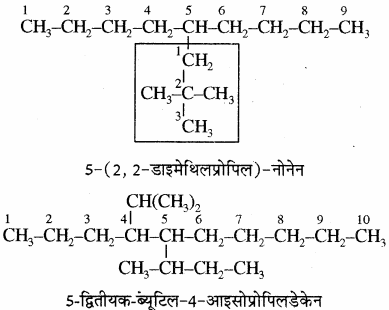
III. असंतृप्त हाइड्रोकार्बन का नामकरण:
वे हाइड्रोकार्बन जिनमें कम से कम एक द्विबन्ध (> C = C <) या एक त्रिआबन्ध (- C = C -) उपस्थित होता है उन्हें अंसतृप्त हाइड्रोकार्बन कहते हैं। > C = C < युक्त यौगिकों को ऐल्कीन तथा – C = C – युक्त यौगिकों को एल्काइन कहा जाता है।
(1) एल्कीनों का नामकरण: एल्कीनों का I.U.PA.C. नामकरण निम्नलिखित नियमों के अनुसार दिया जाता है –
नियम 1.
मुख्य श्रृंखला में द्विआबन्ध को लेकर इसको न्यूनतम अंक दिया जाता है तथा इसके लिए अनुलग्न-इन प्रयुक्त होता है एवं अनुलग्न से पहले द्विबन्ध की स्थिति बतायी जाती है।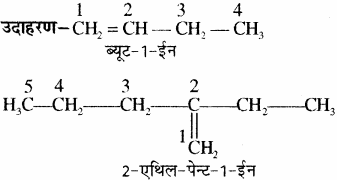
यद्यपि इसमें सीधी श्रृंखला सबसे लम्बी है परन्तु इसमें C = C नहीं है।
नियम 2.
मुख्य श्रृंखला का अंकन करते समय द्वि-आबन्ध को पाश्र्व श्रृंखला (CH3 – अथवा C2H5 – समूह) की तुलना में प्राथमिकता दी जाती है। लेकिन द्विबन्ध दोनों सिरों से समान स्थिति पर आता है तो प्रतिस्थापी को न्यूनतम अंक दिया जाता है।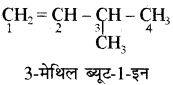
नियम 3.
जब किसी यौगिक में द्विआबन्ध तथा त्रिआबन्ध की स्थिति समान होती है तो द्वि – आबन्ध को प्राथमिकता दी जाती है, अन्यथा द्विआबन्ध या त्रिआबन्ध में से जो भी पहले आता है उसी सिरे से अंकन कर दिया जाता है लेकिन नाम लिखते समय पहले ईन तथा इसके पश्चात् आइन लिखा जाता है।
नियम 4. जब यौगिक में दो द्वि – आबन्ध होते हैं तो इन्हें एल्कोडाइईन कहा जाता है।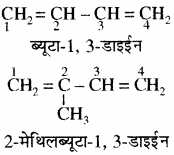
एल्काइनों का नामकरण:
नियम 1. त्रि – आबन्ध को जनक श्रृंखला में लेकर उसे न्यूनतम अंक दिया जाता है तथा शेष नियम एल्कीनों के समान ही होते हैं।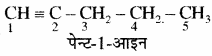
नियम 2. पाश्र्व श्रृंखला की तुलना में त्रिआबन्ध को प्राथमिकता दी जाती है।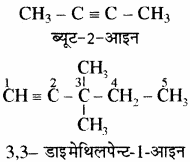
नियम 3. यौगिक में दो या अधिक त्रिआबन्ध उपस्थित होने पर डाइआइन, ट्राइआइन इत्यादि अनुलग्न प्रयुक्त किए जाते हैं।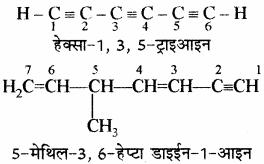
(इस यौगिक में दायीं ओर से अंकन किया गया है क्योंकि इससे द्विआबन्ध तथा त्रिआबन्ध दोनों को न्यूनतम अंक मिले हैं।)
असंतृप्त हाइड्रोकार्बन के अन्य उदाहरण –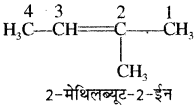
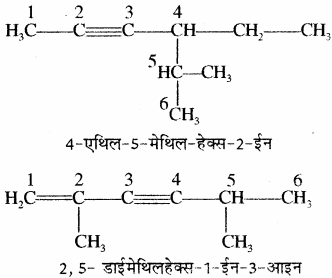
IV. चक्रीय संतृप्त हाइड्रोकार्बनों का नामकरण:
एकल चक्रीय ऐलिसाइक्लिक संतृप्त हाइड्रोकार्बनों का नाम संबंधित खुली श्रृंखला ऐल्केन के नाम से पहले पूर्वलग्न ‘साइक्लो’ लगाकर दिया जाता है। पार्श्व श्रृंखलाओं के नामकरण में खुली (विवृत) श्रृंखला यौगिकों के नियम ही प्रयुक्त होते हैं।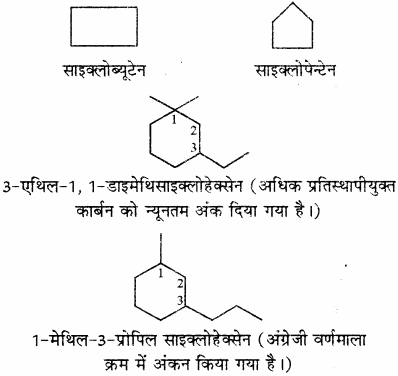
क्रियात्मक समूह युक्त यौगिकों का IUPAC नामकरण (IUPAC Nomenclature of Compounds having Functional Group)
V. एक क्रियात्मक समूह युक्त यौगिकों का नामकरण:
(i) सर्वप्रथम यौगिक में उपस्थित क्रियात्मक समूह की पहचान की जाती है, ताकि उपयुक्त अनुलग्न का चयन किया जा सके। अनुलग्न भी दो प्रकार के होते हैं – प्राथमिक तथा द्वितीयक। प्राथमिक अनुलग्न कार्बन परमाणुओं के मध्य बन्ध के प्रकार को दर्शाता है जैसे ऐन (C – C), ईन (C = C) तथा आइन (C = C) जबकि क्रियात्मक समूह को प्रदर्शित करने के लिए द्वितीयक अनुलग्न का प्रयोग किया जाता है।
(ii) क्रियात्मक समूह की स्थिति दर्शाने के लिए दीर्घतम श्रृंखला का अंकन उस सिरे से किया जाता है जिधर से उस कार्बन को न्यूनतम अंक मिले जिससे क्रियात्मक समूह जुड़ा हुआ है।
(iii) यौगिक का नाम लिखते समय क्रियात्मक समूह का नाम इसकी स्थिति सहित अनुलग्न के रूप में तथा सभी प्रतिस्थापियों को पूर्वलग्न के रूप में अंग्रेजी वर्णक्रम में लिखा जाता है।
विभिन्न क्रियात्मक समूहों को वरीयता क्रम, उनके अनुलग्न तथा पूर्वलग्न नीचे दी गयी सारणी में दिए गए हैं।
सारणी – विभिन्न क्रियात्मक समूहों को वरीयता क्रम, अनुलग्न तथा पूर्वलग्न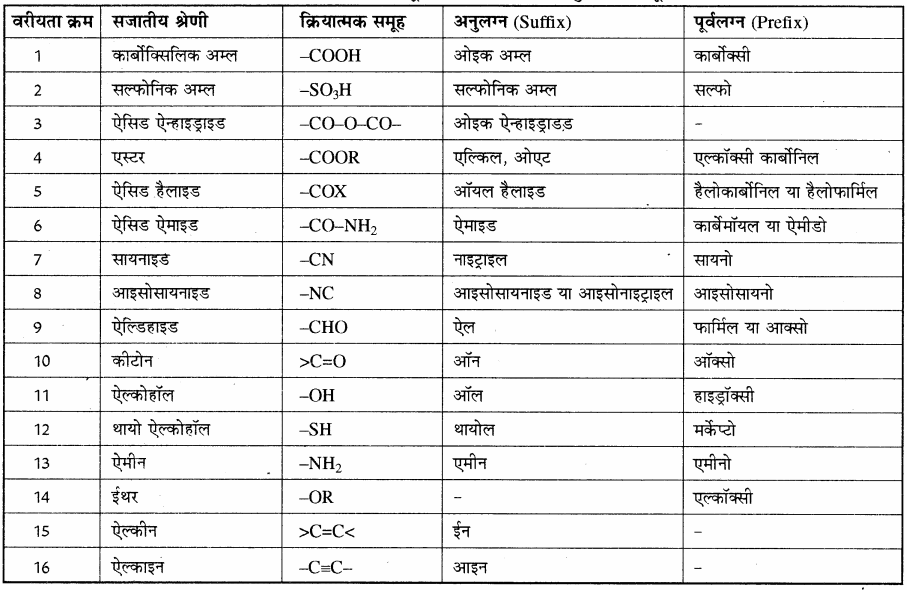
निम्नलिखित समूह हमेशा प्रतिस्थापी (पूर्वलग्न) के रूप में ही प्रयुक्त होते हैं तथा इनका कोई अनुलग्न नहीं होता है।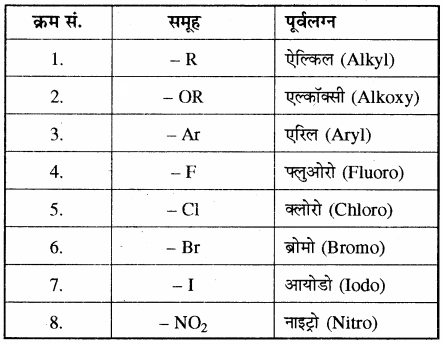
कुछ क्रियात्मक समूहों के अतिरिक्त अनुलग्न भी दिए गए हैं।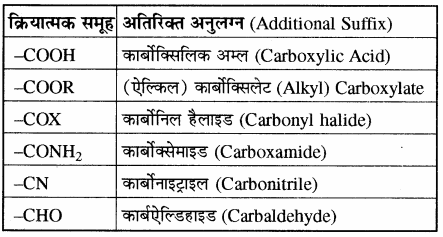
उदाहरण –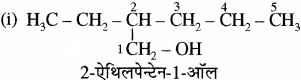
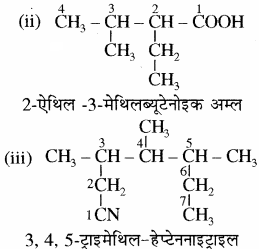
नोट –
(i) यदि क्रियात्मक समूह जनक श्रृंखला के दोनों सिरों से समान स्थिति है तो श्रृंखला का क्रमांकन उस सिरे से किया जाता है। जिधर से प्रतिस्थापी निकट होता है। जैसे –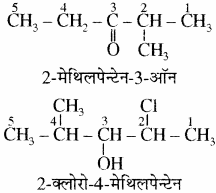
(प्रतिस्थापी क्लोरो को अंग्रेजी वर्णमाला क्रम में निम्नतम स्थिति दी गई है)
(ii) यदि किसी यौगिक में एक ही प्रकार के क्रियात्मक समूहों की संख्या एक से अधिक है तो उनके अनुलग्न से पहले डाइ, ट्राई, टेट्रा इत्यादि लिखा जाता है।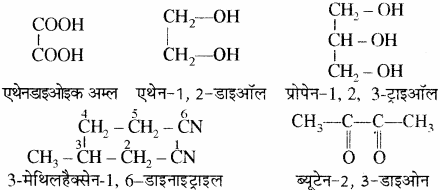
एक क्रियात्मक समूह युक्त विभिन्न सजातीय श्रेणियों के यौगिकों के IUPAC नाम – जब किसी यौगिक में निम्नलिखित क्रियात्मक समूह उपस्थित है या ये प्राथमिक क्रियात्मक समूह के रूप में उपस्थित हैं तो इनके कार्बन को जनक श्रृंखला में लिया जाता है तथा श्रृंखला का अंकन भी इसी कार्बन से प्रारम्भ किया जाता है –
COOH, – COCl, – CONH2, COOR, – CHO, – CN
(i) कार्बोक्जिलिक एसिड: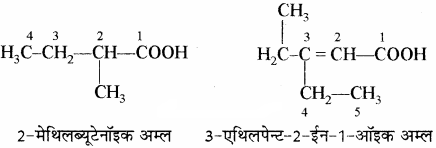
![]()
(ii) सल्फोनिक अम्ल: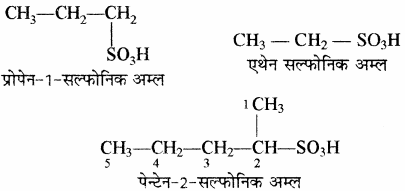
(iii) एसिड ऐन्हाइड्राइड: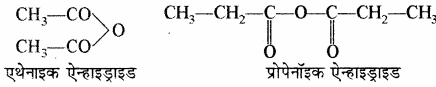
(iv) एस्टर (Ester): एस्टर के नाम में सर्वप्रथम ऑक्सीजन से जुड़े एल्किल समूह को लिखा जाता है।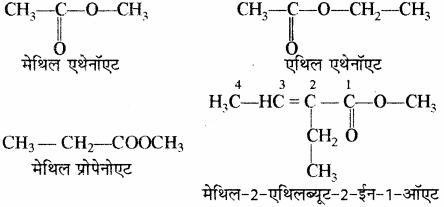
(v) ऐसिड हैलाइड: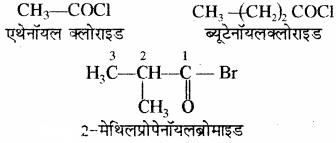
(vi) ऐसिड एमाइड: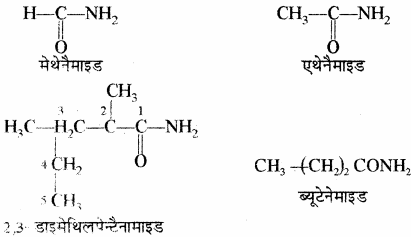
(vii) सायनाइड: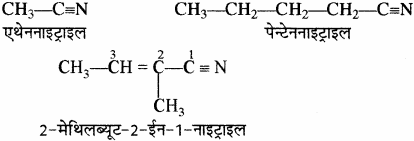
(viii) आइसोसायनाइड:![]()
(ix) ऐल्डिहाइड: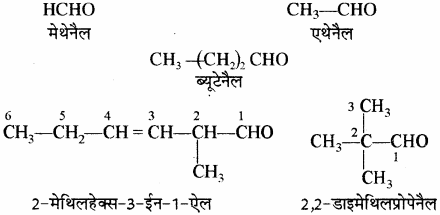
(x) कीटोन: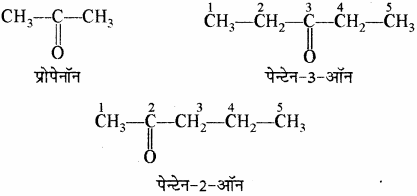
(xi) ऐल्कोहॉल: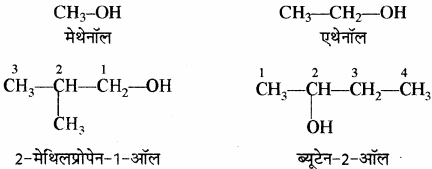
(xii) थायो ऐल्कोहॉल:
(xiii) ऐमीन:
ऐमीन तीन प्रकार के होते हैं –
(a) प्राथमिक (1°)
(b) द्वितीयक (2°) तथा
(C) तृतीयक (3°)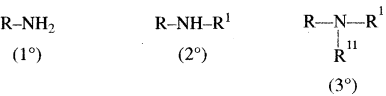
(a) प्राथमिक ऐमीन: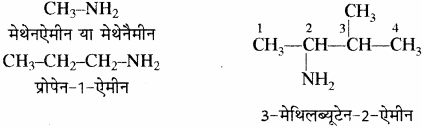
(b) द्वितीयक ऐमीन:
द्वितीयक ऐमीन में अधिकतम कार्बन परमाणुओं की जनक श्रृंखला लेकर शेष मूलकों को N-प्रतिस्थापी माना जाता है।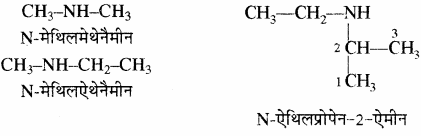
(c) तृतीयक ऐमीन:
द्वितीयक ऐमीन के समान तृतीयक ऐमीन में भी अधिकतम कार्बन परमाणुओं की जनक श्रृंखला लेकर शेष दो मूलकों को N, N – प्रतिस्थापी माना जाता है।
(xiv) ईथर:
ईथर में जनक श्रृंखला (अधिकतम कार्बन) का चयन करके शेष समूह के लिए पूर्वलग्न ऐल्कॉक्सी प्रयुक्त किया जाता है। इसमें कोई अनुलग्न नहीं होता है।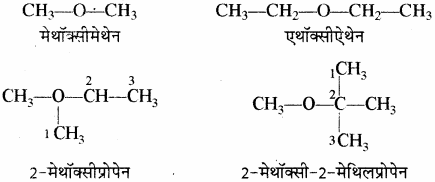
इस उदाहरण में मेथॉक्सी तथा मेथिल की स्थिति समान है लेकिन इन्हें अंग्रेजी वर्णमाला क्रम में लिखा गया है।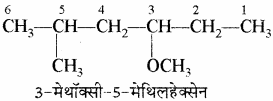
इस उदाहरण में अंकन करते समय मेथिल की तुलना में मेथॉक्सी को महत्व दिया गया है।
(xv) ऐल्किल हैलाइड: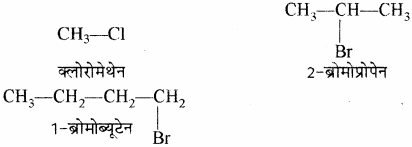
(xvi) नाइट्रो ऐल्केन: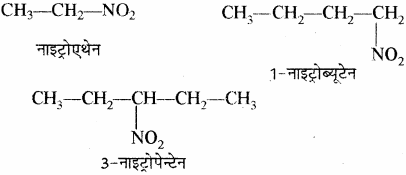
VI. बहुक्रियात्मक समूह (एक से अधिक भिन्न – भिन्न क्रियात्मक समूह) युक्त यौगिकों का IUPAC नामकरण –
किसी यौगिक में उपस्थित सभी क्रियात्मक समूहों में से जो समूह . वरीयता क्रम में पहले आता है उसे मुख्य क्रियात्मक समूह तथा अन्य क्रियात्मक समूहों को प्रतिस्थापी माना जाता है। अतः किसी बहुक्रियात्मक समूह युक्त यौगिक में मुख्य क्रियात्मक समूह ज्ञात करने के बाद इस यौगिक को भी एक क्रियात्मक समूह युक्त यौगिक के समान मानकर ही नाम दिया जाता है।
क्रियात्मक समूहों की प्राथमिकता का घटता क्रम निम्न प्रकार होता है –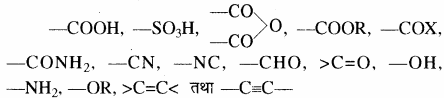
बहुक्रियात्मक समूहयुक्त यौगिक के नामकरण के लिए निम्नलिखित नियम प्रयुक्त होते हैं –
(1) सर्वप्रथम उस सर्वाधिक लम्बी कार्बन श्रृंखला (जनक श्रृंखला) का चयन करते हैं जिसमें मुख्य क्रियात्मक समूह उपस्थित होता है। अन्य क्रियात्मक समूह (प्रतिस्थापी) भी जनक श्रृंखला से जुड़े होने चाहिए।
(2) जब – CN, – COX, – CONH2 तथा – COOR समूह प्रमुख क्रियात्मक समूह के रूप में नहीं होते हैं तो इनके कार्बन को जनक श्रृंखला में नहीं लिया जाता है।
(3) जनक श्रृंखला का क्रमांकन उस सिरे से किया जाता है जिस सिरे से मुख्य क्रियात्मक समूह को न्यूनतम अंक मिलता है।
(4) यौगिक का नाम लिखते समय मुख्य क्रियात्मक समूह का अनुलग्न तथा अन्य क्रियात्मक समूहों (प्रतिस्थापी के रूप में) एवं ऐल्किल समूहों को पूर्वलग्न के रूप में अंग्रेजी वर्णमाला क्रम में लिखा जाता है एवं अंकन करते समय भी इनका अंग्रेजी वर्णमाला क्रम ही देखा जाता है।
(5) यदि यौगिक में द्विबन्ध (C = C) अथवा त्रिबन्ध (C = C) भी उपस्थित है तो इसका नाम मुख्य क्रियात्मक समूह के नाम से पहले तथा कार्बन श्रृंखला के नाम के पश्चात् लिखते हैं। द्विबन्ध अथवा त्रिबन्ध की स्थिति भी इसके नाम के साथ दर्शायी जाती है।
(6) जब ऐल्डिहाइड समूह (- CHO) प्रतिस्थापी के रूप में होता है तथा इस समूह का कार्बन जनक श्रृंखला में लिया गया है तो इसके लिए पूर्वलग्न ऑक्सो प्रयुक्त किया जाता है अन्यथा फार्मिल का प्रयोग किया जाएगा।
उदाहरण –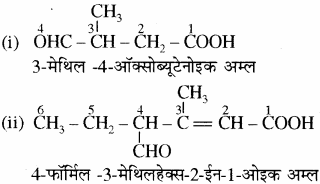
उदाहरण –
(i) में – CHO समूह का कार्बन जनक श्रृंखला में लिया गया है। अतः पूर्वलग्न ‘ऑक्सो’ का प्रयोग किया गया है जबकि उदाहरण
(ii) में – CHO समूह का कार्बन जनक श्रृंखला में नहीं है, अतः पूर्वलग्न ‘फार्मिल’ प्रयुक्त किया गया है।
VII. यौगिक के IUPAC नाम से उसकी संरचना लिखना:
किसी यौगिक के IUPAC नाम से संरचना लिखने के लिए सर्वप्रथम नाम के अनुसार कार्बन परमाणुओं की श्रृंखला लिखते हैं तथा किसी एक सिरे से इस श्रृंखला का क्रमांकन कर लेते हैं, इसके पश्चात् नाम में उपस्थित प्रतिस्थापी तथा क्रियात्मक समूह को उनकी स्थिति के अनुसार लिख देते हैं। अब प्रत्येक कार्बन परमाणु की संयोजकता को हाइड्रोजन द्वारा पूर्ण कर देते हैं।
उदाहरण –
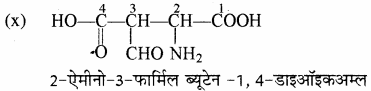
(i) 5 – ऐमीनो – 3 – मेथिल – 4- ऑक्सो हेक्स – 2 – ईन – 1 – ऐल –
श्रृंखला के नाम ‘हेक्स’ के अनुसार छ: कार्बन की श्रृंखला बनाते हैं तथा इसका किसी एक सिरे से (माना दायीं ओर से) क्रमांकन करते हैं। अब C5 पर ऐमीनो समूह (- NH2), C3 पर मेथिल समूह तथा C2 – C3 के मध्य द्विबन्ध लगाते हैं। C4 को कीटोनिक समूह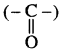
में तथा प्रथम कार्बन (C1) को एल्डिहाइड समूह (- CHO) में परिवर्तित कर देते हैं, क्योंकि इन दोनों समूहों के कार्बन परमाणु जनक श्रृंखला में गिने जा चुके हैं।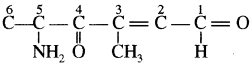
अब कार्बन परमाणुओं की संयोजकता को पूर्ण करने के लिए आवश्यक हाइड्रोजन परमाणु लगा देते हैं, जिससे निम्नलिखित संरचना प्राप्त होती है –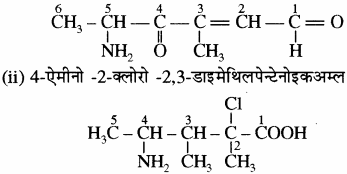
VIII. यौगिक के गलत नाम से सही नाम लिखना: किसीयौगिक के गलत नाम को सही करने के लिए निम्न विधि प्रयुक्त की जाती है। सर्वप्रथम गलत नाम से उपर्युक्त विधि के अनुसार यौगिक की संरचना लिख लेते हैं।
उदाहरण – 4 – ऐमीनो – 3 – हाइड्रॉक्सी – ब्यूट – 2 – ईन
यौगिक के नाम के अनुसार सर्वप्रथम चार कार्बन की एक श्रृंखला बनाकर उसका एक सिरे से क्रमांकन कर लेते हैं। अब कार्बन 2 तथा 3 के मध्य एक द्विबन्ध लगाते हैं। कार्बन 3 पर एक – OH समूह तथा कार्बन 4 पर एक – NH2 समूह लगाते हैं। अब प्रत्येक कार्बन की संयोजकता हाइड्रोजन परमाणुओं की आवश्यक संख्या से पूर्ण करते हैं तो निम्नलिखित संरचना प्राप्त होती है –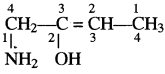
इसका सही नाम लिखने के लिए IUPAC नियम के अनुसार जनक श्रृंखला का अंकन करके मुख्य क्रियात्मक समूह का अनुलग्न प्रयुक्त करने पर निम्नलिखित नाम प्राप्त होगा –
1 – ऐमीनोब्यूट – 2 – ईन – 2 – ऑल
(i) बेन्जीन व्युत्पन्नों की नाम पद्धति:
(1) बेन्जीन व्युत्पन्नों (ऐरोमैटिक यौगिकों) का IUPAC नाम देने के लिए पहले बेन्जीन वलय से जुड़े प्रतिस्थापी का नाम पूर्वलग्न के रूप में तथा इसके पश्चात् बेन्जीन लिखा जाता है। लेकिन यौगिकों के रूढ़ नाम (जो कोष्ठक में दिए गए हैं) भी प्रचलन में हैं।
उदाहरण –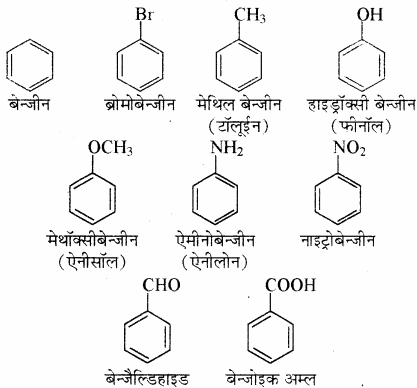
(2) द्विप्रतिस्थापी बेन्जीन व्युत्पन्नों का नाम देते समय प्रतिस्थापी समूहों की स्थितियाँ संख्याओं द्वारा दर्शायी जाती हैं तथा वलय का अंकन इस प्रकार किया जाता है कि प्रतिस्थापियों को न्यूनतम अंक मिलें। जैसे यौगिक (b) का नाम 1, 3 – डाइक्लोरो बेन्जीन होगा न कि 1, 5 डाइक्लोरोबेन्जीन।
उदाहरण –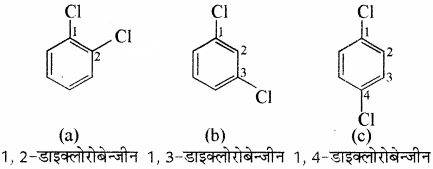
(3) एरोमेटिक यौगिकों के नामांकरण की रूढ़ पद्धति में 1, 2 -; 1, 3 – तथा 1, 4 – स्थितियों को क्रमशः ऑर्थो (o), मेटा (m) तथा पैरा (p) पूर्वलग्नों द्वारा दर्शाया जाता है। अतः 1, 3 – डाइक्लोरोबेन्जीन का रूढ़ नाम मेटा डाइक्लोरोबेन्जीन है तथा 1, 2 – तथा 1, 4 – डाइक्लोरोबेन्जीन को क्रमशः ऑर्थों (o) तथा पैरा (p) डाइक्लोरोबेन्जीन कहते हैं।
(4) त्रि तथा बहुप्रतिस्थापी बेन्जीन के IUPAC नामकरण में प्रतिस्थापियों की स्थितियाँ, न्यूनतम संख्या के नियम का पालन करते हुए दी जाती हैं।
(5) कभी – कभी बेन्जीन व्युत्पन्न के रूढ़ नाम को मूल यौगिक के रूप में (जनक) लिया जाता है तथा मूल यौगिक के प्रतिस्थापी की स्थिति को संख्या 1 देकर इस प्रकार अंकन किया जाता है कि शेष प्रतिस्थापियों को न्यूनतम अंक मिलें तथा प्रतिस्थापियों के नाम अंग्रेजी वर्णमाला क्रम में लिखे जाते हैं।
उदाहरण –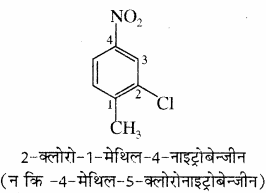
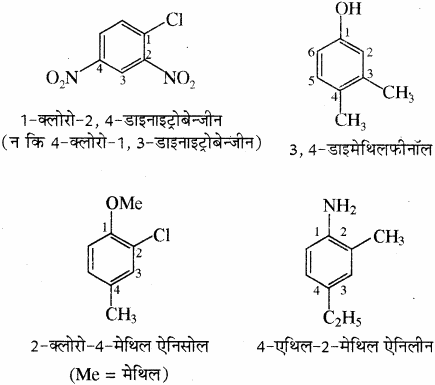
(6) जब बेन्जीन वलय तथा क्रियात्मक समूह संतृप्त हाइड्रोकार्बन श्रृंखला से जुड़े होते हैं तब बेन्जीन वलय को जनक न मानकर इसे प्रतिस्थापी माना जाता है तथा इसका नाम फेनिल दिया जाता है एवं इसे C6H5 – या संक्षेप में Ph लिखते हैं।
उदाहरण –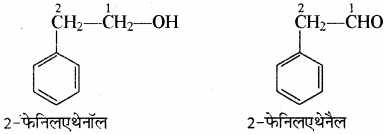
All Chapter RBSE Solutions For Class 11 Chemistry Hindi Medium
—————————————————————————–
All Subject RBSE Solutions For Class 11 Hindi Medium
————————————————————
All Chapter RBSE Solutions For Class 11 Chemistry Hindi Medium
All Subject RBSE Solutions For Class 11 Hindi Medium
Remark:
हम उम्मीद रखते है कि यह RBSE Class 11 chemistry Solutions in Hindi आपकी स्टडी में उपयोगी साबित हुए होंगे | अगर आप लोगो को इससे रिलेटेड कोई भी किसी भी प्रकार का डॉउट हो तो कमेंट बॉक्स में कमेंट करके पूंछ सकते है |
यदि इन solutions से आपको हेल्प मिली हो तो आप इन्हे अपने Classmates & Friends के साथ शेयर कर सकते है और HindiLearning.in को सोशल मीडिया में शेयर कर सकते है, जिससे हमारा मोटिवेशन बढ़ेगा और हम आप लोगो के लिए ऐसे ही और मैटेरियल अपलोड कर पाएंगे |
आपके भविष्य के लिए शुभकामनाएं!!