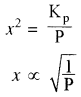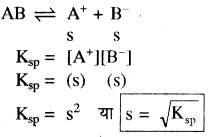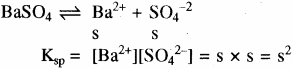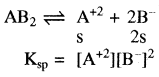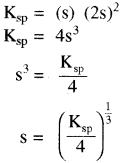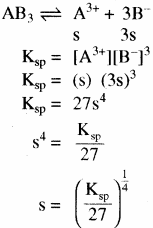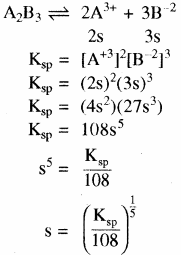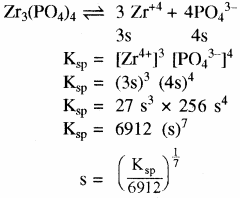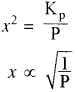हेलो स्टूडेंट्स, यहां हमने राजस्थान बोर्ड Class 11 Chemistry Chapter 7 साम्य सॉल्यूशंस को दिया हैं। यह solutions स्टूडेंट के परीक्षा में बहुत सहायक होंगे | Student RBSE solutions for Class 11 Chemistry Chapter 7 साम्य pdf Download करे| RBSE solutions for Class 11 Chemistry Chapter 7 साम्य notes will help you.
Table of Contents
Rajasthan Board RBSE Class 11 Chemistry Chapter 7 साम्य
RBSE Class 11 Chemistry Chapter 7 पाठ्यपुस्तक के अभ्यास प्रश्न
RBSE Class 11 Chemistry Chapter 7 वस्तुनिष्ठ प्रश्न
प्रश्न 1.
A + 2B ⇌ C अभिक्रिया के लिए साम्य स्थिरांक का व्यंजक है –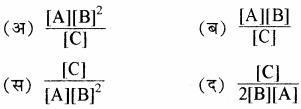
प्रश्न 2.
अभिक्रिया, A (ठोस) + 2B (गैस) ⇌ 3C (ठोस) + 2D (गैस) के लिए –
(अ) Kp = Kc (RT)0
(ब) Kp = Kc R2T2(स) Kp = Kc (RT)
(द) Kp = Kc R-2T-2
प्रश्न 3.
अभिक्रिया N2 + 3H2 ⇌ 2NH3 + x किलो जूल में अधिक अमोनिया बनाने के लिए आवश्यक शर्ते हैं –
(अ) उच्च ताप. और उच्च दाब
(ब) कम ताप और उच्च दाब
(स) कम ताप और कम दाब
(द) उच्च ताप और कम दाब
प्रश्न 4.
AB तथा AB2 प्रकार के दोनों विद्युत अपघट्यों के विलेयता गुणनफल 1 x 10-10 हैं। AB की मोलर विलेयता AB2 की मोलर विलेयता –
(अ) के बराबर होगी।
(ब) से अधिक होगी
(स) से कम होगी
(द) में आपस कोई सम्बन्ध नहीं होता।
प्रश्न 5.
50 मिली. को धीरे – धीरे 10 मिली. विलयन में मिलाने पर प्राप्त मिश्रण की pH होगी –
(अ) 1
(ब) 5
(स) 7
(द) 10
उत्तरमाला:
1. (स)
2. (अ)
3. (ब)
4. (स)
5. (स)
RBSE Class 11 Chemistry Chapter 7 अतिलघूत्तरात्मक प्रश्न
प्रश्न 6.
निम्नलिखित में से प्रत्येक अभिक्रिया के लिए साम्य स्थिरांक Kc का व्यंजक लिखिए –
(i) 2NOCl (g) ⇌ 2NO (g) + Cl2 (g)
(ii) 2Cu(NO3)2 (s) ⇌ 2CuO (s) + 4NO2 (g) + O2 (g)
(iii) CH3COOC2H5 (aq) + H2O (l) ⇌ CH3COOH (aq) + C2H5OH (aq)
(iv) Fe3+(aq) + 3OH– (aq) ⇌ Fe(OH)3 (s)
(v) I2 (S) + 5F ⇌ 2IF5
उत्तर: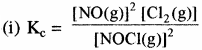

प्रश्न 7.
रासायनिक साम्य क्या है?
उत्तर:
जब कोई अभिक्रिया दोनों दिशाओं में चलती है एवं साम्य पर सभी अभिकारकों एवं उत्पादों की सान्द्रता स्थिर हो जाती है। तो उसे रासायनिक साम्य कहते हैं। साम्य पर मुक्त ऊर्जा परिवर्तन (ΔG) शून्य होता है। साम्य पर सभी मापने योग्य गुण, जैसे – रंग, घनत्व, सान्द्रता, ताप एवं दाब इत्यादि स्थिर हो जाते हैं।
प्रश्न 8.
ऐसी अभिक्रिया का उदाहरण दीजिए जिसमें –
(i) दाब बढ़ाने पर अधिक उत्पाद’ बनता हो।
(ii) ताप बढ़ाने से अधिक उत्पाद बनता हो।
उत्तर:![]()
इस साम्य पर दाब बढ़ाने पर अभिक्रिया अग्रिम दिशा में होती है। क्योंकि अग्रिम दिशा में कुल अणुओं की संख्या कम है अतः अमोनिया अधिक बनेगी।
(ii) N2 (gas) + O2 (gas) ⇌ 2NO (gas) (ΔH = 43.2 कि.कै.)
इस साम्य में अग्रिम अभिक्रिया ऊष्माशोषी है अतः NO2 की अधिक मात्रा बनाने के लिए अभिक्रिया को ऊष्मा की आवश्यकता होगी, अतः ताप बढ़ाने पर उत्पाद अधिक बनता है।
प्रश्न 9.
किसी गैसीय साम्य पर क्या होगा जबकि Δn का मान ऋणात्मक हो और दाब कम कर दिया जाये?
उत्तर:
N2 + 3H2 ⇌ 2NH3; Δn = 2 – 4 = – 2
यदि Δn का मान ऋणात्मक है तो दाब कम करने पर अभिक्रिया अग्रिम दिशा की ओर बढ़ेगी अर्थात् उत्पाद अधिक मात्रा में बनेगा।
प्रश्न 10.
हेबर विधि में अमोनिया की अधिकतम लब्धि हेतु किन शर्तों का होना आवश्यक है?
उत्तर:
N (गैस) + 3H2 (गैस) ⇌ 2NH3 (गैस); ΔH = – 93.6 kJ
अमोनिया की अधिकतम लब्धि के लिए –
- ताप कम होना चाहिए।
- दाब अधिक होना चाहिए।
- N2 एवं H2 की सान्द्रता बढ़ाने पर अमोनिया अधिक बनेगी।
- Fe/मोलीब्डेनम उत्प्रेरक काम में लेने पर अमोनिया अधिक बनेगी।
प्रश्न 11.
किसी पदार्थ के गलनांक बिन्दु पर उस पदार्थ की कौनसी दो अवस्थाएँ परस्पर साम्य में होती हैं?
उत्तर:
किसी पदार्थ के गलनांक बिन्दु पर ठोस एवं द्रव अवस्थाएँ साम्य में होती हैं।
प्रश्न 12.
किसी पदार्थ के क्वथनांक बिन्दु पर उस पदार्थ की कौनसी दो अवस्थाएँ परस्पर साम्य में होती हैं?
उत्तर:
क्वथनांक बिन्दु पर उसकी द्रव एवं वाष्प अवस्थाएँ साम्य में होती हैं। अथात् एक वायुमण्डलीय दाब पर किसी शुद्ध द्रव के लिए वह ताप जिस पर द्रव तथा उनकी वाष्प साम्यावस्था में होते हैं, उसे द्रव का क्वथनांक कहते हैं।
प्रश्न 13.
PCl5 के PCl3 और Cl2 में वियोजन की मात्रा यदि हो तो साम्यावस्था पर PCl5 की कितनी मोल मात्रा होगी?
उत्तर:
PCl5(g) ⇌ PCl3(g) + Cl2(g)
अतः साम्यावस्था पर PCl5 की (frac { a-{ x } }{ V } ) ग्राम मोल प्रति लीटर सान्द्रता होगी।
प्रश्न 14.
KCN लवण के लिए Kw, Kh तथा Ka में सम्बन्ध लिखिए।
उत्तर:
Kh × Ka = Kw
Kh = (frac { { K }_{ w } }{ { K }_{ a } } )
प्रश्न 15.
NH2– को संयुग्मी अम्ल बताइए।
उत्तर:
NH2– + H+ → NH2 (संयुग्मी अम्ल)
प्रश्न 16.
HCO3– का संयुग्मी क्षार बताइए।
उत्तर:
HCO3– – H+ → CO3-2 (संयुग्मी क्षार)
प्रश्न 17.
0.001N HCl की pH बताइए।
उत्तर:
[H+] = 0.001 = 10-3M
अतः pH = – log [H+]
= – log 10-3 = 3
प्रश्न 18.
विलयन में HCl की उपस्थिति H2S से आयनन पर क्या प्रभाव पड़ता है?
उत्तर:
सम आयन (H+) प्रभाव के कारण विलयन में HCl की विलेयता कम हो जाती है।
प्रश्न 19.
उत्क्रमणीय तथा अनुत्क्रमणीय अभिक्रियाएँ क्या हैं?
उत्तर:
वे अभिक्रियाएँ जो दोनों दिशाओं में होती हैं अर्थात् उत्पाद पुनः अभिक्रिया करके अभिकर्मकों का निर्माण करते हैं, उन्हें उत्क्रमणीय अभिक्रिया कहते हैं एवं जो एक ही दिशा में होती हैं अर्थात् उत्पाद से पुनः अभिकर्मक प्राप्त नहीं होते हैं, उन्हें अनुत्क्रमणीय अभिक्रिया कहते हैं।
प्रश्न 20.
साम्य NO (g) + O3 (g) ⇌ NO2 (g) + O2 (g) के लिए 10OOK पर Kc = 6.3 × 1014 है। साम्य में अग्र एवं प्रतीप दोनों अभिक्रियाएँ प्राथमिक रूप से द्विअणुक हैं। प्रतीप अभिक्रिया के लिए Kc क्या है?
उत्तर:
प्रतीप अभिक्रिया के लिए साम्य स्थिरांक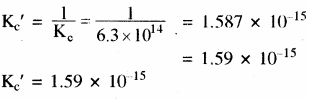
RBSE Class 11 Chemistry Chapter 7 लघूत्तरात्मक प्रश्न
प्रश्न 21.
निम्नलिखित में से दाब बढ़ाने पर कौन – कौनसी अभिक्रियाएँ प्रभावित होंगी? यह भी बताएँ कि दाब परिवर्तन करने पर अभिक्रिया अग्र या प्रतीप दिशा में गतिमान होगी?
- COCl2 (g) ⇌ CO (g) + Cl2 (g)
- CH4 (g) + 2S2 (g) ⇌ CS2 (g) + 2H2S (g)
- CO2 (g) + C (s) ⇌ 2CO (g)
- 2H2 (g) + CO (g) ⇌ CH3OH (g)
- CaCO3 (s) ⇌ CaO (s) + CO2 (g)
- 4NH3 (g) + 5O2 (g) ⇌ 4NO (g) + 6H2O (g)
उत्तर:
अभिक्रियाएँ जिनमें Δn(g) = 0 नहीं है अर्थात् गैसीय उत्पादों तथा गैसीय अभिकारकों के मोलों की संख्या समान नहीं है, उनमें दाब बढ़ाने पर अभिक्रियाएँ प्रभावित होंगी। अतः अभिक्रिया (i), (iii), (iv), (v) तथा (vi) प्रभावित होगी। ला-शातेलिए के सिद्धान्त के अनुसार साम्य पर दाब बढ़ाने से अभिक्रिया उस दिशा में जाती है जिधर गैसीय पदार्थ कम हो।
- Δn(g) = + 1 अतः अभिक्रिया प्रतीप दिशा में गतिमान होगी।
- Δn(g) = 0 अभिक्रिया पर दाब का कोई प्रभाव नहीं होगा।
- Δn = + 1 अभिक्रिया प्रतीप दिशा में गतिमान होगी।
- Δn = – 2 अभिक्रिया अग्र दिशा में गतिमान होगी।
- Δn = + 1 अभिक्रिया प्रतीप दिशा में गतिमान होगी।
- Δn = + 1 अभिक्रिया प्रतीप दिशा में गतिमान होगी।
प्रश्न 22.
रासायनिक साम्य को प्रभावित करने वाले कारकों की विवेचना कीजिए।
उत्तर:
रासायनिक साम्य निम्न भौतिक अवस्थाओं पर निर्भर करता है –
- सान्द्रता
- ताप
- दाब
- उत्प्रेरक।
1. सान्द्रता:
साम्यावस्था में क्रियाकारकों की सान्द्रता में वृद्धि करने पर अग्र अभिक्रिया के वेग में वृद्धि होती है तथा उत्पाद अधिक मात्रा में प्राप्त होता है एवं उत्पाद की सान्द्रता में वृद्धि करने पर प्रतीप अभिक्रिया के वेग में वृद्धि होती है।
2. ताप:
ऊष्माक्षेपी अभिक्रियाओं में ताप बढ़ाने पर प्रतीप अभिक्रिया का वेग बढ़ता है। अतः Kc का मान कम होगा; एवं ऊष्माक्षेपी अभिक्रिया में ताप बढ़ाने पर अग्र अभिक्रिया के वेग में वृद्धि होती है एवं Kc के मान में वृद्धि होती है।
3. दाब:
यदि Δn = 0 तो दाब का कोई प्रभाव नहीं होता है। Δn = +ve होने पर दाब बढ़ाने पर अभिक्रिया प्रतीप दिशा में एवं Δn = -ve होने पर दाब बढ़ाने पर अग्र अभिक्रिया के वेग में वृद्धि होती है।
4. उत्प्रेरक:
साम्यावस्था पर उत्प्रेरक का कोई प्रभाव नहीं होता है क्योंकि उत्प्रेरक अग्र एवं प्रतीप दोनों अभिक्रियाओं के वेग को समान रूप से बढ़ाता है।
प्रश्न 23.
SO3 का संश्लेषण किन – किन परिस्थितियों में अधिक होगा? विवरण दीजिए।
उत्तर:
2SO2 + O2 ⇌ 2SO3 ;ΔH = – 45 Kcal
- कुल अणुओं की संख्या में कमी होती है अतः दाब बढ़ाने पर SO3 का संश्लेषण अधिक होगा।
- यह अभिक्रिया ऊष्माक्षेपी है अतः ताप कम करने पर SO3 अधिक मात्रा में बनेगी।
- SO2 एवं O2 की सान्द्रता बढ़ाने पर SO3 का संश्लेषण अधिक मात्रा में होगा।
- प्लेटिनम या V2O5 उत्प्रेरक की उपस्थिति में अभिक्रिया का वेग बढ़ जाता है।
प्रश्न 24.
अमोनिया के संश्लेषण का साम्य N2 + 3H2 ⇌ 2NH3 + X किलो जूल है। इस साम्य पर ताप, दाब एवं सान्द्रता के प्रभाव की व्याख्या कीजिए।
उत्तर:
- ताप:
इस अभिक्रिया में ताप बढ़ाने पर अभिक्रिया प्रतीप दिशा की ओर बढ़ेगी अर्थात् NH3 का संश्लेषण कम होगा एवं यदि ताप कम करते हैं तो अभिक्रिया अग्र दिशा में बढ़ेगी अर्थात् अमोनिया का संश्लेषण अधिक मात्रा में होगा। - दाब:
इस अभिक्रिया में Δn का मान – 2 है अतः दाब बढ़ाने पर अभिक्रिया अग्र दिशा की ओर गमन करेगी अर्थात् NH3 का संश्लेषण अधिक होगा एवं दाब कम करने पर अभिक्रिया प्रतीप दिशा की ओर गमन करेगी अर्थात् अमोनिया का संश्लेषण कम होगा एवं पुनः N2 एवं H2 की मात्रा बढ़ेगी। - सान्द्रता:
N2 एवं H2 की सान्द्रता में वृद्धि करने पर अभिक्रिया अग्रिम दिशा की ओर बढ़ेगी अर्थात् NH3 का संश्लेषण अधिक होगा।
प्रश्न 25.
लुइस अवधारणा के अनुसार निम्न में से अम्ल – क्षार छाँटिये –
S2-, H+, OH–, BF3, Ni+2, F–
उत्तर:
लुइस के अनुसार वे पदार्थ (अणु, आयन या मूलक) जो असहभाजित इलेक्ट्रॉन युग्म या एकाकी इलेक्ट्रॉन युग्म को स्वीकार कर उपसहसंयोजक बन्ध बनाने की स्थिति में होते हैं, लुइस अम्ल कहलाते हैं; एवं जो असहभाजित इलेक्ट्रॉन युग्म को दान करके उपसहसंयोजक बन्ध बना सकते हैं, लुइस क्षार कहलाते हैं।
लुइस अम्ल – H+, Ni+2, BF3
लुइस क्षार – S2-, OH–, F–
H+, Ni+2 आयन के पास रिक्त कक्षक होते हैं अतः वे इलेक्ट्रॉन युग्म ग्रहण कर सकते हैं। BF3 में अष्टक अपूर्ण होता है अतः इलेक्ट्रॉन ग्रहण कर सकते हैं।
S2-, OH–, F– आयन में एकांकी इलेक्ट्रॉन युग्म होते हैं अतः इनमें इलेक्ट्रॉन युग्म देने की प्रवृत्ति होती है।
प्रश्न 26.
निम्न के संयुग्मी अम्ल लिखिए –
S-2, NH3, H2PO4–, CH3NH2
उत्तर:
HS–, NH4+, H3PO4, CH3(overset { + }{ N } )H3
प्रश्न 27.
आयनन को प्रभावित करने वाले कोई तीन कारक लिखिए।
उत्तर:
वह प्रक्रिया जिसमें उदासीन अणु को जल में घोलने पर वह आवेशित आयनों में विभक्त हो जाता है, उसे आयनन कहते हैं।
- आयनन की मात्रा विद्युत अपघट्य में उपस्थित बन्धों की सामर्थ्य
- आयनों के जलयोजन की मात्रा पर
- ताप, विलायक की प्रकृति एवं तनुता पर
ताप व तनुता बढ़ाने पर आयनन की मात्रा बढ़ती है तथा विलायक की ध्रुवता बढ़ने पर भी आयनन की मात्रा में वृद्धि होती है।
प्रश्न 28.
साधारण नमक के संतृप्त विलयन में अवक्षेपण हेतु HCl गैस मिलायी जाती है, HCl अम्ल नहीं। कारण स्पष्ट कीजिए।
उत्तर:
साधारण नमक के संतृप्त विलयन में HCl गैस प्रवाहित की जाती है तो इसके आयनन से Cl– आयन प्राप्त होते हैं।
NaCl ⇌ Na+ + Cl– साधारण नमक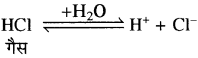
जिससे Cl– की सान्द्रता बढ़ जाती है अतः Na+ तथा Cl– का आयनिक गुणनफल, NaCl के विलेयता गुणनफल (Ksp) से अधिक हो जाता है, जिससे साधारण नमक के संतृप्त विलयन में अवक्षेपण हो जाता है। परन्तु HCl अम्ल का HCl गैस की अपेक्षा आयनन बहुत ही कम होता है, जिससे Cl– की सान्द्रता नहीं बढ़ पाती है।
प्रश्न 29.
प्रबल अम्ल तथा दुर्बल क्षार से बने लवण विलयन का Kh तथा [H+] सान्द्रता ज्ञात करने का सूत्र व्युत्पन्न कीजिए।
उत्तर: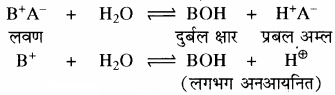
दुर्बल क्षारक (BOH) विलयन में लगभग अनआयनित रहता है। इसके कारण विलयन में H+ आयन की सान्द्रता बढ़ जाती है, जिससे विलयन अम्लीय हो जाता है।
साम्य स्थिरांक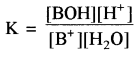
चूँकि [H2O] = लगभग स्थिर
अतः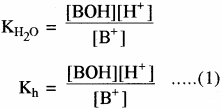
Kh = जल अपघटन स्थिरांक
विलयन में उपस्थित दुर्बल क्षार का अति अल्प आयनन निम्न प्रकार होता है –
BOH ⇌ B+ + OH–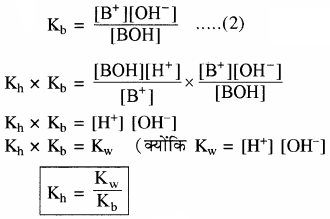
जल अपघटन की मात्रा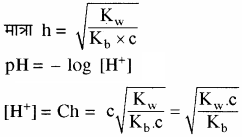
प्रश्न 30.
Mg(OH)2, NH4Cl में विलेय है जबकि NaCl में अविलेय, कारण बताइए।
उत्तर:
Mg(OH)2 के अवक्षेप में NH4Cl विलयन मिलाने पर NH4OH बनता है जो कि दुर्बल क्षार होता है।
Mg(OH)2 + 2NH4Cl → MgCl2 + 2NH4OH
जिसका आयनन कम होता है। अतः OH– कम मिलेंगे इसलिए [OH–] पहले की तुलना में कम हो जाएगी तथा [Mg+2] व [OH–] का गुणनफल Mg(OH)2 के Ksp से कम हो जाएगा, इस कारण Mg(OH)2 घुल जाएगा।
जबकि इसमें NaCl विलयन मिलाने पर NaOH बनता है।
Mg(OH)2 + 2NaCl + 2NaOH + MgCl2
NaOH प्रबल क्षार है, अतः इसका पुनः आयनन होकर यह OH दे देता है। अतः [OH–] पर कोई प्रभाव नहीं पड़ता। अतः Mg(OH)2 का अवक्षेप ही रहेगा अर्थात् यह विलेय नहीं होगा।
प्रश्न 31.
प्रयोग द्वारा कैसे सिद्ध करेंगे कि रासायनिक साम्य एक गतिक साम्य है?
उत्तर:
रासायनिक साम्य की गतिक प्रकृति का प्रायोगिक सत्यापन – रासायनिक साम्य की गतिक प्रकृति का प्रायोगिक सत्यापन अमोनिया के संश्लेषण (हाबर विधि) द्वारा किया जा सकता है। हाबर ने उच्च ताप तथा दाब पर नाइट्रोजन तथा हाइड्रोजन की विभिन्न ज्ञात मात्राओं के साथ अभिक्रिया कराकर नियमित समय अंतराल पर बनी अमोनिया की मात्रा ज्ञात की। इसके आधार पर उन्होंने अभिक्रिया में शेष बची नाइट्रोजन तथा हाइड्रोजन की सांद्रता ज्ञात की। आगे दिया गया चित्र यह दर्शाता है कि एक निश्चित समय के पश्चात् कुछ अभिकारकों के शेष बचने पर भी अमोनिया की सान्द्रता तथा मिश्रण का संघटन वही रहता है। मिश्रण के संघटन की स्थिरता से यह ज्ञात होता है। कि साम्यावस्था स्थापित हो गई है।
इसके पश्चात् अभिक्रिया की गतिक प्रकृति को समझने के लिए उपरोक्त प्रयोग को H2 के स्थान पर D2 (ड्यूटीरियम) लेकर दोहराया तो यह पाया कि साम्यावस्था पर समान संघटन वाली अभिक्रिया मिश्रण प्राप्त होता है लेकिन अभिक्रिया मिश्रण में H2 व NH3 के स्थान पर D2 तथा ND3 पायी जाती हैं।|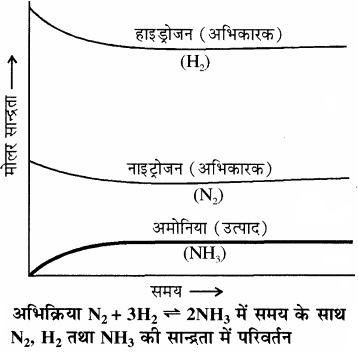
साम्यावस्था स्थापित होने के पश्चात् दोनों प्रयोगों के मिश्रण (जिसमें H2, N2, NH3, तथा D2, N2, ND3, होते हैं) को आपस में मिलाकर कुछ समय के लिए छोड़ दिया जाता है तथा जब इस मिश्रण का विश्लेषण करते हैं तो ज्ञात होता है कि अमोनिया की सांद्रता अपरिवर्तित रहती है। जब इस मिश्रण का द्रव्यमान स्पेक्ट्रोमीटर द्वारा विश्लेषण किया जाता है तो इसमें ड्यूटीरियम युक्त विभिन्न प्रकार के अमोनिया अणु (NH3, NH2D, NHD2 तथा ND3) तथा हाइड्रोजन अणु (H2, HD तथा D2) पाए जाते हैं। इससे यह निष्कर्ष निकलता है कि साम्यावस्था के पश्चात् भी मिश्रण में अंग्र तथा पश्च अभिक्रियाएँ चलती रहती हैं। जिनके कारण अणुओं में H तथा D परमाणुओं का विनिमय हो जाता है। साम्यावस्था स्थापित होने के बाद यदि अभिक्रिया समाप्त हो जाती, तो इस प्रकार का मिश्रण प्राप्त होना संभव नहीं होता।
अतः इस प्रयोग में D2 के प्रयोग से यह स्पष्ट हो जाता है कि रासायनिक अभिक्रियाओं में गतिक साम्यावस्था स्थापित होने पर अग्र तथा पश्च अभिक्रियाओं की दर समान होती है तथा साम्य मिश्रण का संघटन अपरिवर्तित रहता है।
प्रश्न 32.
निम्न समांगी अभिक्रिया के लिए सान्द्रता साम्य स्थिरांक Kc तथा दाब साम्य स्थिरांक Kp में सम्बन्ध स्थापित कीजिए
4NH3 (g) + 5O2 (g) ⇌ 4NO (g) + 6H2O (g)
उत्तर:
Kp = Kc (RT)Δn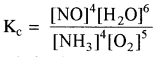
Δn = गैसीय उत्पादों के मोलों की संख्या – गैसीय अभिकारकों के मोलों की संख्या
Δn = 10 – 9 = + 1
Kp = Kc(RT)1
Kp > Kc
प्रश्न 33.
द्रव अनुपाती क्रिया के नियम को निम्न साम्य पर अनुप्रयोग करके समझाइए –
CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O
उत्तर:
द्रव्य अनुपाती क्रिया के नियमानुसार
अग्र अभिक्रिया का वेग
ri ∝ [CH3COOH] [C2H5OH]
rf = K1[CH3COOH] [C2H5OH]
rf = अग्र अभिक्रिया का वेग नियतांक
rb ∝ [CH3COOC2H5] [H2O]
rb = K2[CH3COOC2H5] [H2O]
rb = पश्च अभिक्रिया का वेग नियतांक साम्य पर
rf = rb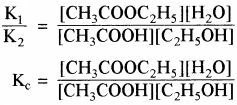
प्रश्न 34.
निकाय N2 + O2 ⇌ 2NO – 44 कि.कै. की साम्यावस्था पर निम्न का क्या प्रभाव पड़ेगा –
- ताप बढ़ाने पर
- दाब घटाने.का
- NO की अधिक सान्द्रता का
- उत्प्रेरक की उपस्थिति का।
उत्तर:
- यह अभिक्रिया ऊष्माशोषी है अतः ताप बढ़ाने पर अभिक्रिया अग्र दिशा की ओर बढ़ेगी अर्थात् NO अधिक मात्रा में बनेगा एवं ताप कम करने पर अभिक्रिया प्रतीप दिशा की ओर जायेगी अर्थात् N2 एवं O2 की मात्रा अधिक मात्रा में बनेगी।
- इस अभिक्रिया में उत्पाद एवं क्रियाकारक अणुओं की मात्रा समान है अर्थात् Δn = 0 अतः इस अभिक्रिया पर दाब का किसी भी प्रकार प्रभाव नहीं पड़ता है।
- उपरोक्त साम्य पर NO की सान्द्रता बढ़ाने पर अभिक्रिया प्रतीप दिशा की ओर अग्रसर होगी अर्थात् N2 एवं O2 की सान्द्रता बढ़ेगी एवं NO की सान्द्रता कम करने पर अभिक्रिया अग्र दिशा की ओर जायेगी अर्थात् NO की मात्रा बढ़ेगी।
प्रश्न 35.
N2 + 3H2 ⇌ 2NH3 अभिक्रिया में साम्य ताप व दाब द्वारा किस प्रकार प्रभावित होता है?
उत्तर:
N2 (g) + 3H2 (g) ⇌ 2NH3 (g) Δn = – 92.38 kJ/M
यह ऊष्माक्षेपी अभिक्रिया है अतः NH3 के निर्माण में ताप कम करने पर NH3 अधिक बनेगी एवं ताप बढ़ाने पर अभिक्रिया प्रतीप दिशा में होगी अर्थात् NH3 कम बनेगी।
Δn = 2 – 4 = – 2
यहाँ Δn का मान – ve है अतः दाब बढ़ाने पर अभिक्रिया अग्र दिशा में होगी जिससे NH3 अधिक बनेगी।
RBSE Class 11 Chemistry Chapter 7 निबन्धात्मक प्रश्न
प्रश्न 36.
(i) भौतिक प्रक्रमों एवं रासायनिक प्रक्रमों में साम्य को उदाहरण सहित समझाइए।
उत्तर:
भौतिक प्रक्रमों में साम्य:
जब किसी अभिक्रिया में केवल पदार्थ की भौतिक अवस्था बदलती है, तो इसे भौतिक प्रक्रम कहते हैं तथा इस प्रकार के प्रक्रम में जब साम्य स्थापित होता है तो इसे भौतिक साम्य कहा जाता है।
भौतिक प्रक्रमों के अध्ययन द्वारा साम्यावस्था में किसी निकाय के लक्षणों को अच्छी तरह समझा जा सकता है। अग्रलिखित प्रावस्था रूपान्तरण प्रक्रम इनके मुख्य उदाहरण हैं जो कि निम्न हैं –
ठोस ⇌ द्रव
द्रव ⇌ गैस
ठोस ⇌ गैस
ठोस – द्रव साम्यावस्था:
बर्फ का जल में बदलना ठोस-द्रव साम्यावस्था का एक महत्त्वपूर्ण उदाहरण है।
जब हम थर्मस फ्लास्क (विलगित निकाय) में रखे बर्फ तथा जल का अध्ययन करते हैं तो यह पाया जाता है कि 273 K ताप तथा एक वायुमण्डलीय दाब पर बर्फ तथा जल साम्यावस्था में होते हैं। 273 K बर्फ का गलनांक तथा जल का हिमांक है। इससे स्पष्ट है कि बर्फ तथा जल एक निश्चित ताप तथा दाब पर ही साम्यावस्था में होते हैं। साम्य पर समय के साथ-साथ बर्फ व जल के द्रव्यमान में कोई परिवर्तन नहीं होता है क्योंकि साम्य पर बर्फ से जल के बनने की दर तथा जल से बर्फ के बनने की दर समान होती है अर्थात् यह साम्यावस्था स्थैतिक (Static) नहीं है। इस समय जल के कुछ अणु बर्फ से टकराकर उसमें समा जाते हैं तथा बर्फ के कुछ अणु जल की तरफ चले जाते हैं।
गलनांक या हिमांक:
एक वायुमण्डलीय दाब पर किसी शुद्ध पदार्थ का वह ताप, जिस पर उसकी ठोस द्रव एवं द्रव प्रावस्थाएँ साम्यावस्था में होती हैं, उसे पदार्थ का ‘मानक गलनांक’ या ‘मानक हिमांक’ कहते हैं। निकाय के दाब में परिवर्तन करने से पदार्थ के गलनांक में भी थोड़ा परिवर्तन होता है।
द्रव – वाष्प साम्यावस्था:
द्रव – वाष्प साम्यावस्था को समझने के लिए जल तथा वाष्प के मध्य साम्य का उदाहरण लेते हैं। इसे निम्न प्रयोग के द्वारा समझाया जा सकता है –![]()
एक पारे से भरी U आकार की नली (मैनोमीटर) को एक काँच के बॉक्स में जोड़ दिया जाता है। बॉक्स में एक वाच ग्लास में जलशोषक (निर्जल CaCl2 या P2O5) रखकर बॉक्स की वायु को सुखा लेते हैं। फिर इस बॉक्स में जलयुक्त वाच ग्लास रख देते हैं तो कुछ समय पश्चात् मैनोमीटर की दायीं तरफ की भुजा में पारा बढ़ने लगता है तथा अन्त में स्थिर हो जाता है तथा वाच ग्लास में रखे जल का आयतन भी कम हो जाता है। इससे सिद्ध होता है कि बॉक्स में पहले दाब बढ़ता है तथा फिर स्थिर हो जाता है। क्योंकि जल के वाष्पन से गैसीय प्रावस्था में अणुओं की संख्या बढ़ जाती है। लेकिन कुछ समय पश्चात् साम्य स्थापित हो जाता है।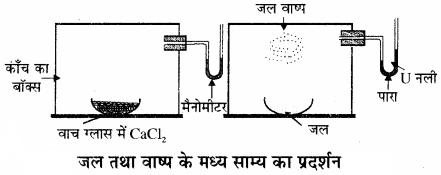
प्रारम्भ में वाष्पन की दर अधिक होती है तथा संघनन की दर कम होती है लेकिन समय के साथ-साथ वाष्पन की दर कम होती जाती है। तथा संघनन की दर बढ़ती जाती है लेकिन साम्य पर वाष्पन की दर तथा संघनन की दर समान हो जाती है। अतः साम्य पर किसी द्रव द्वारा उत्पन्न दाब निश्चित ताप पर स्थिर होता है, इसे उस द्रव का वाष्प दाब या जल का साम्य वाष्प दाब भी कहते हैं। ताप बढ़ाने पर वाष्पन की दर बढ़ती है अतः वाष्प दाब भी बढ़ता है। भिन्न-भिन्न द्रवों को वाष्प दाब भिन्न – भिन्न होता है। जल तथा वाष्प एक वायुमण्डलीय दाब (1.013 bar) तथा 100°C पर साम्य में होते हैं अतः 100°C जल का क्वथनांक है।
क्वथनांक:
एक वायुमण्डलीय दाब पर किसी शुद्ध द्रव का वह ताप जिस पर द्रव तथा उसकी वाष्प साम्यावस्था में होते हैं, उसे द्रव का क्वथनांक कहते हैं। किसी द्रव का क्वथनांक वायुमण्डलीय दाब पर निर्भर करता है। पहाड़ों पर वायुमण्डलीय दाब कम होता है। अतः वहाँ पर द्रवों का क्वथनांक भी कम हो जाता है। उपरोक्त प्रयोग को जल के स्थान पर ऐसीटोन या एथिल ऐल्कोहॉल की भिन्न – भिन्न मात्राएं लेकर खुले पात्र में किया जाता है तो हम पाते हैं कि द्रवों का वाष्पन निम्न कारकों पर निर्भर करता है –
- द्रव की प्रकृति
- द्रव की मात्रा तथा
- ताप
पात्र खुला होने के कारण द्रव का वाष्पन तो होता है लेकिन संघनन बहुत कम होता है अतः सम्पूर्ण द्रव वाष्पित हो जाता है। यह एक खुला निकाय है अतः इसमें साम्यावस्था स्थापित नहीं होती है। जिस द्रव का वाष्प दाब अधिक होता है वह अधिक वाष्पशील होता है अतः उसका क्वथनांक कम होता है।
ठोस – वाष्प साम्यावस्था:
जब कोई ठोस सीधे ही वाष्प अवस्था में परिवर्तित हो जाता है तो इस प्रक्रम को ऊर्ध्वपातन कहते हैं तथा इस प्रकार के ठोसों को। ऊर्ध्वपाती पदार्थ कहते हैं। जैसे – आयोडीन, कपूर तथा अमोनियम क्लोराइड (NH4Cl)। ठोस – वाष्प साम्यावस्था को समझने के लिए हम आयोडीन का उदाहरण लेते हैं। जब आयोडीन को एक बंद पात्र में रखते हैं तो कुछ समय पश्चात् यह पात्र बैंगनी रंग की वाष्प से भर जाता है तथा समय के साथ – साथ बैंगनी रंग की तीव्रता में वृद्धि होती है। लेकिन कुछ समय के पश्चात् रंग की तीव्रता स्थिर हो जाती है। इस स्थिति में ठोस आयोडीन तथा आयोडीन वाष्प में साम्यावस्था स्थापित हो जाती है।
I2 (ठोस) = I2 (वाष्प)।
साम्य पर I2 (ठोस) से 1) (वाष्प) को बनना तथा इसका विपरीत प्रक्रम समान दर से होता है। अतः बैंगनी रंग (I2 की वाष्प) की तीव्रता स्थिर हो जाती है।
द्रव में ठोस या गैस की घुलनशीलता सम्बन्धी साम्य:
- द्रवों में ठोस:
सामान्य ताप पर विलायक की निश्चित मात्रा में किसी विलेय की सीमित मात्रा ही घुलती है। जैसे जल की निश्चित मात्रा में साधारण लवण (NaCl) या शर्करा को घोलें तो इनकी एक निश्चित मात्रा ही जल में घुलेगी तथा यदि ताप बढ़ाकर चीनी की अधिक मात्रा को जल में घोल लिया जाता है (चाशनी बनाना) तो विलयन को ठंडा करने पर शर्करा के क्रिस्टल पृथक् हो जाते हैं।
निश्चित ताप पर किसी विलयन में यदि और अधिक विलेय न घुल सके, तो इस प्रकार के विलयन को संतृप्त विलयन (Saturated Solution) कहते हैं। संतृप्त विलयन में ठोस अवस्था तथा विलयन में उपस्थित विलेय के कणों के मध्य एक गतिक साम्य होता है।
उदाहरण:
शर्करा का विलयन ⇌ ठोस शर्करा
साम्यावस्था पर शर्करा के घुलने की दर = शर्करा के क्रिस्टलन की दर साम्य पर अग्र तथा पश्च अभिक्रियाओं की समान दरों तथा गतिक साम्य का प्रायोगिक सत्यापन रेडियोऐक्टिव शर्करा की सहायता से किया जा सकता है। - द्रवों में गैसें:
जब किसी द्रव में दाब के साथ किसी गैस को प्रवाहित किया जाता है तो गैस की कुछ मात्रा, द्रव में विलेय हो जाती है। किसी द्रव में घुलने वाली गैस की मात्रा विभिन्न कारकों पर निर्भर करती है।
उदाहरण:
सोडावाटर की बोतल में CO2 गैस को अधिक दाब के साथ सीलबन्द किया जाता है तो गैस के बहुत से अणु द्रव में घुल जाते हैं, जैसे ही यह बोतल खोली जाती है वैसे ही बोतल के द्रव की सतह पर गैस का दाब अचानक कम हो जाता है जिससे जल में घुली हुई CO2 गैस तेजी से बाहर निकलती है तथा कुछ समय में सारी गैस बाहर निकल जाती है अर्थात् भिन्न – भिन्न दाबों पर गैसों की विलेयता भिन्न होती है तथा निश्चित ताप व दाब पर अविलेय गैस तथा द्रव में विलेय गैस के मध्य साम्य स्थापित हो जाता है।
CO2 (g) = CO2 (solution)
दिए गए ताप पर किसी द्रव में गैस की विलेयता को हेनरी के नियम द्वारा व्यक्त किया जाता है, जिसके अनुसार निश्चित ताप पर विलायक की दी गई मात्रा में, घुली हुई गैस की मात्रा, विलायक के ऊपर गैस के दाब के समानुपाती होती है। ताप के बढ़ने पर यह मात्रा कम होती जाती है।
अर्थात् m α p
m = kp
k = हेनरी नियतांक
m = घुली हुई गैस की मात्रा
p = गैस का दाब
उपरोक्त सभी भौतिक साम्यों के आधार पर यह निष्कर्ष प्राप्त होता है कि –
- ठोस ⇌ द्रव, साम्यावस्था के लिए एक वायुमण्डलीय दाब पर ताप का एक मान (गलनांक) ऐसा होता है, जिस पर दोनों प्रावस्थाएँ पाई जाती हैं। यदि परिवेश से ऊष्मा का विनिमय न हो, तो साम्य पर दोनों प्रावस्थाओं के द्रव्यमान स्थिर होते हैं।
- वाष्प ⇌ द्रव, साम्यावस्था के लिए किसी निश्चित ताप पर द्रव का वाष्प – दाब स्थिर होता है।
- निश्चित ताप पर किसी द्रव में ठोस की विलेयता निश्चित होती है तथा यह साम्य केवल संतृप्त विलयन में ही स्थापित होता है।
- द्रव में किसी गैस की विलेयता द्रव के ऊपर उस गैस के दाब के समानुपाती होती है।
रासायनिक प्रक्रमों में साम्य:
रासायनिक साम्य ताप, दाब, क्रियाकारकों एवं क्रियाफलों की सान्द्रता एवं अन्य पदार्थों की उपस्थिति पर निर्भर करता है। साम्यावस्था में ये सभी कारक स्थिर रहते हैं। यदि इनमें से किसी भी कारक में थोड़ा सा परिवर्तन कर दिया जाये तो साम्यावस्था भी परिवर्तित हो जाती है। इससे अग्रिम या प्रतीप दोनों में से एक अभिक्रिया की गति बढ़ जाती है। एवं परिवर्तित दिशा में नयी साम्यावस्था स्थापित हो जाती है। इससे ऐसा लगता है कि साम्य एक स्थिति से दूसरी स्थिति की ओर अग्रसर हो जाता है।
H2 (g) + I2 ⇌ 2HI (g)
इस अभिक्रिया की साम्यावस्था में रेडियोधर्मी आयोडीन का Isotope मिलाने पर कुछ समय के बाद HI में रेडियोधर्मी आयोडीन की उपस्थिति हो जाती है। H2, I2, एवं HI की आपेक्षित सान्द्रताओं में कोई परिवर्तन नहीं होता है, जिससे स्पष्ट होता है कि अभिक्रिया दोनों दिशाओं में समान दर से हो रही है। रेडियोधर्मी आयोडीनयुक्त HI का बनना अग्रिम दिशा को स्पष्ट करता है परन्तु आपेक्षित सान्द्रताओं का समान रहना अभिक्रिया का समान दर से प्रतीप दिशा में होने को स्पष्ट करता है। अतः रासायनिक साम्य एक गतिक साम्य है। रासायनिक प्रक्रमों में साम्यावस्था को समझने के लिए निम्नलिखित उत्क्रमणीय अभिक्रिया पर विचार करते हैं –
A + B ⇌ C + D
प्रारम्भ में अभिकारकों (A तथा B ) की सान्द्रता अधिकतम होती है जबकि उत्पादों (C तथा D ) की सान्द्रता शून्य होती है। अतः अग्र अभिक्रिया की दर उच्चतम तथा पश्च अभिक्रिया की दर निम्नतम है। क्योंकि अभिक्रिया की दर सान्द्रता के समानुपाती होती है। समय बीतने के साथ – साथ अभिकारकों (A तथा B ) की सान्द्रता घटती जाती है तथा उत्पादों (C तथा D ) की सान्द्रता बढ़ती जाती है। अतः अग्र अभिक्रिया की दर घटती है और प्रतीप अभिक्रिया की दर बढ़ती है तथा एक स्थिति ऐसी आती है, जब अग्र तथा पश्च अभिक्रियाओं की दर समान हो जाती है। इसे साम्यावस्था की स्थिति कहते हैं।
भौतिक साम्य की तरह रासायनिक साम्य भी गतिक होता है। साम्य पर अभिक्रिया रुक गई प्रतीत होती है क्योंकि जिस दर से अभिकारक उत्पादों में परिवर्तित होते हैं, ठीक उसी दर से उत्पाद भी अभिकारकों में परिवर्तित हो जाते हैं जबकि वास्तव में अभिक्रिया रुकती नहीं है। इस साम्यावस्था को C तथा D के बीच अभिक्रिया कराकर भी प्राप्त किया जा सकता है।
C + D ⇌ A+ B
समय के साथ अभिकारकों एवं उत्पादों की सान्द्रता में परिवर्तन को अग्र प्रकार दर्शाया जा सकता है –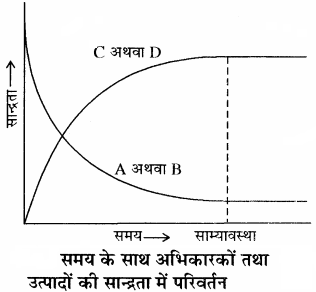
किसी अभिक्रिया में साम्यावस्था प्राप्त होने को निम्नलिखित ग्राफ द्वारा दर्शाया जाता है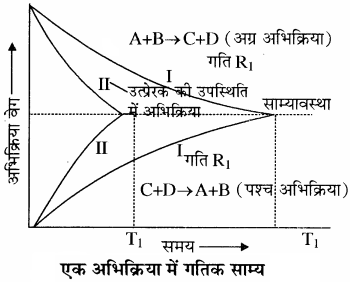
(ii) सिद्ध कीजिए कि PCl5 के वियोजन की मात्रा दाब के वर्गमूल के व्युत्क्रमानुपाती होती है।
उत्तर:
PCl5 के वियोजन:
वे समांगी अभिक्रिया जिनमें Δn का मान धनात्मक हो – फास्फोरस पेन्टा क्लोराइड का वियोजन –
PCl5 ⇌ PCl3 + Cl2
यदि PCl5 की प्रारम्भिक सान्द्रता a ग्राम मोल है एवं साम्यावस्था में इसके x ग्राम मोल वियोजित हो जाते हैं। PCl5 का एक ग्राम अणु वियोजित होकर एक ग्राम अणु PCl5 एवं एक ग्राम अणु Cl2 बनता है अतः इसके x ग्राम मोल वियोजित होकर x ग्राम PCl3 मोल एवं x ग्राम मोल Cl2 बनते हैं। यदि उपरोक्त अभिक्रिया V लीटर के पात्र में करवाते हैं तो साम्यावस्था पर
PCl5 ⇌ PCl3 + Cl2
द्रव्य अनुपाती क्रिया के नियमानुसार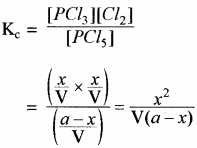
Kp का मान ज्ञात करना –
इस साम्य के लिए Kp का मान Kc से अधिक होता है।
PCl5 ⇌ PCl3 + Cl2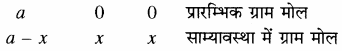
साम्यावस्था में ग्राम मोल साम्यावस्था मिश्रण में कुल ग्राम मोलों की संख्या
= (a – x) + x + x = (a + x)
यदि अभिक्रिया मिश्रण का कुल दाब P हो तो, क्रियाकारकों व उत्पादों के आंशिक दाब निम्न प्रकार ज्ञात कर सकते हैं –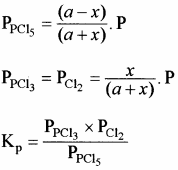
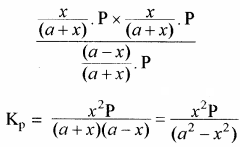
यदि PCl5 का वियोजन 1 ग्राम मोल से प्रारम्भ करें तो साम्यावस्था पर वियोजित ग्राम मोलों की संख्या ४ वियोजन की मात्रा कहलाती है अर्थात् Kc एवं Kp के व्यंजकों में a = 1 रखने पर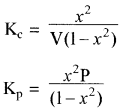
साम्यावस्था पर विभिन्न कारकों का प्रभाव:
- दाब का प्रभाव:
माना x<<< 1 हो तो Kp के व्यंजक में x2 की उपेक्षा की जा सकती है अर्थात् (1 – x2) ≃ 1
Kp = x2P
या
अतः वियोजन की मात्रा (x) दाब के वर्गमूल के व्युत्क्रमानुपाती होती है अर्थात् दाब बढ़ाने पर वियोजन की मात्रा (x) कम होगी एवं अभिक्रिया प्रतीप दिशा में गमन करेगी। - सान्द्रता का प्रभाव:
साम्यावस्था में क्रियाकारक पदार्थों की सान्द्रता बढ़ाने पर Kc का मान स्थिर रखने के लिए उत्पादों की सान्द्रता भी बढ़ेगी एवं अभिक्रिया अग्र दिशा में गमन करेगी। इसी प्रकार उत्पादों की सान्द्रता बढ़ाने पर अभिक्रिया प्रतीप दिशा में गमन करेगी क्योंकि Kc का मान स्थिर रखने के लिए क्रियाकारकों की सान्द्रता भी बढ़ेगी। - ताप का प्रभाव:
PCl5 के वियोजन में ऊष्मा अवशोषित होती है अतः ताप बढ़ाने पर साम्य स्थिरांक Kc का मान बढ़ता है, जिससे साम्य अग्र दिशा में गमन करता है अर्थात् PCl5 का अधिक वियोजन होता है। - अक्रिय गैस के मिलाने का प्रभाव:
PCl5 के वियोजन में साम्यावस्था पर अक्रिय गैस स्थिर आयतन पर मिलाने पर साम्य मिश्रण पर दाब बढ़ जाता है एवं वियोजन की मात्रा कम हो जाती है। स्थिर दाब पर अक्रिय गैस मिलाने पर साम्य मिश्रण का कुल आयतन बढ़ जाता है एवं वियोजन की मात्रा बढ़ जाती है।
प्रश्न 37.
बफर विलयन किसे कहते हैं? बफर विलयन की कोई दो विशेषताएँ लिखिए। अम्लीय बफर विलयन की pH ज्ञात करने का सूत्र व्युत्पन्न कीजिए। साधारण बफर विलयन के कोई दो उदाहरण दीजिए।
उत्तर:
बफर विलयन:
सामान्यतया किसी विलयन में प्रबल अम्ल मिलाने पर pH में कमी आती है तथा प्रबल क्षार मिलाने पर pH बढ़ती है लेकिन वह विलयन, जिनका pH तनु करने अथवा अम्ल या क्षारक की कुछ मात्रा मिलाने के बाद भी अपरिवर्तित रहता है, उसे बफर विलयन कहते हैं।
अतः बफर विलयन, pH में परिवर्तन का प्रतिरोध करता है। इस क्रिया को बफर क्रिया कहते हैं। बफर विलयन दो प्रकार के होते हैं –
(i) मिश्रित बफर विलयन
(ii) सरल बफर विलयन।
मिश्रित बफर को पुनः दो भागों में वर्गीकृत किया जाता है –
(a) अम्लीय बफर
b) क्षारीय बफर।
(ii) सरल बफर विलयन:
दुर्बल अम्ल तथा दुर्बल क्षार से बने लवण का विलयन सरल बफर कहलाता है।
उदाहरण:
CH3COONH4, HCOONH4, NH4CN(NH4)2CO3 इत्यादि। इस प्रकार के बफर विलयन की बफर क्रिया कम होती है।
बफर की क्रियाविधि – उदाहरण – CHCOONH4 (अमोनियम ऐसीटेट)
इसका आयनन निम्न प्रकार होता है
CH3COONH4 ⇌ CH2COO– + NH4+
इसमें कुछ मात्रा में प्रबल अम्ल मिलाने पर प्राप्त H+, CHCOO– से क्रिया करके दुर्बल आयनित CH3COOH बना देते हैं। तथा कुछ मात्रा में प्रबल क्षार मिलाने पर प्राप्त O(overset { – }{ H } ), (overset { + }{ N } )H4, से क्रिया करके दुर्बल आयनित NH4OH बना देते हैं अतः विलयन की pH लगभग स्थिर रहती है।
बफर क्षमता – 1 लीटर बफर विलयन में मिलाए गए अम्ल या क्षार के मोलों की संख्या जो इसकी pH में इकाई परिवर्तित कर सके उसे बफर क्षमता कहते हैं।
बफर विलयन बनाना:
pKa, pKb तथा साम्य स्थिरांक के ज्ञान से हम ज्ञात pH का बफर विलयन बना सकते हैं।
(i) (a) अम्लीय बफर: किसी दुर्बल अम्ल तथा इसकी किसी प्रबल क्षार से क्रिया द्वारा बने लवण का मिश्रण, अम्लीय बफर कहलाता है।
उदाहरण –
1. CH3COOH तथा CH3COONa का मिश्रण
2. HCOOH तथा HCOONa का मिश्रण
3. HCN तथा KCN का मिश्रण।
अम्लीय बफर विलयन की pH ज्ञात करना –
दुर्बल अम्ल (HA) जल में निम्न प्रकार आयनीकृत होता है
HA + H2O ⇌ H3O+ + A–
इसके लिए साम्य स्थिरांक –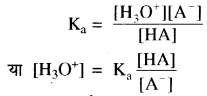
ऋणात्मक लघुगणक लेने पर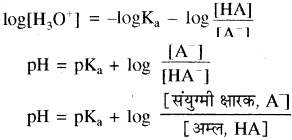
यह हेन्डर्सन समीकरण कहलाता है।
यहाँ
(frac { left[ { A }^{ – } right] }{ left[ H{ A } right] } )
संयुग्मित क्षारक (ऋणायन) तथा मिश्रण में उपस्थित अम्ल की सान्द्रताओं का अनुपात है। अम्ल दुर्बल होता है अत: यह बहुत कम आयनीकृत होता है तथा सान्द्रता [HA] बफर बनाने को लिए गए अम्ल की सान्द्रता के लगभग समान ही होती है, साथ ही अधिकतर संयुग्मी क्षारक, [A–], अम्ल के आयनन से ही प्राप्त होता है। अतः संयुग्मी क्षारक की सान्द्रता, लवण की सान्द्रता से थोड़ी – सी ही भिन्न होगी अतः उपरोक्त समीकरण को इस प्रकार भी लिखा जा सकता है –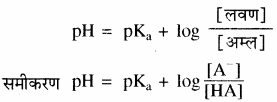
में [HA] = [A–] तो pH = pKa
इसे अधिकतम बफर क्रिया कहते हैं।
अतः यदि हम अम्ल तथा लवण (संयुग्मी क्षारक) की मोलर सान्द्रता बराबर लें तो प्राप्त बफर विलयन का pH अम्ल के pKa के बराबर होगा। अतः अपेक्षित pH का बफर विलयन बनाने के लिए हमें ऐसे अम्ल का चयन करना चाहिए जिसका pKa अपेक्षित pH के बराबर हो। ऐसीटिक अम्ल का pKa मान 4.76 होता है, इसलिए ऐसीटिक अम्ल तथा सोडियम ऐसीटेट को समान मात्रा में लेकर बनाए गए बफर विलयन का pH लगभग 4.76 होता है।
बफर विलयन बनाने के लिए अम्ल तथा लवण की सान्द्रताओं का अधिकतम अनुपात 1 : 10 या 10 : 1 हो सकता है, अतः
अम्लीय बफर की pH परास = pKa ± 1
या
pH परास = pKa – 1 से pKa +1
अम्लीय बफर की क्रियाविधि –
उदाहरण:
CH3COOH तथा CH3COONa के विलयन में CH3COO–, Na+ तथा लगभग अनआयनित CH3COOH होता है। जब इस विलयन में थोड़ा – सा प्रबल अम्ल मिलाया जाता है तो प्राप्त में H+, CH3COO से संयोग करके बहुत कम आयनित CH3COOH बना देते हैं। अतः विलयन की pH पर कोई प्रभाव नहीं होता। इसी प्रकार थोड़ा – सा प्रबल क्षार मिलाने पर प्राप्त OH– अनआयनित CH3COOH से क्रिया कर लेते हैं अतः pH लगभग स्थिर रहती है।
(i) (b) क्षारीय बफर:
किसी दुर्बल क्षार तथा इसकी किसी प्रबल अम्ल से क्रिया द्वारा बने लवण का मिश्रण, क्षारीय बफर कहलाता है।
उदाहरण –
1. NH4OH तथा NH4Cl का मिश्रण
2. NH4OH तथा NH4NO3 का मिश्रण।
क्षारीय बफर विलयन की pH ज्ञात करना –
क्षारीय बफर में उपस्थित दुर्बल क्षार से अम्लीय बफर के समान व्युत्पन्न (Derivation) करने पर निम्नलिखित व्यंजक प्राप्त होगा –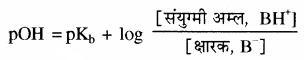
यहाँ [B] = [BH+] तो pOH = pKb
तथा pOH परास = pKb ± 1
चूँकि pH + pOH = 14
या pH + pOH = pKw
या pOH = pKw – pH
तथा pKa + pKb = pKw
या pKb = pKw – pKa
ये मान उपरोक्त समीकरण में रखने पर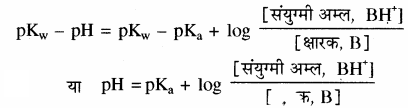
यदि क्षारक तथा इसके संयुग्मी अम्ल (धनायन) की सान्द्रता बराबर हो तो बफर विलयन का pH क्षारक के संयुग्मी अम्ल pKa के बराबर होगा। अमोनिया के संयुग्मी अम्ल का pKa मान 9.25 होता है, अतः 9.25 pH का बफर विलयन समान सान्द्रता वाले अमोनिया विलयन तथा अमोनियम क्लोराइड विलयन को मिलाकर बनाया जा सकता है।
अतः NH4OH + NH4Cl से बने बफर विलयन के लिए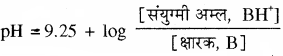
बफर विलयन को तनु करने पर इसके pH पर कोई प्रभाव नहीं होता। है क्योंकि लघुगणक के अन्तर्गत आने वाला पद अपरिवर्तित रहता है।
बफर विलयन के उपयोग –
- हमारे शरीर में उपस्थित कई तरल पदार्थ (जैसे – रक्त या मूत्र) की pH निश्चित होती है। इनकी pH में हुआ परिवर्तन शरीर के ठीक से काम नहीं करने का संकेत देता है।
- कई रासायनिक तथा जैविक क्रियाओं में भी pH का नियंत्रण बहुत महत्त्वपूर्ण होता है।
- कई औषधियों तथा प्रसाधनों को भी एक विशेष pH पर रखा जाता है तथा हमारे शरीर में प्रविष्ट कराया जाता है।
प्रश्न 38.
विलेयता गुणनफल किसे कहते हैं? Cds प्रकार के यौगिकों के लिए विलेयता तथा विलेयता गुणनफल में सम्बन्ध स्थापित कीजिए। तृतीय समूह के अवक्षेपण में NH4OH मिलाने के पहले NH4Cl क्यों मिलाया जाता है? कारण समझाइए।
उत्तर:
जल में भिन्न – भिन्न आयनिक ठोसों की विलेयता में बहुत अन्तर होता है। कुछ आयनिक यौगिकों की विलेयता तो इतनी अधिक होती है। कि वे आर्द्रताग्राही होते हैं, जैसे CaCl2 अतः ये वायुमण्डल से जलवाष्प का अवशोषण कर लेते हैं तथा कुछ यौगिकों की विलेयता इतनी कम होती है कि इन्हें सामान्यतः अविलेय ही कहा जाता है, जैसे LiF
विलेयता के आधार पर लवणों को तीन वर्गों में वर्गीकृत किया गया है –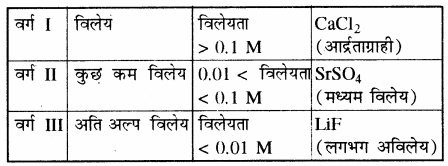
किसी लवण, की विलेयता मुख्यतः जालक एन्थैल्पी तथा जलयोजन एन्थैल्पी पर निर्भर करती है तथा प्रत्येक लवण की विलेयतः निश्चित होती है जो कि ताप पर निर्भर करती है। कोई लवण जल में तभी विलेय होता है जब उसकी जलयोजन एन्थैल्पी (विलायकन एन्थैल्पी) को मान जालक एन्थैल्पी से अधिक होता है। विलायकन एन्थैल्पी की मात्रा विलायक की प्रकृति पर भी निर्भर करती है। अध्रुवीय विलायक में विलायकन एन्थैल्पी का मान कम होता है, जो कि लवण की जालक ऊर्जा को सन्तुष्ट (Overcome) करने में सक्षम नहीं होता है। अतः लवण अध्रुवीय विलायक में अविलेय होते हैं।
विलेयता गुणनफल स्थिरांक (Ksp):
विलेयता (S) – निश्चित ताप पर किसी पदार्थ के संतृप्त विलयन में घुली हुई विलेय की अधिकतम मात्रा को उसकी विलेयता कहते हैं। इसे mol L-1 में व्यक्त किया जाता है।
विलेयता गुणनफल (Ksp) – किसी अल्प विलेय ठोस लवण के संतृप्त विलयन में अविलेय ठोस तथा आयनों के मध्य साम्य होता है। जैसे – Ba+2SO4-2
संतृप्त विलयन में अविलेय ठोस पदार्थ एवं विलेय हुए पदार्थ के साथ साम्यावस्था में रहते हैं। इस ताप पर विलयन में और अधिक विद्युत अपघट्य मिलाने पर यह अविलेय रहता है। इस अवस्था में निम्न साम्यावस्था स्थापित होती है![]()
विलेयता गुणनफल (KSP): निश्चित ताप पर किसी पदार्थ के संतृप्त विलयन में उपस्थित अयनों के सान्द्रता के गुणनफल को पदार्थ का विलेयता गुणनफल कहते हैं। इसे KSP से प्रदर्शित करते हैं –
AB (ठोस) ⇌ A+ + B–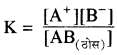
चूँकि निश्चित ताप पर संतृप्त विलयन की सान्द्रता AB (ठोस) स्थिर रहती है अतः K और [AB (ठोस)]का गुणनफल स्थिरांक हो जाता है, इसे विलेयता गुणनफल कहते हैं।
K [AB(ठोस)] = [A+] [B–] = KSP
KSP का मान निश्चित ताप पर स्थिर होता है। ताप परिवर्तन होने पर इसका मान भी परिवर्तित हो जाता है।
विलेयता (S) तथा विलेयता गुणनफल (Ksp) में सम्बन्ध –
किसी ठोस लवण, जिसका सामान्य सूत्र Mxp+ Xyq- है जो अपने संतृप्त विलयन के साथ साम्य में है तथा जिसकी मोलर विलेयता ‘S’ है, को निम्न समीकरण द्वारा दर्शाया जा सकता है – MxXy (s) ⇌ xMp+ (aq) + yXq- (aq)
(यहाँ x × p+ = y × q–)
अतः विलेयता गुणनफल –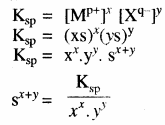
अतः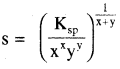
विलेयता तथा विलेयता गुणनफल में सम्बन्ध विद्युत अपघट्य की प्रकृति पर निर्भर करता है –
- एक – एक संयोजी, द्वि – द्विसंयोजी तथा त्रि – त्रिसंयोजी विद्युत अपघट्यों के लिए –
(AB) विद्युत अपघट्य AB का आयनन निम्न प्रकार होता है –
जैसे – BaSO4
उदाहरण – Ag+Cl–, Ag+NO-3 (एक – एकसंयोजी), Ba+2SO4-2Cd+2S-2 (द्वि – द्विसंयोजी) तथा Al+3PO4-3, Al+3N-3
(त्रि – त्रिसंयोजी). - एक – द्विसंयोजी विद्युत अपघट्य के लिए – (AB2) या (A2B)
उदाहरण – Mg(OH)2, Fe(OH)2PbCl2(AB2) तथा Ag2CrO4(A2B)

- एक – त्रिसंयोजी विद्युत अपघट्य के लिए (AB3) या (A3B)
उदाहरण – Fe(OH)3 (AB3) तथा Ag3PO4(A3B)
- द्वि – त्रिसंयोजी विद्युत अपघट्य के लिए (A2B3) या (B3A2)
उदाहरण – Ca3(PO4)2
अन्य प्रकार का उदाहरण
किसी विद्युत अपघट्य के अवक्षेपण की शर्त –
किसी लवण के विलयन में जब साम्य अवस्था नहीं होती है। अर्थात् संतृप्त विलयन से कम या अधिक लवण उपस्थित होता है तो Ksp के स्थान पर Qsp आयनिक गुणनफल का प्रयोग करते हैं तथा जब –
- Ksp = Qsp तो साम्यावस्था की स्थिति होगी।
- Ksp > Qsp तो लवण विलेय होगा।
- Ksp <Qsp तो लवण का अवक्षेपण होगा।
Qsp को आयनिक गुणनफल कहते हैं। अतः किसी लवण के अवक्षेपण के लिए आयनिक गुणनफल का मान विलेयता गुणनफल से अधिक होना चाहिए।
प्रश्न 39.
किसी उपयुक्त रासायनिक अभिक्रिया का उदाहरण लेकर द्रव अनुपाती क्रिया के नियम को समझाइए। एक समांगी अभिक्रिया के लिए Kp तथा Kc में सम्बन्ध के व्यंजक की व्युत्पत्ति कीजिए।
उत्तर:
आंशिक दाब साम्य स्थिरांक Kp तथा Kc:
किसी विलयन में होने वाली अभिक्रियाओं के लिए साम्यावस्था स्थिरांक को, अभिकारकों एवं उत्पादों की मोलर सान्द्रता के रूप में व्यक्त किया जाता है जिसे Kc द्वारा प्रदर्शित किया
जाता है। लेकिन गैसीय अभिक्रियाओं के लिए साम्यावस्था स्थिरांक को अभिकारकों तथा उत्पादों की सान्द्रता को आंशिक दाब के रूप में व्यक्त किया जाता है तथा इसे Kp द्वारा दर्शाते हैं।
आदर्श गैस समीकरण pV = nRT के अनुसार
n = गैस के मोलों की संख्या
p = गैस का दाब (bar में)
V = आयतन (लीटर में)
T = ताप (K में)
p = (frac { n }{ V } ) RT
या p = CRT
क्योंकि ((frac { n }{ V } ) = c) या p = [C] RT
R = 0.0831 bar Lmol-1 K-1
C = सान्द्रता = mol L-1 अतः स्थिर ताप पर किसी गैस का दाब, उसकी सान्द्रता के समानुपाती होता है।
अर्थात् p ∝ [गैस]
p = [गैस] RT
एक सामान्य समांगी गैसीय उत्क्रमणीय अभिक्रिया
aA + bB ⇌ cC + dD के लिए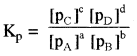
यहाँ pA, pB, pC तथा pD क्रमशः गैस A, B, C तथा D के आंशिक दाब हैं।
p = [C] RT के अनुसार
PA = [A] RT
PB = [B] RT
PC = [C] RT
PD = [D] RT
PA, PB, PC तथा PD के मान रखने पर
यहाँ Δn = गैसीय उत्पादों के मोलों की संख्या –
गैसीय अभिकारकों के मोलों की संख्या यह Kp तथा Kc में सम्बन्ध है।
अतः विलयन में होने वाली अभिक्रियाओं के लिए साम्य स्थिरांक को Kc के रूप में तथा गैसीय अभिक्रियाओं के लिए साम्य स्थिरांक को Kp तथा Kc दोनों रूपों में लिखा जा सकता है। विभिन्न प्रकार की अभिक्रियाओं के लिए Kp व Kc में सम्बन्ध
Kp = Kc (RT)Δn
भिन्न – भिन्न प्रकार की परिस्थितियों (भिन्न – भिन्न अभिक्रियाओं) के लिए यह सम्बन्ध इस प्रकार होगा –
- जब Δn = 0
उदाहरण – H2 (g) + I2 (g) ⇌ 2HI (g) के लिए Δn = 0
अतः Kp = Kc (RT)0
अर्थात् Kp = Kc - जब Δn = -ve
उदाहरण – N2(g) + 3H2(g) ⇌ 2NH3(g) के लिए
Δn = – 2
अतः Kp = Kc (RT)-2
अर्थात् Kp < Kc - जब Δn = +ve
उदाहरण – PCl5 (g) + PCl3 (g) + Cl2 (g) के लिए
Δn = +1
अतः Kp = Kc (RT)1
अर्थात् Kp > Kc
साम्य स्थिरांक Kp की गणना करते समय दाब को bar में व्यक्त किया जाता है क्योंकि दाब की मानक अवस्था 1 bar है।
1 bar = 105 Pascal (Pa) तथा
1Pa = 1 Nm-2
अतः 1 bar = 105Nm-2
साम्यावस्था स्थिरांक Kc तथा Kp के मात्रक –
Kc का माने ज्ञात करते समय सान्द्रता को mol L-1 में तथा Kp का मान ज्ञात करते समय आंशिक दाब को Pa, bar अथवा atm में व्यक्त किया जाता है। इस प्रकार साम्यावस्था स्थिरांक का मात्रक सान्द्रता या दाब के मात्रक पर निर्भर करता है। जब साम्यावस्था स्थिरांक व्यंजक के अंश में घातांकों का योग हर में घातांकों के योग के बराबर होता है, जैसे अभिक्रिया H2 (g) + I2 (g) ⇌ 2HI में Kp तथा Kc के कोई मात्रक नहीं होते हैं। लेकिन अभिक्रिया N2O4(g) ⇌ 2NO2(g) के लिए Kc का मात्रक mol/L तथा Kp का मात्रक bar है। अतः सामान्य रूप में –
Kc का मात्रक = (सान्द्रता)Δn
= (mol L-1)Δn
तथा Kp का मात्रक = (आंशिक दाब)Δn
= (Pa)Δn या (bar)Δn या (atm)Δn
जब अभिकारकों तथा उत्पादों को मानक अवस्था में लिया जाता है तो साम्यावस्था स्थिरांकों को विमाहीन (Dimensionless) मात्राओं में व्यक्त करते हैं। अभिकारकों तथा उत्पादों की मानक अवस्था में शुद्ध गैस की मानक अवस्था एक bar होती है। इस प्रकार 4 bar दाब मानक अवस्था के सापेक्ष में (frac { 4{ bar } }{ 1{ bar } } ) = 4 होता है, जो कि विमाहीन है। एक विलेय के लिए मानक अवस्था (Co) 1 मोलर विलयन है तथा अन्य सभी सान्द्रताएँ इसी के सापेक्ष ली जाती हैं। साम्य स्थिरांक का मान चुनी हुई मानक अवस्था पर निर्भर करता है। इस प्रकार इस प्रणाली में Kp तथा Kc दोनों विमाहीन राशियाँ हैं। लेकिन भिन्न – भिन्न मानक अवस्था के कारण इनका मान भिन्न – भिन्न होता है।
द्रव्य अनुपाती क्रिया के नियम:
समांगी निकाय वह होता है जिसमें सभी अभिकारक एवं उत्पाद एकसमान प्रावस्था में होते हैं।
उदाहरण –
N2 (g) + 3H2 (g) ⇌ 2NH3 (g)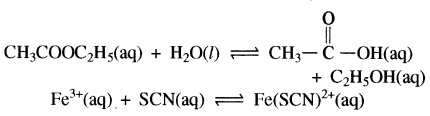
1. वे समांगी अभिक्रिया जिनमें Δn का मान शून्य हो – हाइड्रोजन आयोडाइड का संश्लेषण –
H2 + I2 ⇌ 2HI
इस अभिक्रिया में आरम्भ में a मोल H2 और b मोल I2 है तो x मोल हाइड्रोजन x मोल I2 के साथ अभिक्रिया करके 2x मोल HI बनाती है अतः साम्यावस्था पर (a – x) मोल H2 एवं (b – x) मोल I2 बची रहती है।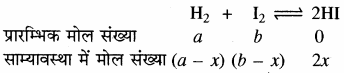
यदि पात्र का आयतन V लीटर है तो साम्यावस्था में इनके सक्रिय द्रव्यमान निम्न प्रकार से होंगे –
[H2] = (frac { a-{ x } }{ V } ); [I2] = (frac { b-{ x } }{ V } ); [HI] = (frac { 2{ x } }{ V } )
द्रव्य अनुपाती क्रिया नियम के अनुसार –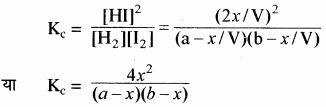
उपरोक्त अभिक्रिया के साम्य के लिए Kp का मान ज्ञात करना –
साम्य अवस्था में कुल मोल = a – x + b – x + 2x = a + b यदि कुल दाब p हो तो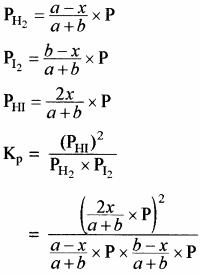
![]()
अतः Kp = Kc
उपरोक्त साम्य में वियोजन की मात्रा x दाब (P) एवं आयतन (V) से अप्रभावित रहती है।
2. वे समांगी अभिक्रिया जिनमें Δn का मान धनात्मक हो – फास्फोरस पेन्टा क्लोराइड का वियोजन –
PCl5 ⇌ PCl3 + Cl2
यदि PCl5 की प्रारम्भिक सान्द्रता a ग्राम मोल है एवं साम्यावस्था में इसके x ग्राम मोल वियोजित हो जाते हैं। PCl5 का एक ग्राम अणु वियोजित होकर एक ग्राम अणु PCl5 एवं एक ग्राम अणु Cl2 बनता है अतः इसके x ग्राम मोल वियोजित होकर x ग्राम PCl3 मोल एवं x ग्राम मोल Cl2 बनते हैं। यदि उपरोक्त अभिक्रिया V लीटर के पात्र में करवाते हैं तो साम्यावस्था पर
PCl5 ⇌ PCl3 + Cl2
द्रव्य अनुपाती क्रिया के नियमानुसार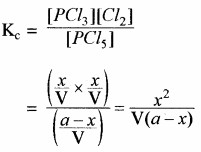
Kp का मान ज्ञात करना –
इस साम्य के लिए Kp का मान Kc से अधिक होता है।
PCl5 ⇌ PCl3 + Cl2![]()
साम्यावस्था में ग्राम मोल साम्यावस्था मिश्रण में कुल ग्राम मोलों की संख्या
= (a – x) + x + x = (a + x)
यदि अभिक्रिया मिश्रण का कुल दाब P हो तो, क्रियाकारकों व उत्पादों के आंशिक दाब निम्न प्रकार ज्ञात कर सकते हैं –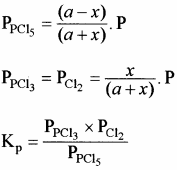
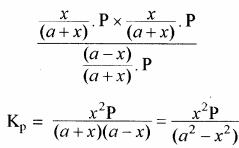
यदि PCl5 का वियोजन 1 ग्राम मोल से प्रारम्भ करें तो साम्यावस्था पर वियोजित ग्राम मोलों की संख्या ४ वियोजन की मात्रा कहलाती है अर्थात् Kc एवं Kp के व्यंजकों में a = 1 रखने पर
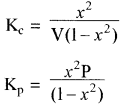
साम्यावस्था पर विभिन्न कारकों का प्रभाव:
- दाब का प्रभाव:
माना x<<< 1 हो तो Kp के व्यंजक में x2 की उपेक्षा की जा सकती है अर्थात् (1 – x2) ≃ 1
Kp = x2P
या
अतः वियोजन की मात्रा (x) दाब के वर्गमूल के व्युत्क्रमानुपाती होती है अर्थात् दाब बढ़ाने पर वियोजन की मात्रा (x) कम होगी एवं अभिक्रिया प्रतीप दिशा में गमन करेगी। - सान्द्रता का प्रभाव:
साम्यावस्था में क्रियाकारक पदार्थों की सान्द्रता बढ़ाने पर Kc का मान स्थिर रखने के लिए उत्पादों की सान्द्रता भी बढ़ेगी एवं अभिक्रिया अग्र दिशा में गमन करेगी। इसी प्रकार उत्पादों की सान्द्रता बढ़ाने पर अभिक्रिया प्रतीप दिशा में गमन करेगी क्योंकि Kc का मान स्थिर रखने के लिए क्रियाकारकों की सान्द्रता भी बढ़ेगी। - ताप का प्रभाव:
PCl5 के वियोजन में ऊष्मा अवशोषित होती है अतः ताप बढ़ाने पर साम्य स्थिरांक Kc का मान बढ़ता है, जिससे साम्य अग्र दिशा में गमन करता है अर्थात् PCl5 का अधिक वियोजन होता है। - अक्रिय गैस के मिलाने का प्रभाव:
PCl5 के वियोजन में साम्यावस्था पर अक्रिय गैस स्थिर आयतन पर मिलाने पर साम्य मिश्रण पर दाब बढ़ जाता है एवं वियोजन की मात्रा कम हो जाती है। स्थिर दाब पर अक्रिय गैस मिलाने पर साम्य मिश्रण का कुल आयतन बढ़ जाता है एवं वियोजन की मात्रा बढ़ जाती है।
3. वे समांगी अभिक्रिया जिनमें Δn का मान ऋणात्मक हो अमोनिया का संश्लेषण:
हेबर ने नाइट्रोजन एवं हाइड्रोजन के संयोग से अमोनिया का निर्माण किया जिसके साम्य को अग्र प्रकार प्रदर्शित करते हैं –
N2 + 3H2 ⇌ 2NH3
इस अभिक्रिया के लिए Δn को मान (2 – Cl) = – 2 ऋणात्मक है। माना एक बन्द पात्र में जिसका आयतन V लीटर है, जिसमें a मोल N2 एवं b मोल H2 से अभिक्रिया होती है। साम्यावस्था पर माना N2 के x मोल हाइड्रोजन के 3x मोल से संयोग करके 2x मोल अमोनिया बनाते हैं।
द्रव्य अनुपाती क्रिया के नियमानुसार–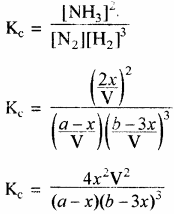
यदि अभिक्रिया 1 ग्राम मोल N2 तथा 3 ग्राम मोल H2 से प्रारम्भ की जाये अर्थात् a – 1 एवं b = 3 हो तो –![]()
Kp का मान परिकलन करना – यदि अभिक्रिया 1 ग्राम मोल N2 और 3 ग्राम मोल H2 से प्रारम्भ करें तो
N2 + 3H2 ⇌ 2NH3![]()
साम्यावस्था में ग्राम मोल साम्यावस्था में कुल ग्राम मोलों (अणुओं) की संख्या = (1 – x) । + (3 – 3x) + 2x = (4 – 2x)
यदि साम्यावस्था में मिश्रण का कुल दाब P है तो –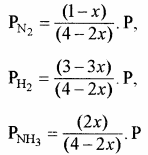
द्रव्य अनुपाती क्रिया के नियमानुसार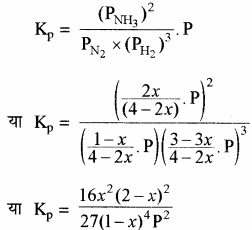
साम्यावस्था पर दाब का प्रभाव – यदि x का मान इकाई से बहुत छोटा हो अर्थात् x <<< 1 तो (2 – x) = 2 तथा (1 – x) = 1 रखने पर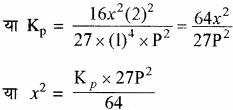
या x2 ∝ p2
या x2 ∝ P
अतः दाब (P) में वृद्धि करने पर x में वृद्धि होती है अर्थात् अभिक्रिया अग्र दिशा में होगी और अमोनिया अधिक मात्रा में बनेगी। दाब कम करने पर x की मात्रा कम होगी और अभिक्रिया प्रतीप दिशा में होगी।
प्रश्न 40.
सूचक किसे कहते हैं? सूचकों के ओस्टवाल्ड सिद्धान्त का वर्णन कीजिए। HNO3 तथा KOH के मध्य अनुमापन के लिए उपयुक्त सूचक अनुमापन वक्र खींचकर समझाइए।
उत्तर:
सूचकों का सिद्धान्त:
अम्ल – क्षार अनुमापन में अन्तिम बिन्दु पर विलयन का माध्यम अम्लीय से क्षारीय या क्षारीय से अम्लीय में परिवर्तित होता है अतः जिन यौगिकों में अम्लीय एवं क्षारीय माध्यम में भिन्न – भिन्न रंग हों, वे अन्तिम बिन्दु को पहचानने में प्रयुक्त होते हैं। इन यौगिकों को सूचक कहते हैं। माध्यम के pH परिवर्तन से सूचक का रंग निम्न दो सिद्धान्तों के अनुसार परिवर्तित होता है –
(i) ओस्टवाल्ड का आयनन सिद्धान्त (Ostwald’s lonisation Theory)
(ii) क्विनोनॉइड का सिद्धान्त (Quinonoid Theory)
(i) ओस्टवाल्ड का आयनन सिद्धान्त:
1. सूचक दुर्बल कार्बनिक अम्ल अथवा क्षार होते हैं। फिनॉल्फ्थेलीन एक दुर्बल अम्ल है जिसे HPh से इंगित करते हैं तथा मेथिल ऑरेंज दुर्बल क्षार है जिसे MeOH से प्रदर्शित करते हैं।
2. सूचक का अवियोजित तथा वियोजित अवस्था में रंग अलग – अलग होता है।
3. विलयन का रंग परिवर्तन सूचक के धनायन या ऋणायन की सान्द्रता पर निर्भर करता है। जिसकी सान्द्रता अधिक होगी उसके रंग के समान ही पूरे विलयन का रंग दिखेगा। फिनॉल्फ्थेलीन क्षारीय माध्यम में गुलाबी रंग देता है। विलयन में HPh तथा क्षार NaOH का निम्न प्रकार वियोजन होता है। विलयन में सूचक HPh से प्राप्त H+ आयन, क्षार से प्राप्त OH– आयन से संयोग करके H2O बनता है। इस कारण सूचक का अधिक आयनन होगा तथा विलयन में Ph आयन की सान्द्रता में वृद्धि होगी तथा विलयन गुलाबी हो जाता है।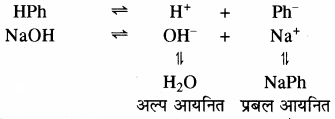
अल्प आयनित प्रबल आयनित फिनॉल्फ्थेलीन अम्लीय माध्यम में रंगहीन रहता है। अम्लीय माध्यमं में समआयने प्रभाव के कारण HPh का वियोजन कम होगा।
HCl → H+ + Cl–
HPh → H+ + Ph–
अतः विलयन में Ph आयन सान्द्रता कम होती है तथा विलयन रंगहीन होता है।
मेथिल ऑरेन्ज दुर्बल कार्बनिक क्षार है। मेंथिल ऑरेन्ज अम्लीय माध्यम में गुलाबी रंग देता है। प्रबल अम्ल से प्राप्त H+ आयन सूचक से प्राप्त OH– आयन से क्रिया करके अल्प वियोजित H2O का निर्माण करता है। अतः MeOH अधिक वियोजित होता है तथा विलयन में Me+ आयन की सॉन्द्रता में वृद्धि होती है एवं गुलाबी रंग प्राप्त होता है। क्षारीय माध्यम में मेथिल ऑरेन्ज गुलाबी रंग नहीं देता है क्योंकि क्षारीय माध्यम में मेथिल ऑरेन्ज का समआयन प्रभाव के कारण वियोजन कम होता है। इस प्रकार विलयन में Me+ आयन की सान्द्रता कम होती है, जिससे गुलाबी रंग प्राप्त नहीं होता है।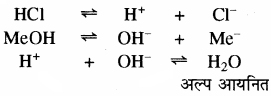
(ii) क्विनोनॉइड सिद्धान्त:
इस सिद्धान्त के अनुसार
1. ये सूचक ऐरोमेटिक कार्बनिक यौगिक हैं।
2. प्रत्येक सूचक में दो अवस्थाएँ होती हैं, जिन्हें बैंजीनॉइड एवं क्विनोनॉइड अवस्था कहते हैं। ये दोनों एक – दूसरे के साम्य अवस्था में होती हैं। रंग परिवर्तन सूचक के संरचनात्मक परिवर्तन के कारण होता है। बैंजीनॉइड संरचना क्विनोनॉइड संरचना में परिवर्तित होती है।
3. दोनों संरचनाओं के रंग भिन्न होते हैं। क्विनोनॉइड का रंग बैंजीनॉइड से अधिक गहरा होता है।
4. फिनॉल्फ्थेलीन क्षारीय माध्यम में गुलाबी रंग देती है क्योंकि क्षार की उपस्थिति में सूचक की बैंजीनॉइड संरचना क्विनोनॉइड संरचना में परिवर्तित हो जाती है। क्योंकि फिनॉल्फ्थेलीन में उपस्थित लैक्टॉन वलय का खुलना है जिससे विलयन का रंग गुलाबी हो जाता है। फिनॉल्फ्थेलीन अम्लीय माध्यम में रंगहीन रहता है क्योंकि अम्लीय माध्यम में इसकी संरचना में परिवर्तन नहीं होता है।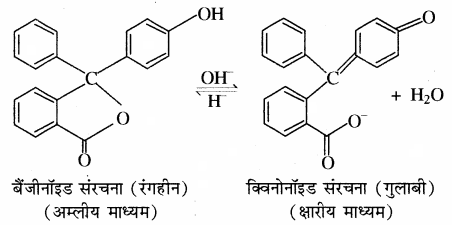
5. मेथिल ऑरेन्ज अम्लीय माध्यम में लाल रंग देता है क्योंकि इसकी बैंजीनॉइड संरचना, क्विनोनॉइड संरचना में परिवर्तित हो जाती है।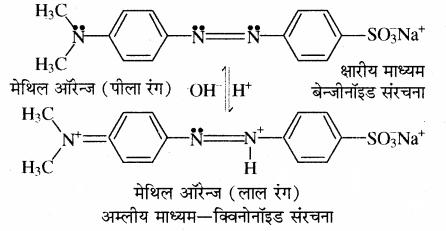
सूचकों का चुनाव:
अम्ल – क्षार अनुमापन में प्रयुक्त विलयनों में से एक विलयन अम्लीय होता है एवं दूसरा विलयन क्षारीय होता है तथा इनके आयनन की मात्रा के आधार पर विलयनों की pH का निर्धारण होता है। अम्ल – क्षार अनुमापन में उचित सूचक का चुनाव निम्न कारकों पर निर्भर करता है –
(i) अनुमापन में भाग लेने वाले अम्ल एवं क्षार की प्रकृति पर
(ii) अन्तिम बिन्दु के विलयन की pH के परिवर्तन पर
अम्ल – क्षार अनुमापन निम्न प्रकार के होते हैं –
(1) प्रबल अम्ल एवं प्रबल क्षार के मध्य अनुमापन:
इस प्रकार के अनुमापन में क्षार को ब्यूरेट में एवं अम्ल को कोनिकल फ्लास्क में लेते हैं। प्रबल अम्ल की pH बहुत ही कम होती है। फ्लास्क में जब क्षार मिलाते । हैं तो pH में धीरे – धीरे परिवर्तन (वृद्धि) होता है परन्तु अन्तिम बिन्दु पर pH में तीव्रता से (3 से 10 तक) वृद्धि होती है। इस प्रकार मिलाये गये क्षार के आयतन एवं pH में परिवर्तन को आलेत करके एक वक्र प्राप्त करते हैं, इस आलेख को अनुमापन वक्र कहते हैं। इस प्रकार के अनुमापनों के लिए मुख्य रूप से फिनॉल्फ्थेलीन (pH परास 8.3 – 10) एवं मेथिल ऑरेन्ज (pH परास 3 – 4.5) काम में ले सकते हैं।
उदाहरण – HCl – NaOH, H2SO4 – NaOH आदि।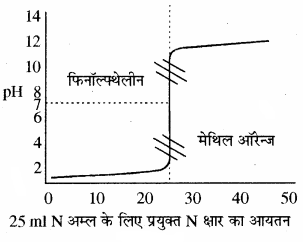
(2) दुर्बल अम्ल एवं प्रबल क्षार के मध्य अनुमापन:
एक दुर्बल अम्ल का pH लगभग 2 – 3 होता है एवं प्रबल क्षार डालने पर तेजी से बढ़ता है तथा अन्तिम बिन्दु पर pH में लगभग 6.5 से 10 तक का परिवर्तन होता है। pH परिवर्तन की इस परास में फिनॉल्फ्थेलीन तो आ जाता है, लेकिन मेथिल ऑरेन्ज नहीं आता है। अतः इस अनुमापन के लिए सूचक के रूप में फिनॉल्फ्थेलीन का चयन किया जा सकता है।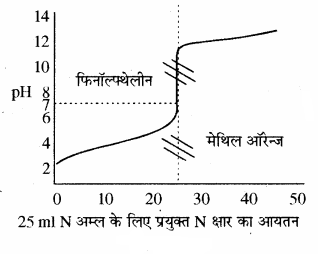
(3) प्रबल अम्ल एवं दुर्बल क्षार के मध्य अनुमापन:
इसमें प्रबल अम्ल कोनिकल फ्लास्क में लेकर धीरे – धीरे दुर्बल क्षार डालते हैं तो प्रबल अम्ल का pH का मान धीरे – धीरे बढ़ेगा और अन्तिम बिन्दु पर परिवर्तन लगभग 3 से 7 तक होता है। इस pH परास में मेथिल ऑरेन्ज तो आ जाता है लेकिन फिनॉल्फ्थेलीन इसके बाहर निकल जाता है। अतः इन अनुमापनों के लिए सूचक के रूप में मेथिल ऑरेन्ज का चयन किया जाता है।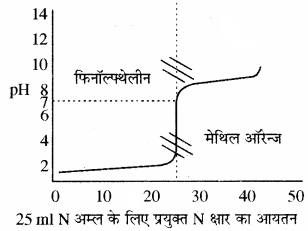
(4) दुर्बल अम्ल एवं दुर्बल क्षार के मध्य अनुमापन:
इस प्रकार के अनुमापन में दुर्बल अम्ल में धीरे – धीरे दुर्बल क्षार डालते हैं तो pH के मान में वृद्धि धीरे – धीरे और अन्तिम बिन्दु की pH परास अत्यन्त कम होने के कारण फीनॉल रेड अथवा ब्रोमोथायमॉल ब्लू जैसे सूचकों का उपयोग किया जा सकता है। लेकिन जैसा कि चित्र से स्पष्ट है, इसका अन्तिम बिन्दु बिल्कुल भी तीक्ष्ण (Sharp) नहीं है अतः रंग परिवर्तन इतना स्पष्ट नहीं दिखता। इन कारणों की वजह से सामान्यतया दुर्बल अम्ल तथा दुर्बल क्षार का अनुमापन किया ही नहीं जाता।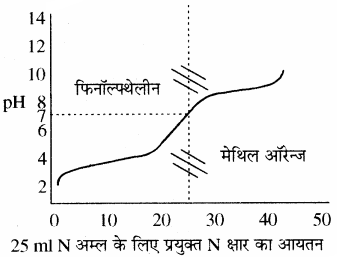
Ma × Va= Mb × Vb
Ma = अम्ल की मोलरता
Va = अम्ल का आयतन
Mb = क्षार की मोलरता
Vb = क्षार का आयतन
उपरोक्त सूत्र के अनुसार यदि तीन का मान ज्ञात हो तो चौथे का मान ज्ञात किया जा सकता है।
naMa × Va = nbMb × Vb
na = अम्ल की क्षारकता
nb = क्षार की अम्लता
RBSE Class 11 Chemistry Chapter 7 आंशिक प्रश्न
प्रश्न 41.
H2S का प्रथम आयनन स्थिरांक 9.1 × 10-6 है। इसके 0.1 M विलयन में HS– आयनों की सान्द्रता की गणना कीजिए तथा बताइए कि यदि इसमें 0.1 M HCl भी उपस्थित हो, तो सान्द्रता किस प्रकार प्रभावित होगी? यदि H2S का द्वितीय वियोजन स्थिरांक 1.2 × 10-13 हो तो सल्फाइड S-2 आयनों की दोनों स्थितियों में सान्द्रता की गणना कीजिए।
उत्तर: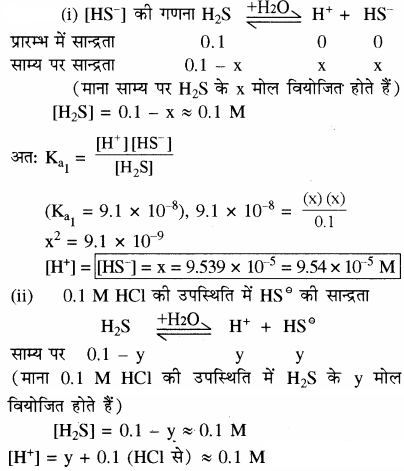

क्योंकि द्वितीय वियोजन बहुत कम होता है अतः उससे प्राप्त | [H+] को नगण्य माना जा सकता है।
प्रश्न 42.
प्रोपेनोइक अम्ल का आयनन स्थिरांक 1.32 × 10-5 है। 0.05M अम्ल विलयन के आयनन की मात्रा तथा pH ज्ञात कीजिए। यदि विलयन में 0.01 M HCl मिलाया जाए तो उसके आयनन की मात्रा ज्ञात कीजिए।
उत्तर
CH3CH2COOH + H2O + H3O+ + CH3CH2COO–
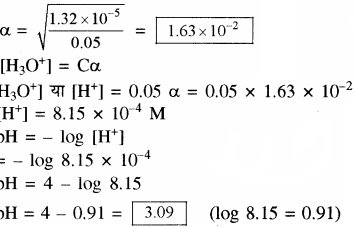
माना 0.01 M HCl की उपस्थिति में प्रोपेनोइक अम्ल की आयनन की मात्रा = α’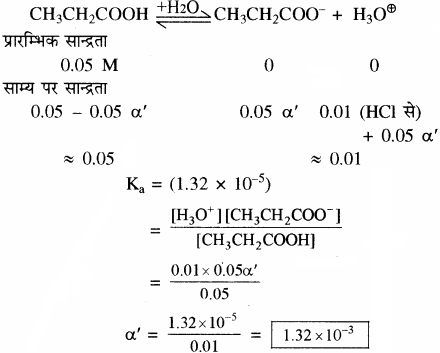
प्रश्न 43.
निम्नलिखित मिश्रणों की pH परिकलित कीजिए –
(क) 0.2M Ca(OH)2 का 10 ml + का 0.1M HCl का 25 ml
(ख) 0.01M H2SO4 का 10 ml + 0.01M Ca(OH)2 का 10 ml
(ग) 0.1M H2SO4 का 10 ml + 0.1M KOH का 10 ml
उत्तर:
(क) 0.2 M Ca(OH)2 के (10 ml) = MV मिलीमोल
= 0.2 × 10 = 2 मिलीमोल
0.1 M HCl के (25 ml) = M × V = 0.1 × 25 = 2.5 मिलीमोल![]()
अभिक्रिया की रससमीकरणमिति के अनुसार HCl के 2.5 मिलीमोल, Ca(OH)2 के 1.25 मिलीमोल से क्रिया करेंगे तथा 0.75 मिलीमोल (2 – 1.25) Ca(OH)2 बच जाएँगे।
विलयन (मिश्रण) का कुल आयतन = 10 + 25 = 35 ml
अतः मिश्रण में शेष बचे Ca(OH)2 विलयन की मोलरता![]()
= 0.0214 M
Ca(OH)2 से प्राप्त [OH–] = 2 × 0.0214 = 0.0428 = 4.28 × 10-2
pOH = – log [OH–] = – log (4.28 × 10-3)
pOH = 2 – log 4.28
pOH = 2 – 0.6314 (log 4.28 = 0.6314)
pOH = 1.37
pH = 14 – pOH = 14 – 1.37 = 12.63
pH = 12.63
(ख) H2SO4 के मिलीमोल = 10 × 0.01 = 0.1
Ca(OH)2 के मिलीमोल = 10 × .01 = 0.1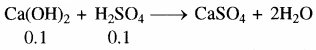
मिश्रण में Ca(OH)2 तथा H2SO4 के मिली मोल। बराबर हैं अतः विलयन उदासीन होगा। अतः pH = 7
(ग) H2SO4 के मिलीमोल = 10 × 0.1 = 1
KOH के मिलीमोल = 10 × 0.1 = 1![]()
संतुलित समीकरण के अनुसार 1 मिलीमोल KOH, 0.5 मिलीमोल H2SO4 से क्रिया करेगा तथा 0.5 मिलीमोल H2SO4 शेष बचेगा जिसकी मोलरता
(frac { 0.5 }{ 20 } ) = 2.5 × 10-2
मिश्रण का कुल आयतन = 20 ml
H2SO4 से [H+] = 2 × मोलरता = 2 × 2.5 × 10-2
[H+] = 5 × 10-2
pH = – log [H+] = – log (5 × 10-2)
pH = 2 – log 5 (log 5 = 0.6990)
pH = 1.3
प्रश्न 44.
Ag2CrO4 तथा AgBr का विलेयता गुणनफल स्थिरांक क्रमशः 1.1 × 10-12 तथा 5.0 × 10-13 है। उनके संतृप्त विलयन की मोलरता का अनुपात ज्ञात कीजिए।
उत्तर:
(i) Ag2CrO4 का Ksp = 1.1 × 10-12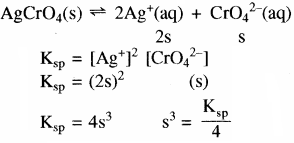
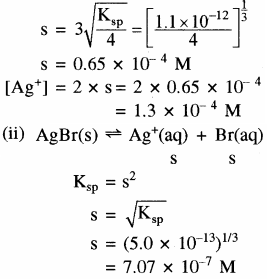
मोलरता का अनुपात =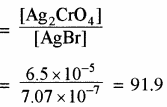
प्रश्न 45.
बेन्जोइक अम्ल का आयनन स्थिरांक 6.46 × 10-5 तथा सिल्वर बेन्जोएट का Ksp = 2.5 × 10-13 है। 3.19 pH वाले बफर विलयन में सिल्वर बेन्जोएट जल की तुलना में कितना गुना विलेय होगा?
उत्तर:
माना बफर विलयन में सिल्वर बेन्जोएट की विलेयता = s’
[Ag+] = s’ तथा [C6H5COO–] + [C6H3COOH–) = s’
लगभग सारा बेन्जोएट आयन, बेंजोइक अम्ल में बदल जाता है।
अतः [C6H5COO] + 10 [C6H5COO] = s’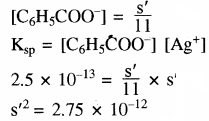
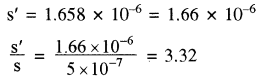
अतः सिल्वर बेन्जोएट बफर विलयन में जल की तुलना में 3.32 गुना अधिक विलेय होगा।
All Chapter RBSE Solutions For Class 11 Chemistry Hindi Medium
—————————————————————————–
All Subject RBSE Solutions For Class 11 Hindi Medium
*************************************************
————————————————————
All Chapter RBSE Solutions For Class 11 Chemistry Hindi Medium
All Subject RBSE Solutions For Class 11 Hindi Medium
Remark:
हम उम्मीद रखते है कि यह RBSE Class 11 chemistry Solutions in Hindi आपकी स्टडी में उपयोगी साबित हुए होंगे | अगर आप लोगो को इससे रिलेटेड कोई भी किसी भी प्रकार का डॉउट हो तो कमेंट बॉक्स में कमेंट करके पूंछ सकते है |
यदि इन solutions से आपको हेल्प मिली हो तो आप इन्हे अपने Classmates & Friends के साथ शेयर कर सकते है और HindiLearning.in को सोशल मीडिया में शेयर कर सकते है, जिससे हमारा मोटिवेशन बढ़ेगा और हम आप लोगो के लिए ऐसे ही और मैटेरियल अपलोड कर पाएंगे |
आपके भविष्य के लिए शुभकामनाएं!!