हेलो स्टूडेंट्स, यहां हमने राजस्थान बोर्ड Class 11 Chemistry Chapter 8 ऑक्सीकरण अपचयन अभिक्रियाएँ सॉल्यूशंस को दिया हैं। यह solutions स्टूडेंट के परीक्षा में बहुत सहायक होंगे | Student RBSE solutions for Class 11 Chemistry Chapter 8 ऑक्सीकरण अपचयन अभिक्रियाएँ pdf Download करे| RBSE solutions for Class 11 Chemistry Chapter 8 ऑक्सीकरण अपचयन अभिक्रियाएँ notes will help you.
Table of Contents
Rajasthan Board RBSE Class 11 Chemistry Chapter 8 ऑक्सीकरण अपचयन अभिक्रियाएँ
RBSE Class 11 Chemistry Chapter 8 पाठ्यपुस्तक के अभ्यास प्रशन
RBSE Class 11 Chemistry Chapter 8 वस्तुनिष्ठ प्रश्न
प्रश्न 1.
ऑक्सीकरण वह प्रक्रिया है
(अ) जिसमें इलेक्ट्रोन ग्रहण किये जाते हैं।
(ब) जिसमें विद्युत ऋणी तत्त्व का योग होता है।
(स) जिसमें विद्युत धनी तत्त्व योग होता है।
(द) जिसमें ऑक्सीकरण का निष्कासन होता है।
प्रश्न 2.
निम्नलिखित में से कौन से यौगिकों के युग्म में क्रोमियम का ऑक्सीकरण अंक समान है?
(अ) K2CrO4 तथा KCrO2
(ब) KCrO2 तथा Cr(CO)6
(स) K2Cr2O7 तथा Cr(CO)6
(द) K2Cr2O7 तथा K2CrO4
प्रश्न 3.
हीरे में कार्बन का ऑक्सीकरण अंक है
(अ) शून्य
(ब) + 4
(स) – 4
(द) + 2
प्रश्न 4.
निम्न अभिक्रिया में
2FeCl3 + SnCl2 → 2FeCl2 + SnCl4 अपचयित होने वाला पदार्थ है
(अ) Sn+2
(ब) Fe+2
(स) Sn+4
(द) Fe+3
प्रश्न 5.
निम्न में रेडॉक्स अभिक्रिया है
(अ) SnCl2 + 2FeCl3 → SnCl4 + 2FeCl2
(ब) AsNO3 + HCl → AsCl + HNO3
(स) 2KI + Pb(NO3)2 → 2KNO3 + PbI2
(द) BaCl2 + H2SO4 → BaSO4 + 2HCl
उत्तरमाला
1. (ब)
2. (द)
3. (अ)
4. (द)
5. (अ)
RBSE Class 11 Chemistry Chapter 8 अतिलघूत्तरात्मक प्रश्न
प्रश्न 6.
सेल विभव किसे कहते हैं ?
उत्तर:
किसी बैटरी के दो अर्द्ध-सेलों के मध्य उत्पन्न वोल्व को उस सेल का सेल विभव कहते हैं।
प्रश्न 7.
F तथा I में से कौनसा तत्त्व धनात्मक तथा ऋणात्मक दोनों ऑक्सीकरण अवस्था प्रदर्शित करेगा ?
उत्तर:
I धनात्मक एवं ऋणात्मक दोनों ऑक्सीकरण अवस्था प्रदर्शित करते हैं जबकि F की विद्युत ऋणात्मकता बहुत अधिक होने के कारण धनात्मक ऑक्सीकरण अवस्था प्रदर्शित नहीं करता है।
प्रश्न 8.
समीकरण ClO–+ H2O + Xe → Cl– + 2OH– में x का मान कितना होगा ?
उत्तर:
ClO–(aq) + H2O(l) + 2e– → Cl–(aq) + 2OH–(aq)
अतः Xe में X का मान 2 होगा।
प्रश्न 9.
अभिक्रिया 5H2O2 + Br2 → 2HBrO3 + 4H2O में अपचायक बताइए।
उत्तर:
इस अभिक्रिया में Br2 का ऑक्सीकरण होता है अतः Br2 अपचायक है।
प्रश्न 10.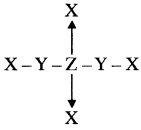
संरचना में ‘Y’ की विद्युत ऋणता
Z से अधिक है। ‘Z’ का ऑक्सीकरण अंक ज्ञात कीजिए।
उत्तर: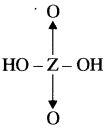
x + 2(-1) + 2(-2) = 0
x – 2 – 4 = 0
X = 6
x = +6
अतः Z का ऑक्सीकरण अंक + 6 होगा।
प्रश्न 11.
अमोनियम नाइट्रेट में नाइट्रोजन को ऑक्सीकरण अंक लिखिए।
उत्तर:
NH4NO3
x + 4(1) + x + 3(-2) = 0
x + 4 + x – 6 = 0
2x – 2 = 0
x = 1
अतः नाइट्रोजन का ऑक्सीकरण 1 होगा।
प्रश्न 12.
निम्नलिखित को Mn की बढ़ती ऑक्सीकरण अवस्था के क्रम में लिखिए-
K2MnO4, MnO2, KMnO4
उत्तर:
K2MnO4 2(+1) + x + 4 (-2)= 0
2 + x – 8= 0
x = 6
MnO2 x + 2(-2) = 0
x – 4= 0 x = 4
KMnO4 1(+1) + x +4 (-2) = 0
1 + x – 8= 0
x – 7 x = 7
MnO2 < K2MnO4 < KMnO4
प्रश्न 13.
रेडॉक्स अभिक्रिया किसे कहते हैं ?
उत्तर:
वे अभिक्रियाएँ जिनमें ऑक्सीकरण एवं अपचयन दोनों होते हैं, उन्हें रेडॉक्स अभिक्रिया कहते हैं।
प्रश्न 14.
LiAlH4 में Al का ऑक्सीकरण अंक क्या है ?
उत्तर:
LiAlH4
1(+1) + x + 4(-1) = 0
MnO2
1 + x – 4 = 0
x – 3 = 0
x = 3
अतः Al का ऑक्सीकरण अंक + 3 होगा।
प्रश्न 15.
K4 [Fe(CN)6] में Fe का ऑक्सीकरण अंक बताइए।
उत्तर:
4(+1) + x + 6(-1) = 0
4+ x – 6 = 0
x – 2 = 0
x = 2
अतः Fe का ऑक्सीकरण अंक + 2 होगा।
प्रश्न 16.
सल्फर की निम्नतम तथा उच्चतम ऑक्सीकरण अवस्था लिखिए।
उत्तर:
सल्फर की निम्नतम ऑक्सीकरण अवस्था -2 होती है। जबकि उच्चतम ऑक्सीकरण अवस्था +6 होती है।
RBSE Class 11 Chemistry Chapter 8 लघूत्तरात्मक प्रश्न
प्रश्न 17.
आयन इलेक्ट्रॉन विधि द्वारा क्षारीय माध्यम में होने वाली अभिक्रिया किस प्रकार संतुलित की जाएगी ? समझाइए।
उत्तर:
क्षारीय माध्यम में आयन इलेक्ट्रॉन विधि द्वारा निम्न प्रकार संतुलित करते हैं-
(i) सर्वप्रथम असंतुलित समीकरण को आयनिक रूप में लिखते हैं
Fe2+ (aq) + Cr2O7-2 (aq) → Fe3+ (aq) + Cr3+ (aq)
(ii) इस समीकरण को दो अर्द्ध अभिक्रियाओं में विभक्त करते हैं।
ऑक्सीकरण Fe2+ (aq) → Fe3+ + (aq)
अपचयन Cr2O7-2 (aq) → Cr3+ (aq)
(iii) अब प्रत्येक अर्द्ध अभिक्रिया में ऑक्सीजन एवं हाइड्रोजन के अतिरिक्त अन्य तत्त्वों के परमाणुओं को संतुलित करते हैं।
Cr2O72- (aq) → 2Cr+3 (aq)
Fe2+ (aq) → Fe3+ (aq)
(iv) ऑक्सीजन परमाणु के संतुलन के लिए H,0 तथा हाइड्रोजन परमाणु के संतुलन के लिए H+ जोड़ते हैं
Cr2O72- (aq) + 14H+ (aq) → 2Cr3+ (aq) + 7H2O(l)
(v) क्षारीय माध्यम के लिए समीकरण के दोनों ओर H+ आयनों की संख्या के बराबर OH– आयन जोड़ देते हैं। H+ एवं OH– को जोड़कर H2O लिख देते हैं।
(vi) अब आवेश को सन्तुलित करते हैं
Fe2 + (aq) → Fe3+ (aq) + e–
Cr2O72- (aq) + 14H+ (aq) + 6e– → 2Cr+3 (aq) + 7H2O(l)
दोनों अर्द्ध अभिक्रियाओं में es की संख्या समान करने के लिए ऑक्सीकरण अर्द्ध अभिक्रिया को 6 से गुणा करते हैं ।
6Fe2+ (aq) → 6Fe3+ (aq) + 6e–
(vii) अब दोनों अर्द्ध अभिक्रियाओं को जोड़ने पर सम्पूर्ण अभिक्रिया प्राप्त होती है।
6Fe2+ (aq) + Cr2O72- (aq) + 14H+ (aq) → 6Fe3+ (aq) + 2Cr+3 (aq) + 7H2O(l)
प्रश्न 18.
तत्त्व की ऑक्सीकरण अवस्था तथा संयोजकता में भिन्नता को स्पष्ट कीजिए।
उत्तर:
(i) किसी तत्त्व की संयोजकता उसकी अन्य तत्त्वों के परमाणुओं के साथ संयोग करने की क्षमता है जबकि ऑक्सीकरण अंक किसी अणु या आयन में उपस्थित परमाणु पर आदेश है।
(ii) संयोजकता के साथ धनात्मक या ऋणात्मक चिन्ह नहीं लगाया जाता है जबकि ऑक्सीकरण अंक के साथ धनात्मक या ऋणात्मक चिन्ह लगता है।
(iii) संयोजकता हमेशा पूर्णाक होती है जबकि ऑक्सीकरण संख्या भिन्नों में भी हो सकती है।
(iv) सामान्यतया किसी तत्त्व की संयोजकता निश्चित होती है। लेकिन एक तत्त्व का O.N. भिन्न-भिन्न यौगिक में भिन्न-भिन्न हो सकता है।
प्रश्न 19.
2KI + Cl2 → 2KCI – I2 अभिक्रिया में अपचायक पदार्थ बताइए।
उत्तर:
उपरोक्त अभिक्रिया में अपचायक को ऑक्सीकरण अंक द्वारा ज्ञात करते हैं।
KI 1(+1) + x = 0
1 + x = 0
x = -1
I2 = 0
अतः आयोडीन का ऑक्सीकरण अंक -1 से शून्य होता है अर्थात् आयोडीन के ऑक्सीकरण अंक में वृद्धि होती है।
Cl2 = 0 KCl 1 + x = 0 x = -1
Cl2 का ऑक्सीकरण अंक शून्य से -1 होता है अत: ऑक्सीकरण अंक में कमी होती है।
अत: KI अपचायक पदार्थ है क्योंकि आयोडीन के ऑक्सीकरण अंक में वृद्धि हुई है।
प्रश्न 20.
ऑक्सीकरण अंक ज्ञात कीजिए
(i) (NH4)2 MoO4,में Mo
(ii) Ni(CN)2-4 में Ni का
उत्तर:
(i) (NH4)2 MoO4 में Mo
2(+1) + x + 4(-2) = 0
2 + x – 8 = 0
x – 6
x = +6 अत: Mo का ऑक्सीकरण अंक + 6 होगा।
(ii) Ni(CN)2+4 में Ni
x + 4 (-1) = -2
x – 4 = -2
x = -2 + 4
x = +2
अतः Ni का ऑक्सीकरण अंक + 2 होगा।
प्रश्न 21.
निम्नलिखित धातुओं को उनके लवणों के विलयन में से विस्थापन की क्षमता के क्रम में लिखिए-
Cr, Cu, Mg, Zn, Fe, Al
उत्तर:
किसी धातु का मानक इलेक्ट्रॉड विभव जितना अधिक ऋणात्मक होगा वह उतना ही अधिक सक्रिय होगा एवं उतना ही अधिक प्रबल अपचायक होगा। इसी कारण किसी अधिक क्रियाशील धातु (सारणी में ऊपर वाला तत्त्व) को कम क्रियाशील धातु (सारणी के नीचे वाला तत्त्व) लवण विलयन में डाल दिया जाये तो वह कम क्रियाशील धातु को विलयन में प्रतिस्थापित कर देगा।
अतः विस्थापन का क्रम निम्न प्रकार से होगा
Mg > Al > Zn > Cr > Fe > Cu
प्रश्न 22.
Zn तथा CuSO4 विलयन के मध्य अप्रत्यक्ष रेडॉक्स अभिक्रिया प्रदर्शित करने वाले विद्युत रासायनिक सेल को चित्रित कीजिए।
उत्तर: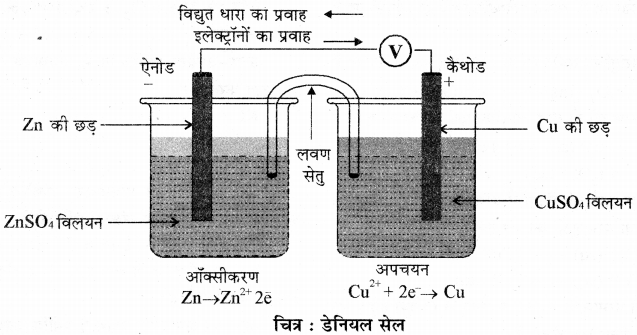
प्रश्न 23.
ऑक्सीकरण तथा अपचयन को परिभाषित कीजिए
(i) इलेक्ट्रोन संकल्पना के आधार पर
(ii) ऑक्सीकरण अंक परिवर्तन के आधार पर।
उत्तर:
(i) जब किसी परमाणु, अणु या आयन में से इलेक्ट्रोन का निष्कासन होकर ऑक्सीकरण अंक में वृद्धि होती है तो उस अभिक्रिया को ऑक्सीकरण कहते हैं। ऑक्सीकरण के धनादेश में वृद्धि अथवा ऋणावेश में कमी होती है।
Mg → Mg2++ 2e–
Zn → Zn2+ + 2e–
2Cl– → Cl2 + 2e–
अपचयन: वह प्रक्रम जिसमें किसी परमाणु, अणु या आयन द्वारा इलेक्ट्रोन ग्रहण किया जाता है उसे अपचयन कहते हैं।
Cl + e– → Cl–
S + 2e– → S2-
Na+ + e– → Na
(ii) ऑक्सीकरण अंक के आधार पर
जब किसी परमाणु, अणु या आयन के ऑक्सीकरण अंक में वृद्धि होती है तो उसे ऑक्सीकरण कहते हैं एवं ऑक्सीकरण अंक में कमी होने पर उसे अपचयन कहते हैं।
प्रश्न 24.
निम्न अभिक्रियाओं में ऑक्सीकारक तथा अपचायक बताइये
(i) H2+O2+ + O3 → H2O + 2O2
(ii) 2Na2S2O3 + I2 → Na2S4O6 + 2Nal
उत्तर:
(i) H2O2 + O3 → H2O + 2O2
H2O2 2(+1) + 2x = 0
2 + 2x = 0
x = 1
अत: H2O2 में ऑक्सीजन का ऑक्सीकरण अंक +1 होता है जो शून्य में परिवर्तित होता है। अतः ऑक्सीकरण अंक में कमी होती है। अतः H2O2 ऑक्सीकारक है एवं ओजोन अपचायक है।
(ii) 2Na2S2O3 + I2 → Na2S4O6 + 2NaI
2(+1) + 2x + 3 (-2) = 0
2 + 2x – 6 = 0
2 + 4 = 0
x = +2
2(+1) + 4x + 6(-2) = 0
2 + 4x – 12 + 0
4x – 10
x = 2.5
अतः सल्फर का ऑक्सीकरण अंक +2 से +2.5 में वृद्धि होती है। अतः Na2S2O3 अपचायक है जबकि आयोडीन का ऑक्सीकरण अंक शून्य से -1 हो जाता है अर्थात् ऑक्सीकरण अंक में कमी होती है।
अतः I2 ऑक्सीकारक है।
प्रश्न 25.
सिल्वर नाइट्रेट विलयन में लोहे की छड़ डालने पर वह चमकीली हो जाती है, कारण बताइए।
उत्तर:
लोहे का मानक इलेक्ट्रोड विभव सिल्वर की अपेक्षा कम होता है अतः यह अधिक सक्रिय एवं अपेक्षाकृत प्रबल अपचायक होता है। इसी कारण अधिक क्रियाशील धातु (लोहा) को कम क्रियाशील धातु के लवण (सिल्वर नाइट्रेट) में डालने पर कम क्रियाशील धातु (सिल्वर) को विलयन में प्रतिस्थापित कर देती है। इसी कारण लोहे की छड़ पर सिल्वर की परत चढ़ने के कारण वह चमकीली हो जाती है।
प्रश्न 26.
KO2 में ऑक्सीजन का ऑक्सीकरण अंक बताइए।
उत्तर:
1(+1) + 2x = 0
1 + 2x = 0
2x = -1
x = -1/2
अत: KO2 में ऑक्सीजन का ऑक्सीकरण अंक -1/2 होता है।
प्रश्न 27.
नाइट्रेट के भूरे वलय परीक्षण में संकुल [Fe(H2O)5 (NO)]SO4 बनता है। इसमें आयरन की ऑक्सीकरण संख्या बताइए।
उत्तर:
[Fe(H2O)5 (NO)]SO4
x + 5(0) + 1(+1) + 1(-2) = 0
x + 2 + 1 – 2 = 0
x – 1 = 0
x = 1
अतः आयरन की ऑक्सीकरण संख्या +1 है।
प्रश्न 28.
निम्नलिखित को आयोडीन की बढ़ती हुई ऑक्सीकरण अवस्था के क्रम में लिखिए-
I2, HI, HIO4, ICI
उत्तर:
I2 = 0
HI:
1(+1) + x = 0
1 + x = 0
x = -1
HIO4 :
1(+1) + x + 4(-2) = 0
1 + x – 8 = 0
X – 7 = 0
x = +7
ICl:
x + 1(-1) = 0
x – 1 = 0
x = 1
HI < I2 < ICI < HIO4
RBSE Class 11 Chemistry Chapter 8 निबन्धात्मक प्रश्न
प्रश्न 29.
ऑक्सीकरण अंक किसे कहते हैं? ऑक्सीकरण अंक परिवर्तन के आधार पर ऑक्सीकरण-अपचयन कैसे ज्ञात किया जाता है? ऑक्सीकरण अंक विधि द्वारा समीकरण संतुलित करने के विभिन्न पद लिखिए।
उत्तर:
किसी यौगिक या तत्त्व के अणु में उपस्थित किसी परमाणु पर स्थित आवेश को उस परमाणु का ऑक्सीकरण अंक कहते हैं।
ऑक्सीकरण – अपचयन प्रक्रियाओं के तत्त्वों के ऑक्सीकरण अंक भी परिवर्तित हो जाते हैं।
ऑक्सीकरण – दिए गए पदार्थ में तत्त्व की ऑक्सीकरण संख्या में वृद्धि को ऑक्सीकरण कहते हैं।
अपचयन: दिए गए पदार्थ में तत्त्व की ऑक्सीकरण संख्या में कमी को अपचयन कहते हैं। जिस तत्त्व के ऑक्सीकरण अंक में परिवर्तन नहीं होता है, उसका न तो ऑक्सीकरण होता है एवं न ही अपचयन होता है। जिस पदार्थ का ऑक्सीकरण होता है उसे अपचायक कहते हैं, अतः अपचायक पदार्थ के ऑक्सीकरण अंकों में वृद्धि हो जाती है एवं जिस पदार्थ का अपचयन होता है उसे ऑक्सीकारक कहते हैं । अतः
ऑक्सीकारक पदार्थ के ऑक्सीकरण अंकों में कमी हो जाती है । सम्पूर्ण प्रक्रिया में कुल ऑक्सीकरण अंकों में कमी एवं कुल ऑक्सीकरण अंकों में वृद्धि समान होती है।
किसी रासायनिक अभिक्रिया में ऑक्सीकरण अंकों के आधार पर ऑक्सीकरण एवं अपचयन का पता निम्न प्रकार से लगाया जा सकता है
- सबसे पहले यौगिक में उपस्थित परमाणुओं के ऑक्सीकरण अंक ज्ञात करते हैं।
- अब सभी तत्त्वों के ऊपर उनके ऑक्सीकरण अंक लिखते हैं।
- अब तत्त्वों के ऑक्सीकरण अंकों में परिवर्तन के आधार पर निष्कर्ष निकालते हैं।
उदाहरण: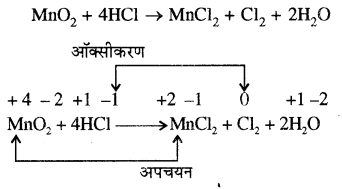
इस अभिक्रिया में Mn का ऑक्सीकरण अंक +4 (MnO2, में) से +2 (MnCl2 में) हो रहा है अत: MnO2 का MnCl2 में अपचयन होता है। जबकि क्लोरीन का ऑक्सीकरण अंक -1 (HCl) से O(Cl2 में) हो रहा है अर्थात् वृद्धि हो रही है। अत: HCl का Cl2 में ऑक्सीकरण हो रहा है। यहाँ MnO2 ऑक्सीकारक है एवं HCl अपचायक।
ऑक्सीकरण-अपचयन अभिक्रियाओं को संतुलित करने की निम्न दो विधियाँ प्रचलित हैं
- आयन-इलेक्ट्रॉन विधि।
- ऑक्सीकरण अंक विधि।
(1) अर्ध अभिक्रिया विधि या आयन इलेक्ट्रॉन विधि (Half Reaction Method or Ion Electron Method):
यह विधि जेट तथा लामर ने दी थी। अपचयोपचय अभिक्रिया को सन्तुलित करने की इस विधि में दोनों अर्द्ध-अभिक्रियाओं को अलग-अलग संतुलित करते हैं तथा बाद में दोनों को जोड़कर संतुलित अभिक्रिया प्राप्त कर लेते हैं। माना कि हमें Fe2+ आयन से Fe3+ आयन में डाइक्रोमेट आयन (Cr2O7)2- द्वारा अम्लीय माध्यम में ऑक्सीकरण अभिक्रिया करानी है, जिसमें Cr2O72- आयनों का Cr3+ आयन में अपचयन होता है। इसके लिए निम्नलिखित पद प्रयुक्त किए जाते हैं-
1. सर्वप्रथम असंतुलित समीकरण को आयनिक रूप में लिखते हैं।
Fe2+(aq) + Cr2O72-(aq) → Fe3+(aq) + cr3+(aq)
2. इस समीकरण को दो अर्द्ध-अभिक्रियाओं में विभक्त करते हैं।
ऑक्सीकरण: Fe2+(aq) → Fe3+(aq)
अपचयन: Cr2O-(aq) → Cr3+(aq)
3. अन्य तत्त्वों के परमाणुओं का सन्तुलन–प्रत्येक अर्द्ध अभिक्रिया में ऑक्सीजन तथा हाइड्रोजन के अतिरिक्त अन्य तत्त्वों के परमाणुओं को संतुलित करते हैं। अपचयन अर्द्धअभिक्रिया में Cr को संतुलित करने के लिए Cr3+ को 2 से गुणा करते हैं। ऑक्सीकरण अर्द्ध-अभिक्रिया में Fe परमाणु पहले ही संतुलित है।
Cr2O72-(aq) → 2cr3+(aq)
4. ऑक्सीजन तथा हाइड्रोजन का सन्तुलन – अम्लीय माध्यम में होने वाली अर्द्ध-अभिक्रिया में ऑक्सीजन परमाणु के संतुलन के लिए H2O तथा हाइड्रोजन परमाणु के संतुलन के लिए H+ जोड़ते हैं।
Cr2O72-(aq) + 14H+ (aq) → 2Cr3+(aq) + 7H2O(l)
5. क्षारीय माध्यम होने पर – अभिक्रिया को पहले तो उसी प्रकार संतुलित करते हैं, जैसे अम्लीय माध्यम में करते हैं। इसके पश्चात् समीकरण के दोनों ओर H+ आयनों की संख्या के बराबर OH– आयन जोड़ देते हैं । H+ तथा OH–
को जोड़कर H20 लिख देते हैं।
6. आवेश का सन्तुलन – अर्द्ध – अभिक्रियाओं में आवेशों को संतुलित करने के लिए आवश्यकतानुसार एक तरफ इलेक्ट्रॉन जोड़ते हैं। दोनों अर्द्ध-अभिक्रियाओं में इलेक्ट्रॉनों की संख्या समान करने के लिए किसी एक को या दोनों को उपयुक्त गुणांक से गुणा करते हैं। आवेश को संतुलित करते हुए ऑक्सीकरण अर्द्ध-अभिक्रिया को पुनः लिखते हैं-
Fe2+(aq) → Fe3+ (aq) + e–
अपचयन अर्द्ध-अभिक्रिया के बायीं ओर 12 धन आवेश हैं, जबकि दाहिनी ओर 6 धन आवेश हैं अत: बायीं ओर 6 इलेक्ट्रॉन जोड़ देते हैं-
Cr2O72- (aq) + 14H+ (aq) + 6e– → 2Cr3+ (aq) + 7H2O(l)
दोनों अर्द्ध-अभिक्रियाओं में इलेक्ट्रॉनों की संख्या समान करने के लिए ऑक्सीकरण अर्द्ध-अभिक्रिया को 6 से गुणा करते हैं।
6Fe2+ (aq) → 6Fe3+ (aq) + 6e–
7. दोनों अर्द्ध-अभिक्रियाओं को जोड़ने पर हमें सम्पूर्ण अभिक्रिया प्राप्त हो जाती है जिसमें दोनों ओर के इलेक्ट्रॉन निरस्त हो जाते हैं।
6Fe2+ (aq) + Cr2O72- (aq) + 14H+ (aq) → 6Fe3+ (aq) + 2Cr3+ (aq) + 7H2O(l)
8. फिर यह सत्यापित कर लेते हैं कि समीकरण के दोनों पक्षों में सभी तत्त्वों के परमाणुओं की संख्या तथा आवेश समान हैं। इससे सिद्ध हो जाता है कि अभिक्रिया पूर्णतः संतुलित है।
प्रश्न 30.
मानक इलेक्ट्रॉड विभव किसे कहते हैं ? मानक इलेक्ट्रॉड विभव का रासायनिक अभिक्रियाओं में क्या महत्त्व हैं? उदाहरण देकर समझाइए।
उत्तर:
मानक इलेक्ट्रोड विभव (Standard Electrode Potential)
किसी धातु की छड़ को 298 K ताप पर 1 वायुमण्डल दाब पर एक मोलर धातु आयन सान्द्रता के विलयन में डुबोने पर धातु विलयन के मध्य उत्पन्न विभवान्तर को उस धातु का मानक इलेक्ट्रोड विभव (E°) कहते हैं।
किसी एक इलेक्ट्रॉड का विभव ज्ञात नहीं किया जा सकता अतः इसे मानक (सन्दर्भ) इलेक्ट्रोड (ज्ञात मान वाला इलेक्ट्रॉड) से जोड़कर ज्ञात करते हैं। यह गणना निम्न प्रकार की जाती हैमानक अपचयन विभव या मानक इलेक्ट्रोड विभव = कैथोड विभव – एनोड विभव
E°cell = E°cathode – E°anode
हाइड्रोजन इलेक्ट्रोड का विभव मानक दशा में शून्य माना जाता है अतः इसे अज्ञात इलेक्ट्रॉड के साथ जोड़कर उसके इलेक्ट्रोड विभव का मान सीधे ही प्राप्त किया जा सकता है। प्रत्येक इलेक्ट्रॉड अभिक्रिया के लिए इलेक्ट्रॉड विभव का मान सक्रिय स्पीशीज की ऑक्सीकृत/ अपचयित अवस्था में रहने की आपेक्षिक प्रवृत्ति का माप है। E° का मान ऋणात्मक होने का अर्थ है कि रेडॉक्स युग्म H°/H2 की तुलना में प्रबल अपचायक है जबकि यह धनात्मक होने पर रेडॉक्स युग्म H+/H2 की तुलना में दुर्बल अपचायक है।
इसकी सहायता से एक इलेक्ट्रॉड का विभव ज्ञात करने के लिए दूसरे इलेक्ट्रॉड का इलेक्ट्रॉड विभव ज्ञात होना चाहिए अतः मानक हाइड्रोजन इलेक्ट्रॉड विभव का इलेक्ट्रॉड विभव का मान स्वेच्छा से शून्य माना गया यदि मानक हाइड्रोजन इलेक्ट्रॉड के सापेक्ष इलेक्ट्रॉड ऋणाग्र बनता है तो इलेक्ट्रॉड विभव ऋण आवेशित होगा तथा धनाग्र बनने पर इलेक्ट्रॉड विभव धनावेशित होता है।
मानक इलेक्ट्रॉड विभव का महत्त्व (Importance of Standard Electrode Potential):
(1) लिथियम के अपचयन विभव का मान निम्नतम होता है। इसमें इलेक्ट्रॉन त्यागने की प्रवृत्ति अधिकतम होती है। अतः यह प्रबल अपचायक है। जबकि फ्लोरीन के अपचयन विभव का मान अधिकतम होने के कारण इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति अधिकतम होती है। अतः यह प्रबलतम ऑक्सीकारक है।
(2) विद्युत रासायनिक श्रेणी से यह स्पष्ट है कि किसी धातु का मानक इलेक्ट्रॉड विभव जितना अधिक ऋणात्मक होता है वह उतना ही अधिक सक्रिय होगा और उतना ही अधिक प्रबल अपचायक भी होगा। इसी कारण यदि किसी अधिक क्रियाशील धातु (सारणी में ऊपर वाला तत्त्व) को कम क्रियाशील धातु के (सारणी में नीचे वाला तत्त्व) लवण विलयन में डाल देते हैं तो वह कम क्रियाशील धातु को विलयन में प्रतिस्थापित कर देगा।
(3) विद्युत रासायनिक श्रेणी में ऊपर आने वाले धातु प्रबल अपचायक होने के कारण उनके धनायनों का धातु रूप में रासायनिक विधि से अपचयन नहीं किया जा सकता है। इसी कारण क्षार धातुओं, क्षार मृदा धातुओं तथा ऐलुमिनियम आदि को विद्युत अपघटनीय अपचयन द्वारा प्राप्त किया जाता है।
अतः इनका E° का मान धनात्मक आता है। उपरोक्त क्रिया कम क्रियाशील धातु को विस्थापित कर देता है।
(4) हाइड्रोजन से ऊपर जाने वाले धातु हाइड्रोजन आयनों का हाइड्रोजन में अपचयन कर देते हैं। इसी कारण धातु अम्लों से क्रिया कर H2 गैस मुक्त करते हैं।
Zn + 2H+ → Zn2+ +H2
Mg + 2H+ → Mg2+ + H2
(5) कोई भी अधातु अपने से ऊपर आने वाले तत्वों को उनके लवण विलयन से विस्थापित कर देती है।
Cl2 + 2Br– → 2Cl– + Br2
(6) वे तत्त्व जो श्रेणी में नीचे की ओर आते हैं, उनकी इलेक्ट्रॉन त्यागने की तुलना में इलेक्ट्रॉन ग्रहण करने की शक्ति अधिक होती है। अर्थात् वे अच्छे ऑक्सीकारक होते हैं। उन धातुओं के धनात्मक आयन H2 का H+ आयनों में ऑक्सीकरण कर देते हैं।
2Au3+ + 3H2 → 2Au + 6H+
(7) सोना एवं चांदी जैसी धातुओं को उनके लवण विलयनों में से अधिक विद्युत धनात्मक धातु Zn, Al आदि द्वारा अवक्षेपित किया जा सकता है।
2Na [Ag(CN)2] + Zn → Na2 [Zn(CN)4] + 2Ag
प्रश्न 31.
निम्नलिखित समीकरणों को सन्तुलित कीजिए तथा उनमें ऑक्सीकारक भी बताइए
(i) H2S + MnO–4 → S + Mn2+ + H2O (अम्लीय माध्यम)
(ii) Cl2O7(g) + H2O2(g) → ClO–2 (जलीय) + O2(g) (क्षारीय माध्यम)
हल:
(i) H2S + MnO–4 → S + Mn+2 + H2O (अम्लीय माध्यम)
अपचयन अर्ध अभिक्रिया।
MnO–4 → Mn+2 (ऑक्सीकारक)
MnO–4 → Mn+2+ 4H0 (ऑक्सीजन का सन्तुलन)
MnO4 + 8H+ → Mn+2 + 4H2O (हाइड्रोजन का H+ आयन द्वारा सन्तुलन)
LHS = 1 x MnO4 + 8 x H+ = 7
RHS = 1 x 2 = + 2
MnO–4 + 8H+2 + 5e– → Mn+2 +4H2O …(1) आवेश का सन्तुलन
2MnO–4 + 16H+ + 10e– → 2Mn+2 + 8H2O ऑक्सीकरण अर्ध अभिक्रिया
H2S → S (अपचायक)
H2S → S + 2H+ हाइड्रोजन का सन्तुलन
H2S → S + 2H+ + 2e– …(2) आवेश का सन्तुलन
समीकरण (1) को 2 से एवं 2 को 5 से गुणा करके दोनों को जोड़ने पर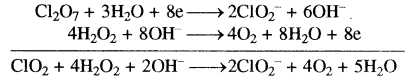
इस अभिक्रिया में MnO–4 ऑक्सीकारक है।
(ii) Cl2O7(g) + H2O2(g) → ClO–2(जलीय) + O2(g) (क्षारीय माध्यम)
प्रथम अर्द्ध अभिक्रिया
Cl2O7 → ClO2– (ऑक्सीकारक)
Cl2O7 → 2ClO2– (Cl को सन्तुलन करना)
Cl2O7 → 2ClO2–+ 3H2O (ऑक्सीजन का सन्तुलन)
Cl2O7 + 6H+ → 2ClO2– + 3H2O (हाइड्रोजन को H+ आयन द्वारा सन्तुलन)
Cl2O7 + 6H+ + 6OH– → 2ClO2– + 3H2O + 6OH– (क्षारीय माध्यम)
Cl2O7 + 6H2O → 2ClO2– + 3H2O + 6OH–
Cl2O7 + 3H2O → 2ClO2– + 6OH–
Cl2O9 + 3H2O + 8e → 2ClO2– + 6OH– …(1) (आवेश का सन्तुलन)
यह ऑक्सीकारक अर्ध समीकरण सन्तुलित है।
ऑक्सीकरण अर्ध समीकरण
H2O2 → O2 (अपचायक)
H2O2 → O2 + 2H+ (हाइड्रोजन को सन्तुलन H+ आयने द्वारा)
H2O2 + 2OH– → O2 + 2H+ 2OH– (क्षारीय माध्यम)
H2O2 + 2OH– → O2 + 2H2O
H2O2 + 2OH– → O2 + 2H2O + 2e …(2) (आवेश का सन्तुलन)
समीकरण (2) को 4 से गुणा करके एवं समीकरण (1) को 1 से गुणा करके समीकरण (1) एवं (2) को जोड़ने पर।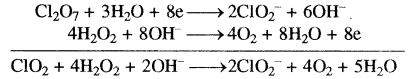
इस अभिक्रिया में H2O अपचायक है।
प्रश्न 32.
आयन इलेक्ट्रॉन विधि द्वारा समीकरण संतुलित करने की विधि के विभिन्न पद लिखिये निम्न समीकरणों को संतुलित कीजिए-
(i) Al + NO3 → Al(OH)2 + NH3 (क्षारीय)
(ii) MnO–4 + Br– → Mn2+ + Br2 (अम्लीय)
हल:
(i) Al + NO–3 → Al(OH)–4 + NH3 (क्षारीय)
समीकरण को दो अर्द्ध अभिक्रियाओं में विभाजित करने पर ऑक्सीकरण अर्द्ध अभिक्रिया
Al → Al(OH)–4 (अपचायक)
Al + 4H2O → Al(OH)–4 (ऑक्सीकरण का सन्तुलन)
Al + 4H2O → Al(OH)–4 + 4H+ (हाइड्रोजन का सन्तुलन)
Al + 4H2O + 4OH– → Al(OH)–4 + 4H+ + 4OH–
Al + 4H2O + 4OH– → Al(OH)–4 + 4H2O
Al + 4OH– → Al(OH)–4 …(1)
अपचयन अर्द्ध अभिक्रिया
NO–3 → NH3 (ऑक्सीकारक)
NO–3 → NH3 + 3H2O
NO–3 + 9H+→ NH3 + 3H2O
NO–3 + 9H+ + 90H+ → NH3 + 3H2O + 90H–
NO–3 + 9H2O → NH3 + 3H2O + 90H–
NO–3 + 6H2O → NH3 + 90H–
NO–3+ 6H2O + 8e– → NH3 + 90H– …(2)
समीकरण (1) को 8 से गुणा करके समीकरण (1) एवं (2) को जोड़ने पर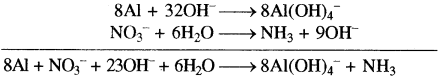
(ii) MnO–4 + BO– → Mn2+ + Br2 (अम्लीय)
इस समीकरण को दो अर्द्ध अभिक्रियाओं में विभक्त करते हैं।
ऑक्सीकरण अर्द्ध अभिक्रिया
Br– → Br2
2Br– → Br2
2Br– → Br2 + 2e– …(1)
अपचयन अर्द्ध अभिक्रिया
MnO4–→ Mn2+
MnO4– → Mn2+ + 4H2O
MnO4– + 8H+ → Mn2+ 4H2O
MnO4– + 8H+ + 5e– → Mn2+ + 4H2O …(2)
समीकरण (1) को 5 से एवं समीकरण (2) को 2 से गुणा करके जोड़ने पर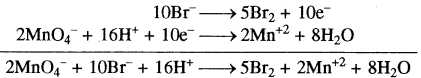
प्रश्न 33.
निम्न अभिक्रियाओं को प्रदर्शित करने वाले गेल्वेनिक सेल का चित्र बनाइए।
Zn + 2Ag+ → Zn2+ + 2Ag
इसके आधार पर निम्न उत्तर भी दीजिए
(i) प्रत्येक इलेक्ट्रॉड पर होने वाली अभिक्रिया का समीकरण दीजिए।
(ii) बाह्य परिपथ में इलेक्ट्रॉनों का प्रवाह किस ओर होगा?
(iii) एनोड तथा केथोड़ बताइए।
(iv) यदि E°Zn2+/Zn = -0.76 तथा E°Ag1+/Ag = +.80 वोल्ट हो तो क्या WE° = 1.56 वोल्ट होगा।
उत्तर:
IMG
Zn(S) + 2Ag+ → Zn+2+ 2Ag
Zn(S) /Zn2+(aq) // 2Ag+(aq) /2Ag(S)
(i) बायें इलेक्ट्रोड पर
Zn(S) → Zn+2 + 2e– ऑक्सीकरण
दायें इलेक्ट्रोड पर
2Ag+ + 2e– → 2Ag(S) अपचयन
(ii) बाह्य परिपथ में इलेक्ट्रॉन का प्रवाह Zn से सिल्वर इलेक्ट्रॉड की तरफ होता है।
(iii) यहाँ Zn एनोड का कार्य करता है एवं सिल्वर कैथोड का कार्य करता है।
(iv) E°net = E°Ox + E°red
E°net = E°Zn + E°Ag
E°net = (+ 0.76 V) + (+ 0.80) = 1.56 V.
प्रश्न 34.
विद्युत रासायनिक श्रेणी किसे कहते हैं? धात्त्विक तत्त्व A, B, C तथा D का इलेक्ट्रॉड अपचयन विभव क्रमशः + 0.79, – 0.74, 1.08 तथा -0.31 वोल्ट है। इन्हें बढ़ती क्रियाशीलता के क्रम में जमाइये। 1M HCl अम्ल को रखने के लिए ऐलुमिनियम तथा चाँदी के पात्रों में से कौन अधिक उपयुक्त होगा?E°Al3+/Al = -1.66 V तथा E°Ag+/Ag = + 0.80(v)
उत्तर:
विद्युत रासायनिक अभिक्रियाओं में विभिन्न इलेक्ट्रॉडों पर होने वाली अर्द्ध-अभिक्रियाओं के मानक इलेक्ट्रॉड विभव मानो को घटते हुए क्रम में व्यवस्थित करने पर जो श्रेणी प्राप्त होती है उसे विद्युत रासायनिक श्रेणी कहते हैं।
A = + 0.79 वोल्ट
B = – 0.74 वोल्ट
C = 1.08 वोल्ट
D = – 0.31 वोल्ट
क्रियाशीलता का क्रम B > D> A > C
HCl के विलयन 1M को रखने के लिए Ag का पात्र उपयुक्त है। क्योंकि यह हाइड्रोजन से कम क्रियाशील है अतः यह HCl से क्रिया, नहीं करेगा।
प्रश्न 35.
निम्नलिखित समीकरणों को आयन इलेक्ट्रॉन विधि द्वारा संतुलित कीजिए-
(i) MnO4– + SO32- → Mn2+ + SO42-
(ii) Cr2O72- + H+ + I– → Cr3+ + H2O + I2 (अम्लीय माध्यम में)
(iii) Cl2 + OH– → Cl– + ClO3–
(iv) N2H4 + ClO3– → NO + Cl– (अम्लीय माध्यम में)
हल:
(i) MnO4– + SO32- → Mn2+ + SO42-
MnO4– → Mn+2
MnO4– → Mn+2 + 4H2O
MnO4– + 8H+ → Mn+2+ 4H2O …..(1)
SO3-2 → SO4-2
SO3-2 + H2O → SO4-2
SO3-2 + H2O → SO4-2 + 2H+
SO3-2 + H2O → SO4-2 + 2H+2e …(2)
समीकरण (1) को 2 से एवं समीकरण (2) को 5 से गुणा करके जोड़ने पर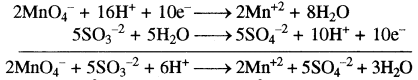
(ii) Cr2O72- + H+ + I– → Cr3+ + H2O + I2 (अम्लीय माध्यम में)
Cr2O72-→ Cr+3
Cr2O72- → 2Cr+3
Cr2O72-→ 2Cr+3 + 7H2O
Cr2O72- + 14H+ → 2Cr+3 + 7H2O
Cr2O72- + 14H++ 6e– → 2Cr+3 + 7H2O ……(1)
I– → I2
2I– → I2
2I– → I2 + 2e– …(2)
समीकरण (1) को 1 से एवं समीकरण (2) को 3 से गुणा करके जोड़ने पर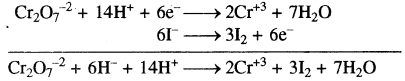
(iii) Cl2 + OH– → Cl– + ClO3–+ H2O
ऑक्सीकरण अर्द्ध अभिक्रिया
Cl2 → ClO3–
Cl2 → 2ClO3–
Cl2 + 6H2O → 2ClO3–
क्षारीय माध्यम में होने पर
Cl2 + 6H2O + 12OH– → 2ClO3– + 12H2O
Cl2 + 6H2O + 12OH– → 2ClO3– + 12H2O + 10e– …(1)
अपचय अर्द्ध अभिक्रिया
Cl2 → Cr–
Cl2 → 2Cl–
Cl2 + 2e → 2Cl–
समीकरण (2) को 5 से गुणा करके समीकरण (1) एवं (2) को जोड़ने पर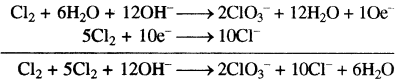
(iv) N2H4 + ClO3– → NO + Cl– (अम्लीय माध्यम में)
आयन इलेक्ट्रॉन विधि-इसमें ऑक्सीकरण अर्ध-अभिक्रिया निम्नलिखित है-
N2H4(l)
N2H4 → 2NO(g) (नाइड्रोजन का संतुलन)
N2H4 + 2H2O → 2NO (ऑक्सीजन का संतुलन)
N2H4 + 2H2O → 2NO + 8H+ (हाइड्रोजन का संतुलन)
N2H4 + 2H2O + 8OH– → 2NO + 8H+ + 8OH–
(क्षारीय माध्यम के लिए OH– का प्रयोग)
अथवा
N2H4 + 8OH– → 2NO + 6H2O
N2H4 + 8OH– → 2NO + 6H2O + 8e– (आवेश का संतुलन) …..(a)
अपचयन की अर्ध-अभिक्रिया निम्नलिखित है-
ClO3– (aq) → Cr(aq)
ClO3– → Cl– + 3H2O (ऑक्सीजन का संतुलन)
ClO3– + 6H+ → Cl– + 3H2O (हाइड्रोजन का संतुलन)
ClO3–+ 6H+ + 6OH– → Cl– + 3H2O + 6OH– (OH– का प्रयोग)
अथवा ClO3–+ 3H2O → Cl– + 6OH–
ClO3–+ 3H2O + 6e– → Cl– + 6OH– (आवेश का संतुलन) …..(b)
समीकरण (a) को 3 से तथा समीकरण (b) को 4 से गुणा करके दोनों को जोड़ने पर
3N2H4 + 24OH → 6NO + 18 H2O + 24e–
4ClO3– + 12H2O+ 24e– → 4Cl– + 24OH–
3N2H4(l) + 4ClO3– (aq) → 6NO(g) + 4Cl–(aq) + 6H2O(l) (संतुलित समीकरण)
ऑक्सीकरण संख्या विधि –![]()
N के ऑक्सीकरण अंक में कुल वृद्धि = 2 x 4 = 8
Cl के ऑक्सीकरण अंक में कुल कमी = 1 x 6 = 6
अत: N2H4 को 3 से तथा ClO3– को 4 से गुणा करने पर
3N2H4 + 4ClO3– → NO + Cl
N तथा Cl को संतुलित करने पर
3N2H4 + 4ClO3– → 6NO + 4Cl–
ऑक्सीजन को संतुलित करने के लिए अभिक्रिया के दाहिनी तरफ 6H2O जोड़ते हैं तो हाइड्रोजन अपने आप संतुलित हो जाती है-
3N2H4(l) + 4ClO3– (aq) → 6NO(g) + 4Cl– (aq) + 6H2O(l)
प्रश्न 36.
आयन इलेक्ट्रॉन विधि द्वारा निम्न अभिक्रियाओं को संलित कीजिए
(i) NO3–+ H+ + I– → NO + I2 + H2O
(ii) CrO42- + OH– + SO32- → CrO2– + SO42-
(iii) MnO4– + Fe3O4 + OH– → Fe3O4 + MnO2
(iv) P4 + OH– → PH3 + H2PO2–
हल:
(i) NO3–+ H+ + I– → NO + I2 + H2O
NO3– → NO
NO3– → NO + 2H2O
NO3– + 4H+ → NO + 2H2O
NO3– + 4H+ + 3e → NO + 2H2O …..(1)
I– → I2
2I– → I2
2I– → I2+ 2e ……(2)
समीकरण (1) को 2 से एवं समीकरण (2) को 3 से गुणा करके आपस में जोड़ने पर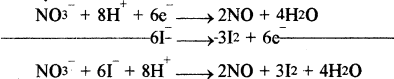
(ii) CrO42- + OH– + SO32- → CrO2– + SO42-
अभिक्रिया को दो अर्द्ध अभिक्रियाओं में विभक्त करने पर
CrO42- → CrO2–
CrO42- → CrO2– + 2H2O
CrO42- + 4H+ → CrO2– + 2H2O
CrO42- + 4H+ + 4OH– → CrO2– + 2H2O + 4OH–
CrO42- + 4H2O → CrO2– + 2H2O + 4OH–
CrO42- + 2H2O → CrO2– + 4OH–
CrO42- + 2H2O + 3e– → CrO2– + 4OH⊝ …(1)
SO32- → SO42-
SO32- + H2O → SO42-
SO32- + H2O → SO42- + 2H+
SO32- + H2O + 2OH⊝ → SO42- + 2H+ + 2OH⊝
SO32- + H2O + 2OH– → SO42- + 2H2O
SO32- + 2OH– → SO42- + H2O
SO32- + 2OH– → SO42- + H2O + 2e– …(2)
समीकरण (1) को 2 से एवं (2) को 3 से गुणा करके जोड़ने पर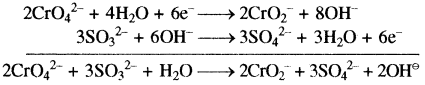
(iii) MnO4– + Fe3O4 + H2O → Fe2O3 + MnO2
MnO4– → MnO2
MnO4– → MnO2 + 2H2O
MnO4– + 4H+→ MnO2 + 2H2O
MnO4– + 4H+ + 4OH⊝ → MnO2 + 2H2O + 4OH–
MnO4– + 4H2O → MnO2 + 2H2O + 4OH–
MnO4–+ 2H2O → MnO2 + 4OH–
MnO4– + 2H2O + 3e– → MnO2 + 4OH– … (1)
Fe3O4 → Fe2O3
2Fe3O4 → 3Fe2O3
2Fe3O4 + H2O → 3Fe2O3
2Fe3O4 + H2O → 3Fe2O3 + 2H+
2Fe3O4 + H2O + 2OH– → 3Fe2O3+ 2H+ + 2OH–
2Fe3O4 + H2O + 2OH⊝ → 3Fe2O3+ 2H2O
2Fe3O4 + 2OH– → 3Fe2O3+ H2O
2Fe3O4 + 2OH– → 3Fe2O3 + H2O + 2e …….(2)
समीकरण (1) को 2 से एवं समीकरण (2) को 3 से गुणा करके
समीकरण (1) को एवं 2 जोड़ने पर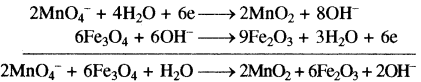
(iv) P4 + OH– → PH3+ H2PO2–
ऑक्सीकरण अर्द्ध अभिक्रिया
P → H2PO2–
P + 2H2O → H2PO2–
P + 2H2O → H2PO2– + 2H+
P + 2H2O + 2OH– → H2PO2–+ 2H+ + 2OH–
P + 2H2O + 2OH– → H2PO2– + 2H2O
P + 2OH– → H2PO2–
P + 2OH–→ H2PO2–+ e– …(1)
अपचयन अर्द्ध अभिक्रिया
P→ PH3
P + 3H+ → PH3
P+ 3H+ + 3OH– → PH3 + 3OH–
P + 3H+ + 3OH– + 3e– → PH3 + 3OH–
P + 3H2O + 3e– → PH3 + 3OH– …(2)
समीकरण (1) को 3 से गुणा करके समीकरण (2) में जोड़ने पर।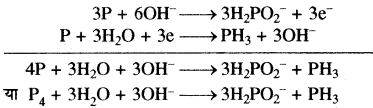
प्रश्न 37.
निम्नलिखित समीकरणों को आयन इलेक्ट्रॉन विधि द्वारा सन्तुलित कीजिए-
(i) MnO4– + H2O2 → MnO2 + O2 + OH–
(ii) ASO3-3 + I2 + H2O → ASO4-3 + H+ + I–
(iii) Cl2O7 + H2O2 → CrO2– + O2 + H+
(iv) Cr2O7-2 + SO2 → Cr+3 + SO4-2
हल:
(i) MnO4– + H2O2 → MnO2 + O2 + OH–
अभिक्रिया को ऑक्सीकरण एवं अपचयन अर्द्ध अभिक्रिया में विभाजित करने पर।
अपचयन अर्द्ध अभिक्रिया समीकरण
MnO4– → MnO2
MnO4– → MnO2 + 2H2O
MnO4– + 4H+ → MnO2 + 2H2O
MnO4– + 4H+ + 4OH– → MnO2 + 2H2O + 4OH–
MnO4– + 4H2O → MnO2 + 2H2O + 4OH–
MnO4– + 2H2O → MnO2 + 4OH–
MnO4–+ 2H2O + 3e– → MnO2 + 4OH– …(1)
ऑक्सीकरण अर्द्ध अभिक्रिया
H2O2 → O2
H2O2 → 2H+ + O2
H2O2 + 2OH–→ 2H+ + 2OH– + O2
H2O2 + 2OH– → 2H2O + O2
H2O2 + 2OH– → 2H2O +O2 + 2e– …(2)
समीकरण (1) को 2 से एवं समीकरण (2) को 3 से गुणा करके आपस में जोड़ने पर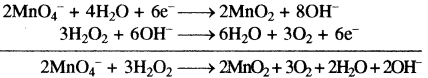
(ii) ASO3-3 + I2 + H2O → ASO4-3 + H+ + I–
ऑक्सीकरण एवं अपचयन अर्द्ध अभिक्रिया में विभाजित करने पर ऑक्सीकरण अर्द्ध अभिक्रिया
ASO3-3 → ASO4-3
ASO3-3 + H2O → ASO4-3
ASO3-3 + H2O → ASO4-3 + 2H+
ASO3-3 + H2O → ASO4-3 + 2H++ 2e– …(1)
अपचयन अर्द्ध अभिक्रिया
I2 → I–
I2 → 2I–
I2 + 2e– → 2I–
समीकरण (1) एवं (2) को जोड़ने पर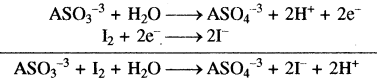
(iii) Cl2O7 + H2O2 → CrO2– + O2 + H+
ऑक्सीकरण एवं अपचयन अर्द्ध अभिक्रिया में विभाजित करने पर
अपचयन अर्द्ध अभिक्रिया
Cl2O7 → ClO2–
Cl2O7 → 2ClO2–
Cl2O7 → 2ClO2– + 3H2O
Cl2O7 + 6H+ → 2ClO2– + 3H2O
Cl2O7 + 6H+ + 8e– → 2ClO2– + 3H2O …(1)
ऑक्सीकरण अर्द्ध अभिक्रिया
H2O2 → O2
H2O2 → O2 + 2H+
H2O2 → O2 + 2H++ 2e– …(2)
समीकरण (2) को 4 से गुणा करके समीकरण (1) एवं (2) को जोड़ने पर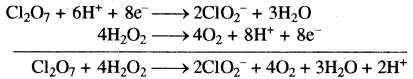
(iv) Cr2O7-2 (aq) + SO2 (aq) (aq) → Cr+3 (aq) + SO4-2(aq) (अम्लीय माध्यम)
इस अभिक्रिया में ऑक्सीकरण की अर्ध-अभिक्रिया निम्नलिखित है-
SO2 (aq) → SO4-2 (aq)
SO2 + 2H2O → SO4-2 (ऑक्सीजन का संतुलन)
SO2 + 2H2O → SO4-2 + 4H+ (हाइड्रोजन का संतुलन)
SO2 + 2H2O → SO4-2 + 4H+ + 2e– (आवेश का संतुलन) …(a)
अपचयन की अर्ध-अभिक्रिया निम्नलिखित है-
Cr2O7-2(aq) → Cr3+ (aq)
Cr2O7-2 → 2Cr3+ (क्रोमियम का संतुलन)
Cr2O7-2 → 2Cr3+ + 7H2O (ऑक्सीजन का संतुलन)
Cr2O7-2(aq) + 14H+ → 2Cr3++ 7H2O (हाइड्रोजन का संतुलन)
Cr2O7-2 + 14H++ 6e– → 2Cr3+ + 7H2O (आवेश का संतुलन) …(b)
समीकरण (a) को 3 से गुणा करके समीकरण (b) में जोड़ने पर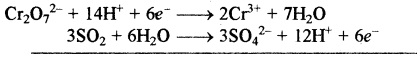
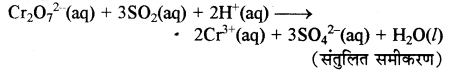
प्रश्न 38.
निम्नलिखित यौगिकों में ऑक्सीकरण अंक ज्ञात कीजिए –
(i) FeSO4 में (Fe) का
(ii) Fe(CO)5 में (Fe) का
(iii) H2PO3 में P को
(iv) H2S2O7 में S का
(v) C12H22O11 में C का
(vi) NaH2PO2 में P का
उत्तर:
(i) FeSO4 में (Fe) का
x + 6 + 4(-2) = 0
x + 6 – 8 = 0
x – 2
x = +2
(ii) Fe(CO)5 में (Fe) का
x + 5(0) = 0
x = 0
(iii) H2PO3 में P का
3(+1) + x + 3(-2) = 0
3 + 1 – 6 = 0
x = +3
(iv) H2S2O7 में S का
2(+1) + 2x + 7(-2) = 0
2 + 2x – 14 = 0
2x – 12 = 0
x = +6
(v) C12H22O11
12x + 22(+1) + 11(-2) = 0
12x + 22 – 22 = 0
12x = 0
x = 0
(vi) NaH2PO2 में P का
1 + 2(+1) + x + 2(-2) = 0
1 + 2 + 1 – 4 = 0
x – 1 = 0
x = +1
प्रश्न 39.
निम्नलिखित में से ऑक्सीकारक तथा अपचायक पहचानिए
(i) 3I2 + 6NaOH → NaIO3 + 5NaI + 3H2O
(ii) AlCl3 + 3K → Al + 3KCl
(iii) SO2 + 2H2S → 3S + 2H2O
(iv) SnCl2 + 2FeCl3 → SnCl4 + 2FeCl2
(v) H2O2 + H2O2 → 2H2O + O2
उत्तर:
(i) 3I2 + 6NaOH → NaIO3 + 5NaI + 3H2O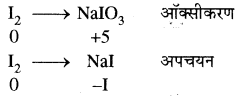
अतः यहाँ , ऑक्सीकारक एवं अपचायक दोनों का कार्य करता है।
(ii) AlCl3 + 3K → Al + 3KCl
अतः AlCl3 ऑक्सीकारक है एवं K अपचायक है।
(iii) SO2 + 2H2S → 3S + 2H2O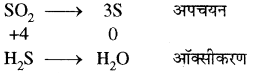
अतः SO2 ऑक्सीकारक है एवं H,S अपचायक है।
(iv) SnCl2 + 2FeCl3 → SnCl4 + 2FeCl2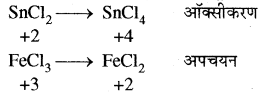
अतः SnCl2 अपचायक है एवं FeCl3 ऑक्सीकारक है।
(v) H2O2 + H2O2 → 2H2O + O2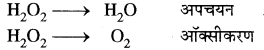
इस अभिक्रिया में H2O2 ऑक्सीकारक एवं अपचायक दोनों का कार्य करता है।
प्रश्न 40.
निम्नलिखित अभिक्रियाओं में H2O2 क़िसमें ऑक्सीकारक तथा किसमें अपचायक का कार्य करता है?
(i) 2KI + H2O2 → 2KOH + I2
(ii) Cl2 + H2O2 → 2HCl + O2
उत्तर:
(i) 2KI + H2O2 → 2KOH + I2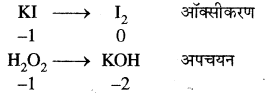
अतः इस अभिक्रिया में H2O2 ऑक्सीकारक का कार्य करता है।
(ii) Cl2 + H2O2 → 2HCl + O2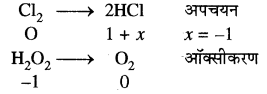
इसमें H2O2 अपचायक का कार्य करता है।
All Chapter RBSE Solutions For Class 11 Chemistry Hindi Medium
—————————————————————————–
All Subject RBSE Solutions For Class 11 Hindi Medium
*************************************************
————————————————————
All Chapter RBSE Solutions For Class 11 Chemistry Hindi Medium
All Subject RBSE Solutions For Class 11 Hindi Medium
Remark:
हम उम्मीद रखते है कि यह RBSE Class 11 chemistry Solutions in Hindi आपकी स्टडी में उपयोगी साबित हुए होंगे | अगर आप लोगो को इससे रिलेटेड कोई भी किसी भी प्रकार का डॉउट हो तो कमेंट बॉक्स में कमेंट करके पूंछ सकते है |
यदि इन solutions से आपको हेल्प मिली हो तो आप इन्हे अपने Classmates & Friends के साथ शेयर कर सकते है और HindiLearning.in को सोशल मीडिया में शेयर कर सकते है, जिससे हमारा मोटिवेशन बढ़ेगा और हम आप लोगो के लिए ऐसे ही और मैटेरियल अपलोड कर पाएंगे |
आपके भविष्य के लिए शुभकामनाएं!!