हेलो स्टूडेंट्स, यहां हमने राजस्थान बोर्ड Class 11 Chemistry Chapter 1 रसायन विज्ञान की मूल अवधारणाएँ सॉल्यूशंस को दिया हैं। यह solutions स्टूडेंट के परीक्षा में बहुत सहायक होंगे | Student RBSE solutions for Class 11 Chemistry Chapter 1 रसायन विज्ञान की मूल अवधारणाएँ pdf Download करे| RBSE solutions for Class 11 chemistry notes will help you.
Table of Contents
Rajasthan Board RBSE Class 11 Chemistry Chapter 1 रसायन विज्ञान की मूल अवधारणाएँ
RBSE Class 11 Chemistry Chapter 1 पाठ्यपुस्तक के अभ्यास प्रशन
RBSE Class 11 Chemistry Chapter 1 वस्तुनिष्ठ प्रश्न
प्रश्न 1.
संख्या 0.0287 में सार्थक अंक है –
(अ) 5
(ब) 2
(स) 3
(द) 4
प्रश्न 2.
ग्लूकोस अणु का आणविक द्रव्यमान होगा –
(अ) 342 u
(ब) 110 u
(स) 90 u
(द) 180 u
प्रश्न 3.
मानक ताप एवं दाबे पर 2 ग्राम मेथेन का आयतन होगा –
(अ) 2.8L
(ब) 5.6L
(स) 11.2L
(द) 22.4L
प्रश्न 4.
मानक ताप व दाब पर किसी आदर्श गैस के 1 ml में उपस्थित अणुओं की संख्या होगी –
(अ) 6.023 x 1023
(ब) 2.69 x 1019
(स) 2.69 x 1023
(द) 4.58 x 1026
प्रश्न 5.
निम्नलिखित में से किसका भार न्यूनतम है –
(अ) सिल्वर का 108 ग्राम
(ब) सल्फर का 1 मोल
(स) नाइट्रोजन का 1 ग्राम परमाणु
(द) कार्बन के 3.011 x 1023 परमाणु
उत्तरमाला:
1. (स)
2. (द)
3. (अ)
4. (ब)
5. (द)
RBSE Class 11 Chemistry Chapter 1 अतिलघूत्तरात्मक प्रश्न
प्रश्न 6.
S.I. पद्धति में पदार्थ की मात्रा की इकाई तथा उसका संकेत क्या है?
उत्तर:
S.I. पद्धति में पदार्थ की मात्रा की इकाई मोल है तथा इसका संकेत mol है।
प्रश्न 7.
भार 8.0 ग्राम और 8.000 ग्राम में क्या अन्तर है?
उत्तर:
भार 8.0 ग्राम में दो सार्थक अंक हैं, जबकि 8.000 में चार सार्थक अंक हैं। इसका तात्पर्य यह है कि प्रथम मापन की तुलना में द्वितीय मापन अधिक यथार्थ है।
प्रश्न 8.
3600 ग्राम को तीन सार्थक अंकों वाली संख्या में व्यक्त कीजिए।
उत्तर:
3600 ग्राम को 3.60 x 103 के रूप में लिखने पर इसमें तीन सार्थक अंक हैं।
प्रश्न 9.
20 ग्राम हाइड्रोजन में हाइड्रोजन के कितने ग्राम अणु उपस्थित हैं?
उत्तर:
हाइड्रोजन (H2) का अणुभार = 2
अतः 20 ग्राम हाइड्रोजन में ग्राम अणु
प्रश्न 10.
64 ग्राम ऑक्सीजन में अणुओं की संख्या कितनी। होगी?
उत्तर:
ऑक्सीजन (O2) का अणु भार = 2 x 16 = 32
अतः ऑक्सीजन के मोल = (frac { 64 }{ 32 } ) = 2
इसलिए अणुओं की संख्या = 2 x 6.023 x 1023 = 1.2046 x 1024
प्रश्न 11.
H2SO4 का तुल्यांकी भार ज्ञात करो, यदि इसका अणुभार 98 है।
उत्तर:
अम्ल का तुल्यांकी भार = अणुभार/क्षारकता
H2SO4 की क्षारकता = 2, अतः तुल्यांकी भार = (frac { 98 }{ 2 } ) = 49
प्रश्न 12.
आवोगाद्रो नियम क्या है?
उत्तर:
समान ताप और दाब पर भिन्न-भिन्न गैसों के समान आयतन में अणुओं की संख्या समान होती है, इसे आवोगाद्रो नियम कहते हैं।
प्रश्न 13.
0.1 मोल C6H12O6 में कार्बन के कितने परमाणु होंगे?
उत्तर:
0.1 मोल C6H12O6 में कार्बन के परमाणुओं की संख्या
= 0.1 x 6 x 6.023 x 1023
= 3.6138 x 1023
प्रश्न 14.
सार्थक अंक किसे कहते हैं?
उत्तर:
सार्थक अंक वे अर्थपूर्ण अंक होते हैं, जो निश्चित रूप से ज्ञात हों।
प्रश्न 15.
गैस की परमाणुकता किसे कहते हैं?
उत्तर:
किसी तात्विक गैस के एक अणु में उपस्थित परमाणुओं की संख्या को उसकी परमाणुकता कहते हैं। जैसे हाइड्रोजन की परमाणुकता दो है।
प्रश्न 16.
36 ग्राम जल में उपस्थित इलेक्ट्रॉनों की संख्या ज्ञात कीजिए।
उत्तर:
36 ग्राम जल = (frac { 36 }{ 18 } ) = 2 मोल
अणुओं की संख्या = मोल x आवोगाद्रो संख्या = 2 x 6.023 x 1023 = 0%
जल के एक अणु में इलेक्ट्रॉनों की संख्या = 10
अतः इलेक्ट्रॉनों की संख्या = 2 x 6.023 x 1023 x 10
= 1.2046 x 1024
प्रश्न 17.
अणुभार से आपका क्या तात्पर्य है?
उत्तर:
किसी पदार्थ के अणुसूत्र के संघटक परमाणुओं के सापेक्षिक द्रव्यमान का योग अणुभार होता है।
प्रश्न 18.
एक मोल जल जिसमें 50% भारी पानी (D2O) है, का द्रव्यमान कितना होगा?
उत्तर:
मोल जल (H2O) का द्रव्यमान = 2 + 16 = 18 ग्राम लेकिन इसमें 50% भारी पानी है जिसका द्रव्यमान (D2O) = 4 + 16 = 20 ग्राम
अत: इसका वास्तविक द्रव्यमान = (frac { 20 +18 }{ 2 } ) = 19 ग्राम दोनों का औसत होगा।
प्रश्न 19.
मानक ताप और दाब से क्या तात्पर्य है?
उत्तर:
273 K ताप तथा एक वायुमण्डलीय दाब को मानक ताप और दाब कहते हैं।
प्रश्न 20.
मानक ताप और दाब पर x मिली N2 गैस तथा x मिली। O2 गैस पूर्णतः क्रिया कर गैस A बनाती है। यदि क्रिया के पश्चात् आयतन अपरिवर्तित रहे तो A का अणुसूत्र क्या होगा?
उत्तर:
N2 गैस तथा O2 के मध्य अभिक्रिया में दोनों का समान आयतन क्रिया कर रहा है तथा क्रिया के पश्चात् आयतन अपरिवर्तित रहता है, अतः अभिक्रिया निम्न प्रकार होगी तथा गैस A का अणुसूत्र NO होगा।
N2 = O = 2NO
RBSE Class 11 Chemistry Chapter 1 लघूत्तरात्मक प्रश्न
प्रश्न 21.
निम्नलिखित में प्रत्येक के 1 मोल का भार क्या है?
(i) NaCl
(ii) CaCO3
उत्तर:
(i) NaCl के 1 मोल का भार = 23 + 35.5 = 58.5 ग्राम
(ii) CaCO3 के 1 मोल का भार = 40 + 12 + (3 x 16) = 100 ग्राम
प्रश्न 22.
निम्नलिखित के सार्थक अंक ज्ञात करो –
(i) 0.00468
(ii) 753
उत्तर:
(i) 0.00468 में सार्थक अंक = 3
(ii) 753 में सार्थक अंक = 3
प्रश्न 23.
निम्नलिखित में प्रत्येक के 2 मोल का क्या भार है?
(i) MgSO4
(ii) KCI
उत्तर:
(i) MgSO4 के 2 मोल का भार
= 2[24 + 32 + (4x 16)]
= 2(24 + 32 + 64)
= 2(120)
= 240
(ii) KCI के 2 मोल का भार = 2(39 + 35.5)
= 2 x (74.5)
= 149
प्रश्न 24.
निम्नलिखित में से प्रत्येक में कितने सार्थक अंक हैं?
(i) 0.868
(ii) 3.865 x 104
उत्तर:
(i) 3
(ii) 4
प्रश्न 25.
मोल किसे कहते हैं? समझाइए।
उत्तर:
किसी निकाय में पदार्थ की वह मात्रा एक मोल के बराबर होती है, जिसमें कणों की संख्या उतनी ही होती है, जितनी 0.012 kg C में उपस्थित कार्बन परमाणुओं की संख्या होती है।
प्रश्न 26.
सीमान्त अभिकर्मक किसे कहते हैं? उदाहरण सहित समझाइए।
उत्तर:
किसी अभिक्रिया के संतुलित समीकरण के अनुसार आवश्यक अभिकर्मकों में से एक अभिकर्मक आवश्यक मात्रा से कम मात्रा में होता है तो उसके समाप्त होते ही अभिक्रिया रुक जाती है उसे सीमान्त अभिकर्मक कहते हैं।
उदाहरण:
अभिक्रिया – 2H2(g) + O2(g) → 2H2O (1) में H2 तथा O2, के प्रत्येक के 2 मोल लेकर विद्युत स्फुलिंग प्रवाहित की जाती है तो उपरोक्त समीकरण के अनुसार जल प्राप्त होगा। यहाँ H2 के 2 मोल O2 के केवल 1 मोल से क्रिया कर 2 मोल H2O बनाते हैं तथा O2, का एक मोल बच जाता है। इस स्थिति में H2 सीमान्त अभिकारक होगा क्योंकि इसकी मात्रा उत्पाद की मात्रा को निर्धारित कर रही है। अतः सीमान्त अभिकारक क्रियाकारी पदार्थों में से वह पदार्थ होता है जो अभिक्रिया के पूर्णतः सम्पन्न होने पर पूर्ण रूप से प्रयुक्त हो जाता है।
प्रश्न 27.
यौगिक के तुल्यांकी भार ज्ञात करने के सूत्र दीजिए।
उत्तर:
तुल्यांकी भार ज्ञात करने के सूत्र निम्नलिखित हैं –
प्रश्न 28.
मोलरता, नार्मलता एवं मोललता को परिभाषित कीजिए।
उत्तर:
- मोलरता (M): एक लिटर विलयन में घुले हुए विलेय के मोलों की संख्या को विलयन की मोलरता कहते हैं।
- नार्मलता (N): विलेय के ग्राम तुल्यांकों की संख्या, जो एक लिटर विलयन में घुली होती है, उसे विलयन की नार्मलता कहते हैं।
- मोललता (m): 1 Kg (1000 g) विलायक में उपस्थित विलेय के मोलों की संख्या को उस विलयन की मोललता कहते हैं।
प्रश्न 29.
निम्नलिखित के सूत्र लिखकर उनके अणुभार ज्ञात कीजिए –
(i) कैल्शियम कार्बोनेट
(ii) मैग्नीशियम फॉस्फेट
(iii) फैरिक क्लोराइड।
उत्तर:
(i) कैल्शियम कार्बोनेट का सूत्र CaCO3 होता है तथा इसका अणुभार
= 40 + 12 + (3 x 16)
= 40 + 12 + 48 = 100
(ii) मैग्नीशियम फॉस्फेट का सूत्र Mg3(PO)4 होता है तथा अणुभार
= (3 x 24) + 3[31 + (4 x 16)]
= 72 + 3(31 + 64)
= 72 + 3(95)
= 72 + 285
= 357
(iii) फैरिक क्लोराइड का सूत्र FeCl3 होता है तथा इसका अणुभार
= 56 + (3 x 35.5)
= 56 + 106.5
= 162.5
प्रश्न 30.
निम्नलिखित में प्रत्येक के कितने मोल हैं?
(i) 100g CaCO3
(ii) 80g O2
(iii) 10g C12H22O11
उत्तर:
(i) CaCO का अणुभार = 100
अतः 100g CaCO3 के मोल = (frac { 100 }{ 100 } ) = 1
(ii) O2 का अणुभार = 32
अत: 80g O2, के मोल = (frac { 80 }{ 32 } ) = 2.5
(iii) C12H22O11 का अणुभार = 342
अतः 10g C12H22O11 के मोल = (frac { 10 }{ 342 } ) = 0.029
प्रश्न 31.
निम्नलिखित के सूत्र लिखकर उनके अणुभार ज्ञात कीजिए –
(i) अमोनियम ऑक्सेलेट
(ii) सोडियम सल्फेट
(iii) एल्यूमिनियम नाइट्रेट।
उत्तर:
(i) अमोनियम ऑक्सेलेट का सूत्र = (NH4)2 C2O4
अणुभार = [2(14 +4)] + (24 + 64)
= 36 + 88
= 124
(ii) सोड़ियम सल्फेट का सूत्र = Na2SO4
अणु भार = (2 x 23) + 32 + (4 x 16)
= 46 + 32 + 64
= 142
(iii) एल्यूमिनियम नाइट्रेट का सूत्र = Al(NO3)3
अणुभार = 27 + 3(14 +48)
= 27 + 3(62) = 27 + 186
= 213
प्रश्न 32.
ऑक्सीजन गैस के 32 ग्राम और नाइट्रोजन के 14 ग्राम में उपस्थित अणुओं की संख्या कितनी होगी?
उत्तर:
(i) ऑक्सीजन का अणुभार = 32
अतः ऑक्सीजन गैस के 32 ग्राम में मोल = (frac { 32 }{ 32 } ) = 1
इसलिए अणुओं की संख्या = 1 x आवोगाद्रो संख्या
= 6.022 x 1023
(ii) नाइट्रोजन का अणुभार = 28
अत: नाइट्रोजन के 14 ग्राम में मोल = (frac { 14 }{ 28 } ) = 0.5
इसलिए अणुओं की संख्या = 0.5 x 6.022 x 1023 = 3.011 x 1023
प्रश्न 33.
निम्नलिखित के लिए मोलर द्रव्यमान का परिकलन कीजिए –
(i) HNO3
(ii) CO2
(Iii) C2H6
उत्तर:
(i) HNO3 का मोलर द्रव्यमान = H को परमाणु द्रव्यमान + N का परमाणु द्रव्यमान + 3 x (O का परमाणु द्रव्यमान)
= 1 + 14 + 3(16)
= 15 + 48
= 63
(ii) CO2 का मोलर द्रव्यमान = C का परमाणु द्रव्यमान + 2 x (O का परमाणु द्रव्यमान)
= 12 + 2(16)
= 44
(iii) C2H6 का मोलर द्रव्यमान = 2(C का परमाणु द्रव्यमान) + 6 (H का परमाणु द्रव्यमान)
= 2(12) + 6(1) = 24 + 6 = 30
प्रश्न 34.
निम्न में अणुओं की अधिकतम संख्या किसमें उपस्थित –
(i) 36 g जल
(ii) 28 g कार्बन मोनो ऑक्साइड।
उत्तर:
(i) 36 g जल (H2O) के मोल = (frac { 36 }{18 } ) = 2 (H2O का अणुभार = 18)
(ii) 28 g कार्बन मोनो ऑक्साइड (CO) के मोल = (frac { 28 }{ 28 } ) = 1 (CO का अणुभार = 28)
अतः 36g जल में अणुओं की संख्या, 28 g कार्बन मोनो ऑक्साइड से अधिक होगी क्योंकि H2O के 2 मोल हैं जबकि CO का एक मोल है।
प्रश्न 35.
निम्न में अणुओं की न्यूनतम संख्या किसमें उपस्थित है –
(i) 46g एथिल ऐल्कोहॉल
(ii) 54g नाइट्रोजन पेन्टाक्साइड।
उत्तर:
(i) 46g एथिल ऐल्कोहॉल (C2H5OH) के मोल = (frac { 46 }{ 46 } ) = 1 (C2H5OH को अणु भार = 46)
(ii) 54g नाइट्रोजन पेन्टाक्साइड (N2O5) के मोल = (frac { 54 }{ 108 } ) = 0.5 (N2O5)का अणु भार = 108)
अतः 54g N2O5 में अणुओं की संख्या कम होगी क्योंकि N2O5 के 0.5 मोल हैं जबकि, C2H5OH का 1 मोल है।
RBSE Class 11 Chemistry Chapter 1 निबन्धात्मक प्रश्न
प्रश्न 36.
सोडियम सल्फेट में उपस्थित विभिन्न तत्त्वों के द्रव्यमान प्रतिशत का परिकलन कीजिए।
उत्तर:
किसी तत्त्व का द्रव्यमान प्रतिशत![]()
सोडियम सल्फेट (Na2SO4) का आण्विक द्रव्यमान = 2 x Na का परमाणु द्रव्यमान + S का परमाणु द्रव्यमान + 4 x O का परमाणु द्रव्यमान
= 2(23.0) + 32.0 +4 x (16.0)
= 142g mol-1
प्रश्न 37.
सीमान्त अभिकर्मक किसे कहते हैं? 3.0 ग्राम H2 29.0 ग्राम O2 से क्रिया में सीमांत अभिकर्मक की पहचान करो।
उत्तर:
सीमान्त अभिकर्मक –
इसके लिए लघूत्तरात्मक प्रश्न संख्या 26 को उत्तर देखें।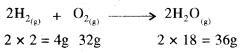
संतुलित समीकरण के अनुसार –
4g H2 से क्रिया करने वाली O2, की मात्रा = 32g
अतः 3g H2 से क्रिया करने वाली O2, की मात्र
= (frac { 32 }{ 4 } ) × 3
= 24 g
ऑक्सीजन की वास्तविक उपस्थित मात्रा = 29 ग्राम
चूँकि ऑक्सीजन अधिक मात्रा में उपस्थित है, अतः इस अभिक्रिया में सीमान्त अभिकर्मक H2 है।
प्रश्न 38.
कार्बन और ऑक्सीजन से दो यौगिक बनते हैं। इनमें से एक में कार्बन की मात्रा 42.9% तथा दूसरे में 27.3% है तो गुणित अनुपात के नियम की पुष्टि करिए।
उत्तर:
कार्बन की ऑक्सीजन से क्रिया द्वारा दो प्रकार के ऑक्साइड बनते हैं जिनमें कार्बन तथा ऑक्सीजन की प्रतिशत मात्राएँ निम्न प्रकार हैं –
1. ऑक्साइड में – 57.1 ग्राम ऑक्सीजन से क्रिया करने वाले कार्बन की मात्रा = 42.9 ग्राम
अतः 1 ग्राम ऑक्सीजन से क्रिया करने वाले कार्बन की मात्रा = (frac { 42.9 }{ 57.1 } ) = 0.751g
2. ऑक्साइड में – 72.7 ग्राम ऑक्सीजन से क्रिया करने वाले कार्बन की मात्रा 27.3 ग्राम
अतः 1 ग्राम ऑक्सीजन से क्रिया करने वाले कार्बन की मात्रा = (frac { 27.3 }{ 72.7 } ) = 0.375
उपरोक्त दोनों ऑक्साइडों में ऑक्सीजन की एक निश्चित मात्रा (1 ग्राम) से क्रिया करने वाली कार्बन की मात्राएँ क्रमशः 0.751 g तथा 0.375 g हैं जो कि एक सरल अनुपात (2 : 1) में है अतः इससे गुणित अनुपात के नियम की पुष्टि होती है।
प्रश्न 39.
निम्नलिखित पर संक्षिप्त टिप्पणियाँ लिखिए
(i) डाल्टन का परमाणु सिद्धान्त
(ii) गैलुसेक का गैसीय आयतन सम्बन्धी नियम
(iii) आवोगादो परिकल्पना के अनुप्रयोग।
उत्तर:
(i) डाल्टन का परमाणु सिद्धान्त:
पदार्थ के सबसे छोटे कण की अवधारणा आज से हजारों वर्ष पूर्व वैशेषिक दर्शन के आचार्य महर्षि कणाद ने दी थी जिसमें उन्होंने पदार्थ की सूक्ष्मतम अवस्था को परम-अणु (परमाणु) से प्रदर्शित किया था। परमाणु शब्द की उत्पत्ति ऐटोमोस (atomos) शब्द से हुई है जिसका अर्थ है अविभाज्य। 1803 में रासायनिक संयोग के नियमों के आधार पर ब्रिटिश वैज्ञानिक जॉन डाल्टन ने तत्त्वों के सबसे छोटे कण के बारे में परमाणु की अवधारणा प्रस्तुत की जिसके अनुसार तत्त्व का वह सूक्ष्मतम कण जिसे और अधिक विभाजित नहीं किया जा सकता, उसे परमाणु कहते हैं।
परमाणु संयोग के नियमों को सैद्धान्तिक आधार प्रदान करने हेतु डॉल्टन ने 1808 में परमाणु सिद्धान्त दिया जिसके मुख्य बिन्दु निम्नलिखित –
- द्रव्य छोटे-छोटे अविभाज्य कणों से मिलकर बना होता है। जिन्हें परमाणु कहते हैं।
- किसी तत्त्व के सभी परमाणु समान होते हैं तथा उनके सभी गुण (आकार, भार, रंग) समान होते हैं।
- भिन्न-भिन्न तत्त्वों के परमाणु भिन्न-भिन्न होते हैं तथा उनके गुण भी भिन्न होते हैं।
- परमाणु, पदार्थ की सबसे छोटी इकाई है जो कि रासायनिक अभिक्रिया में भाग लेती है।
- दो या अधिक भिन्न-भिन्न तत्त्वों के परमाणु सरल तथा निश्चित अनुपात में संयोग करते हैं तथा बनने वाले पदार्थ को यौगिक परमाणु (compound atom) कहते हैं जिसे आजकल अणु (molecule) कहा जाता है।
- किसी भी भौतिक और रासायनिक अभिक्रिया में परमाणु न तो उत्पन्न होते हैं तथा न ही नष्ट होते हैं। डाल्टन के परमाणु सिद्धान्त द्वारा रासायनिक संयोजन के नियमों की व्याख्या की जा सकती है।
जे.जे. थॉमसन, रदरफोर्ड, नील्स, बोर आदि वैज्ञानिकों द्वारा किए। गए आविष्कारों के संदर्भ में डाल्टन के परमाणु सिद्धान्त की समीक्षा की गई तथा इसमें निम्नलिखित संशोधन किए गए –
- परमाणु अविभाज्य नहीं होता अपितु इसे उप-परमाणु (sub atomic particles) प्रोटॉन, इलेक्ट्रॉन तथा न्यूट्रॉन में विभाजित किया जा सकता है।
- समस्थानिकों (Isotopes) के अस्तित्व के कारण एक ही तत्त्व के सभी परमाणु समान नहीं होते हैं क्योंकि इनकी द्रव्यमान संख्या भिन्न-भिन्न होती है।
- भिन्न-भिन्न तत्त्वों के परमाणुओं के एक या एक से अधिक गुणधर्म समान हो सकते हैं, जैसे कैल्शियम (Ca) और ऑर्गन (Ar) का परमाणु द्रव्यमान
- समान (40) है जबकि रासायनिक गुणधर्म भिन्न हैं, इस प्रकार के तत्त्वों को समभारिक (Isobars) कहते हैं।
- एक तत्त्व के परमाणु को दूसरे तत्त्व के परमाणु में बदला जा सकता है (नाभिकीय अभिक्रियाओं द्वारा)।
- परमाणु के द्रव्यमान को ऊर्जा में बदला जा सकता है। परन्तु रासायनिक अभिक्रिया में परमाणु अपरिवर्तित रहते हैं। केवल उनकी व्यवस्था परिवर्तित होती है।
(ii) गैलुसेक का गैसीय आयतन सम्बन्धी नियम:
1808 में गै-लूसैक ने रासायनिक अभिक्रिया में गैसों के संयुक्त होने में प्रयुक्त उनके आयतनों के अध्ययन के आधार पर यह नियम दिया था। इसके अनुसार समान ताप व दाब पर जब गैसें आपस में अभिक्रिया (संयोग) करती हैं तो उनके आयतन सरल अनुपात में होते हैं और यदि उत्पाद भी गैस हो तो उसका आयतन भी क्रियाकारी गैसों के आयतन के सरल अनुपात में होता है।
उदाहरण:
हाइड्रोजन तथा ऑक्सीजन की क्रिया से जल का बनना
यहाँ क्रिया करने वाली H2 तथा O2 के आयतनों का अनुपात 100 : 50 (2 : 1) है जो कि एक सरल अनुपात है तथा उत्पाद भी एक गैस (जलवाष्प) है, अतः सम्पूर्ण अभिक्रिया अनुपात 100 : 50 : 100 या 2 : 1 : 2 (सरल अनुपात) है।
उदाहरण:![]()
इस अभिक्रिया में N2, H2 (अभिकारक गैसें) तथा NHS (उत्पाद गैस) का अनुपात 1 : 3 : 2 है जो कि एक सरल अनुपात है। यह नियम वास्तव में आयतन के संदर्भ में स्थिर अनुपात का नियम है। आवोगाद्रो (1811) द्वारा किए गए कार्य द्वारा गै-लूसैक के नियम जो कि प्रायोगिक परिणामों पर आधारित था, की सही ढंग से व्याख्या की गयी। लेकिन यह नियम यथार्थ नहीं है क्योंकि गैसों में आदर्श आचरण से विचलन पाया जाता है।
(iii) आवोगादो परिकल्पना के अनुप्रयोग:
आवोगाद्रो की परिकल्पना द्वारा रसायन विज्ञान के विकास में दिए गए महत्त्वपूर्ण योगदान निम्नलिखित हैं
(1) आवोगाद्रो ने परमाणु तथा अणु की स्पष्ट परिभाषा देकर डाल्टन के परमाणु सिद्धान्त में संशोधन किया।
(2) किसी तात्विक गैस (elementary gas) के एक अणु में उपस्थित परमाणुओं की संख्या को उसकी परमाणुकता (atomicity) कहते हैं। जैसे हाइड्रोजन, ऑक्सीजन तथा क्लोरीन की परमाणुकता दो है। उदाहरण आवोगाद्रो के नियम की सहायता से ऑक्सीजन की परमाणुकता ज्ञात करने के लिए ऑक्सीजन और हाइड्रोजन की अभिक्रिया द्वारा जल वाष्प बनने की अभिक्रिया का अध्ययन करते हैं।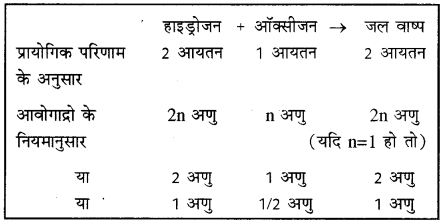
इससे स्पष्ट है कि जल वाष्प के 1 अणु में (frac { 1 }{ 2 } ) अणु ऑक्सीजन उपस्थित है। यदि ऑक्सीजन का एक अणु एक परमाणु से बना है तो (frac { 1 }{ 2 } ) अणु का अर्थ है (frac { 1 }{ 2 } ) परमाणु जो कि डाल्टन के परमाणु सिद्धान्त के विपरीत है क्योंकि परमाणु अविभाज्य है। अब यदि यह माना जाए कि ऑक्सीजन का एक अणु उसके दो परमाणुओं से मिलकर बना है तो डॉल्टन और आवोगाद्रो के विचारों में समानता होगी। क्योंकि (frac { 1 }{ 2 } ) अणु ऑक्सीजन का अर्थ है एक परमाणु न कि (frac { 1 }{ 2 } ) परमाणु। अतः ऑक्सीजन की परमाणुकता दो है। अणुओं की परमाणुकताओं से पदार्थ (गैस) के अणु का रासायनिक सूत्र भी लिखा जा सकता है। यहाँ आवोगाद्रो परिकल्पना से यह ज्ञात होता है कि जल वाष्प का रासायनिक सूत्र H2O होगा क्योंकि जल वाष्प का एक अणु, 1 अणु हाइड्रोजन और (frac { 1 }{ 2 } ) अणु ऑक्सीजन से मिलकर बना है।
प्रश्न 40.
रासायनिक संयोजन के नियम के अन्तर्गत आने वाले नियमों को संक्षिप्त में लिखिए।
उत्तर:
रसायनज्ञों ने रासायनिक परिवर्तनों के मात्रात्मक अध्ययन के आधार पर निम्नलिखित निश्चित सामान्य एवं मूलभूत नियम प्रतिपादित किए हैं।
(1) द्रव्यमान संरक्षण का नियम (Law of Conservation of Mass):
यह नियम 1789 में लेवोसिए द्वारा दहन अभिक्रियाओं के अध्ययन द्वारा दिया गया था तथा लेण्डोल्ट ने इसे प्रतिपादित किया। इस नियम के अनुसार द्रव्य को न तो उत्पन्न किया जा सकता है और न ही नष्ट किया जा सकता है, अर्थात् किसी रासायनिक अभिक्रिया में बने उत्पादों का कुल द्रव्यमान, अभिक्रिया में भाग लेने वाले अभिकारकों के कुल द्रव्यमान के बराबर होता है। इसे द्रव्य की अविनाशिता का नियम भी कहते हैं। इससे यह निष्कर्ष प्राप्त होता है कि ब्रह्माण्ड में उपस्थित द्रव्य हमेशा निश्चित रहता है। उदाहरण-कार्बन का दहने।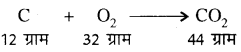
प्रायोगिक सत्यापन – लेण्डोल्ट ने द्रव्यमान संरक्षण नियम के प्रायोगिक सत्यापन के लिए एक ट्यूब ली जिसकी एक भुजा में सिल्वर नाइट्रेट (AgNO3) तथा एक भुजा में सोडियम क्लोराइड (NaCl) का विलयन लेकर इस ट्यूब का भार ज्ञात किया। इसके पश्चात् उपकरण को तेजी से हिलाकर दोनों विलयनों को मिश्रित किया ताकि इनके मध्य अभिक्रिया हो सके। AgNO3 तथा NaCl विलयनों की अभिक्रिया से AgCl का श्वेत अपक्षेप प्राप्त हुआ।![]()
प्रयोग के पश्चात् ट्यूब का भार पुनः ज्ञात किया गया तो देखा कि इसके भार में कोई परिवर्तन नहीं हुआ है, इससे द्रव्यमान संरक्षण नियम की पुष्टि होती है।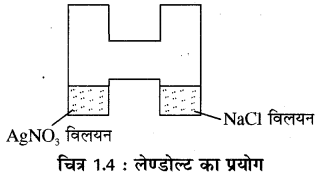
अपवाद-नाभिकीय अभिक्रियाएँ द्रव्यमान संरक्षण नियम की अपवाद हैं।
(2) स्थिर अनुपात ( संघटन) का नियम (Law of Constant Proportion):
यह नियम 1799 में फ्रांसीसी रसायनज्ञ प्राऊट द्वारा दिया गया था। यह नियम किसी यौगिक में उपस्थित तत्त्वों के द्रव्यमानों पर आधारित है। इसके अनुसार किसी शुद्ध यौगिक के नमूने में उपस्थित तत्त्वों के द्रव्यमानों का अनुपात सदैव स्थिर होता है, चाहे वह यौगिक किसी भी स्रोत या विधि से प्राप्त हुआ हो। अतः इसे निश्चित संघटन का नियम भी कहते हैं।
उदाहरण:
(i) शुद्ध CO2 को प्राप्त करने की निम्नलिखित विधियाँ प्रयुक्त की जा सकती हैं, लेकिन इन सभी विधियों से प्राप्त CO2 में कार्बन तथा ऑक्सीजन का अनुपात हमेशा 12 : 32 या 3 : 8 होगा।
(a) चूना पत्थर को गर्म करके
CaCO3 → CaO + CO2
(b) कोक को वायु में जलाकर
C + O2 →CO2
(c) कैल्सियम कार्बोनेट पर तनु HCl की क्रिया से –
CaCO3 + 2HCI → CaCl + H2O+ CO2
(ii) शुद्ध जल को हम किसी भी स्रोत जैसे नदी, कुआँ या झील से प्राप्त करें या रासायनिक विधि द्वारा तत्त्वों से इसका संश्लेषण करें इसमें हाइड्रोजन तथा ऑक्सीजन के द्रव्यमानों का अनुपात हमेशा 1 : 8 ही होता है।
प्राऊट का प्रयोग –
प्राऊट ने क्यूप्रिंक कार्बोनेट (CuCO3) के दो नमूनों में Cu, O तथा C के प्रतिशत का अध्ययन किया तो पाया कि दोनों नमूनों में इन तत्त्वों का संघटन समान था जो कि इस नियम की पुष्टि करता है।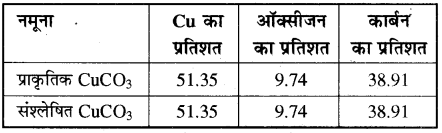
स्थिर अनुपात के नियम के लिए यह आवश्यक है कि यौगिक शुद्ध हो। इस नियम को समस्थानिकों के आविष्कार के बाद संशोधित किया गया है। इस नियम के अनुसार शुद्ध यौगिक के तत्त्वों के भारों का अनुपात स्थिर रहता है, अतः उसमें तत्त्वों की संख्या भी स्थिर होगी। जैसे अमोनिया के अणु में एक नाइट्रोजन और तीन हाइड्रोजन तथा जल के अणु में दो हाइड्रोजन एवं एक ऑक्सीजन तत्त्व ही होंगे।
(3) गुणित अनुपात का नियम (Law of Multiple Proportion):
यह नियम 1803 में डाल्टन नामक वैज्ञानिक द्वारा दिया गया था तथा इसे बर्जीलियस द्वारा प्रतिपादित किया गया। इसके अनुसार जब दो तत्त्व आपस में क्रिया करके एक से अधिक यौगिक बनाते हैं तो एक तत्त्व के निश्चित भार (द्रव्यमान) के साथ क्रिया करने वाले दूसरे तत्त्व के द्रव्यमान छोटे पूर्णाकों के अनुपात में होते हैं अर्थात् इनमें एक सरल अनुपात होता है। इसी अवलोकन के आधार पर डाल्टन ने परमाणु सिद्धांत का विकास किया था।
उदाहरण:
(i) कार्बन तथा ऑक्सीजन आपस में क्रिया करके CO तथा CO2 बनाते हैं।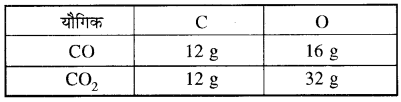
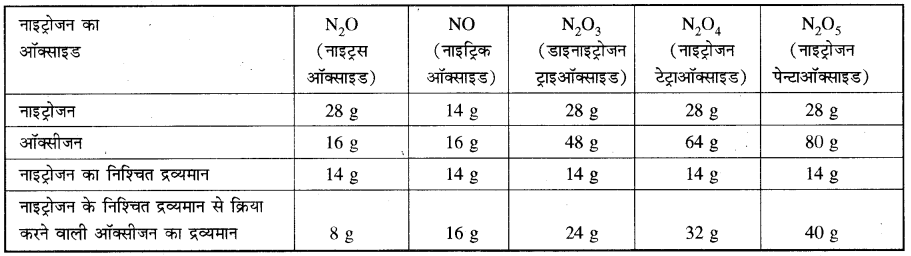
(ii) हाइड्रोजन तथा ऑक्सीजन आपस में क्रिया करके H2O तथा H2O2 बनाते हैं।उपरोक्त सारणी से यह स्पष्ट है कि नाइट्रोजन के इन ऑक्साइडों में नाइट्रोजन के निश्चित द्रव्यमान (14 g) से क्रिया करने वाली ऑक्सीजन के द्रव्यमानों में एक सरल अनुपात (8: 16 : 24: 32 : 40 या 1 : 2 : 3 : 4 : 5) है। उपरोक्त सभी उदाहरण गुणित अनुपात के नियम की पुष्टि करते हैं। इस नियम की सहायता से यौगिक का संभावित सूत्र भी लिखा जा सकता है जैसे यदि कार्बन (C) तथा ऑक्सीजन (O) मिलकर दो भिन्न यौगिक A और B बनाते हैं। A में द्रव्यमान के आधार पर कार्बन 42.9% तथा ऑक्सीजन 57.1% है तथा B में कार्बन तथा ऑक्सीजन की प्रतिशत मात्रा क्रमशः 27.3% तथा 72.7% है तो गुणित अनुपात के नियमानुसार दोनों यौगिकों में ऑक्सीजन के द्रव्यमानों, जो कि कार्बन के नियत द्रव्यमान से संयोग कर रहे हैं, में सरल अनुपात होना चाहिए। इसके लिए हम कार्बन के नियत द्रव्यमान के सापेक्ष अन्य द्रव्यमानों को लेकर गणना करते हैं। अतः यौगिक A में प्रति ग्राम कार्बन, ऑक्सीजन का द्रव्यमान = (frac { 57.1 }{ 42.9 } ) = 1.33 ग्रा. तथा यौगिक B में प्रति ग्राम कार्बन, ऑक्सीजन का द्रव्यमान = (frac { 72.7 }{ 27.3 } ) = 2.66। अतः स्पष्ट है कि प्रति कार्बन के CO तथा CO2 में कार्बन की निश्चित मात्रा (12g) से क्रिया करने वाली ऑक्सीजन की मात्राएँ 16 g तथा 32 g हैं जिनमें एक सरल अनुपात (16 : 32 या 1 : 2) है।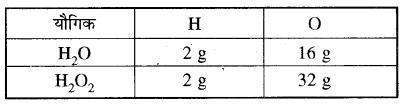
H2O तथा H2O2 में हाइड्रोजन की निश्चित मात्रा (2g) से क्रिया करने वाली ऑक्सीजन की मात्राएँ 16 g तथा 32 g जो कि एक सरल अनुपात (16 : 32 या 1 : 2) में है।
(iii) नाइट्रोजन तथा ऑक्सीजन के संयोग से पाँच प्रकार के ऑक्साइड बनते हैं।
साथ संयोग करने वाले ऑक्सीजन के द्रव्यमानों में अनुपात (frac { 2.66 }{ 1.33 } ) = 2 : 1 है। अर्थात् यौगिक A में प्रति कार्बन परमाणु के लिए एक ऑक्सीजन परमाणु है जबकि यौगिक B में प्रति कार्बन परमाणु के लिए दो ऑक्सीजन परमाणु है। अतः यौगिक A तथा B के संभावित सूत्र CO (कार्बन मोनोक्साइड) तथा CO2 (कार्बन डाईऑक्साइड) हो सकते हैं। जो कि डाल्टन के बाद के वर्षों में सही पाए गए।
(4) तुल्य अनुपात या व्युत्क्रम अनुपात का नियम (Law of Reciprocal Proportion):
यह नियम 1792 में रिचर ने दिया था तथा स्टेस ने इसे अनुमोदित किया। इस नियम के अनुसार जब दो भिन्न-भिन्न तत्त्व किसी तीसरे तत्त्व के एक निश्चित द्रव्यमान के साथ पृथक्-पृथक् क्रिया करते हैं। (संयोग करते हैं) तो उनके द्रव्यमानों को अनुपात भी समान या उसका सरल गुणक होता है, जब वे आपस में क्रिया करते हैं।
उदाहरण:
(i) कार्बन तथा ऑक्सीजन, तीसरे तत्त्व हाइड्रोजन से क्रिया करके मेथेन (CH4) तथा जल (H2O) बनाते हैं तथा कार्बन व ऑक्सीजन आपस में क्रिया करके CO2 बनाते हैं।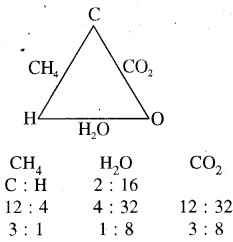
CH4 में हाइड्रोजन निश्चित द्रव्यमान (4 g) से क्रिया करने वाली कार्बन का द्रव्यमान 12 g है तथा H2O में हाइड्रोजन के 4 g से क्रिया करने वाली ऑक्सीजन का द्रव्यमान 32 g है, लेकिन जब कार्बन तथा ऑक्सीजन मिलकर CO2 बनाते हैं तो इसमें C तथा O के द्रव्यमान का अनुपात भी वही (12 : 32 या 3 : 8) है।
उदाहरण:
(ii) सल्फर तथा ऑक्सीजन तीसरे तत्त्व हाइड्रोजन से क्रिया करके H2S तथा H2O बनाते हैं तथा सल्फर व ऑक्सीजन आपस में मिलकर SO2 बनाते हैं।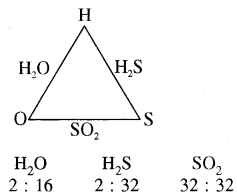
H2O में हाइड्रोजन के निश्चित द्रव्यमान (2 g) से क्रिया करने वाली ऑक्सीजन का द्रव्यमान 16 ग्राम है तथा H2S में हाइड्रोजन के उसी द्रव्यमान (2 g) से क्रिया करने वाले सल्फर का द्रव्यमान 32 ग्राम है। लेकिन जब ऑक्सीजन व सल्फर मिलकर SO2 बनाते हैं तो इसमें ऑक्सीजन तथा सल्फर के द्रव्यमान का अनुपात 32 ; 32 या 1 : 1 है। जो कि 16 : 32 यो 1 : 2 का सरल गुणक है।
व्युत्क्रम अनुपात के नियम को तुल्य अनुपात का नियम भी कहते हैं जिसके अनुसार विभिन्न तत्त्व अपने तुल्यांकी द्रव्यमान या उनके पूर्ण गुणकों के अनुपात में क्रिया करते हैं। अतः यह नियम तत्त्वों का तुल्यांकी भार ज्ञात करने में भी उपयोगी है।
5. गैलुसेक का गैसीय आयतन सम्बन्धी नियम (Gaylussac’s Law of combining volumes):
1808 में गै-लूसैक ने रासायनिक अभिक्रिया में गैसों के संयुक्त होने में प्रयुक्त उनके आयतनों के अध्ययन के आधार पर यह नियम दिया था। इसके अनुसार समान ताप व दाब पर जब गैसें आपस में अभिक्रिया (संयोग) करती हैं तो उनके आयतन सरल अनुपात में होते हैं और यदि उत्पाद भी गैस हो तो उसका आयतन भी क्रियाकारी गैसों के आयतन के सरल अनुपात में होता है।
उदाहरण:
हाइड्रोजन तथा ऑक्सीजन की क्रिया से जल का बनना
यहाँ क्रिया करने वाली H2 तथा O2 के आयतनों का अनुपात 100 : 50 (2 : 1) है जो कि एक सरल अनुपात है तथा उत्पाद भी एक गैस (जलवाष्प) है, अतः सम्पूर्ण अभिक्रिया अनुपात 100 : 50 : 100 या 2 : 1 : 2 (सरल अनुपात) है।
उदाहरण:![]()
इस अभिक्रिया में N2, H2 (अभिकारक गैसें) तथा NHS (उत्पाद गैस) का अनुपात 1 : 3 : 2 है जो कि एक सरल अनुपात है। यह नियम वास्तव में आयतन के संदर्भ में स्थिर अनुपात का नियम है। आवोगाद्रो (1811) द्वारा किए गए कार्य द्वारा गै-लूसैक के नियम जो कि प्रायोगिक परिणामों पर आधारित था, की सही ढंग से व्याख्या की गयी। लेकिन यह नियम यथार्थ नहीं है क्योंकि गैसों में आदर्श आचरण से विचलन पाया जाता है।
RBSE Class 11 Chemistry Chapter 1 रसायन विज्ञान की मूल अवधारणाएँ आंकिक प्रश्न
प्रश्न 41.
एक कार्बनिक यौगिक में 40% कार्बन, 6.66% हाइड्रोजन तथा शेष ऑक्सीजन है, इसका वाष्प घनत्व 30 है। यौगिक के मूलानुपाती सूत्र तथा आणविक सूत्र को ज्ञात कीजिए।
हल:
सर्वप्रथम तत्त्वों का सरलतम पूर्णांक मोलर अनुपात ज्ञात करते हैं –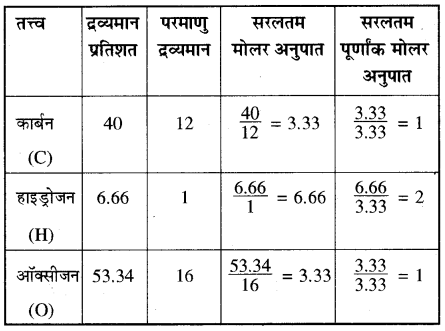
यौगिक में तत्त्वों का सरलतम अनुपात = 1: 2 : 1
अतः यौगिक का मूलानुपाती सूत्र = CH2O
मूलानुपाती सूत्र द्रव्यमान = 12 + 2 + 16 = 30 g
यौगिक का वाष्प घनत्व = 30 अतः अणुभार = 2 x वाष्प घनत्व (30) = 60
अतः यौगिक का आण्विक सूत्र = (CH2O) x 2 = C2H4O2
प्रश्न 42.
एक कार्बनिक यौगिक में C, H, N को भारात्मक अनुपात 9 : 1 : 3.5 है तथा यौगिक का अणुभार 108 है। यौगिक का मूलानुपाती सूत्र और अणुसूत्र क्या है?
हल:
C, H तथा N के भारात्मक अनुपात का योग
= 9 + 1 + 3.5 = 13.5
अतः यौगिक में C की % मात्रा = (frac { 9 }{ 13.5 } ) x 100 = 66.66
H की % मात्रा = (frac { 1 }{ 13.5 } ) x 100 = 7.41%
N की % मात्रा = (frac { 3.5 }{ 13.5 } ) x 100 = 25.93%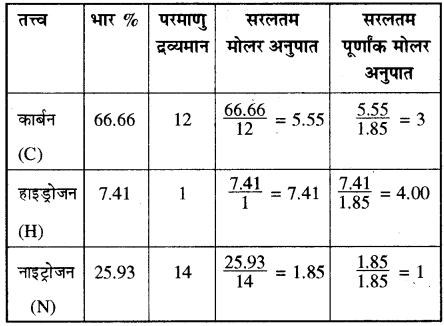
यौगिक में तत्त्वों का सरलतम अनुपात = 3 : 4 : 1
अतः यौगिक का मूलानुपाती सूत्र = C3H4N
मूलानुपाती सूत्र द्रव्यमान = (12 x 3) + (1 x 4) + 14 = 54
यौगिक का अणुभार = 108
अतः यौगिक का अणु सूत्र (C3H4N)2 = C6H8N2
प्रश्न 43.
रासायनिक विश्लेषण में ज्ञात हुआ कि किसी यौगिक में 10 ग्राम आयरन क्लोराइड में 3.438 ग्राम आयरन और 6.560 ग्राम क्लोरीन है। आयरन क्लोराइड का मूलानुपाती सूत्र ज्ञात कीजिये। (Fe = 55.8, Cl = 35.5)
हल:
आयरन (Fe) का भार % = (frac { 3.439 }{ 10 } ) x 100 = 34.38%
क्लोरीन (CI) का भार % =(frac { 6.560 }{ 10 } ) x 100 = 65.60%
अत: Fe का मोलर अनुपात = (frac { 34.38 }{ 558 } ) = 0.616
CI का मोलर अनुपात = (frac { 65.60 }{ 35.50 } ) = 1.847
अतः Fe व CI का सरलतम मोलर अनुपात
(frac {0.616 }{ 0.616 } ) : (frac { 1.847 }{ 0.616 } ) = 1 : 2.99 (1 : 3)
अतः आयरन क्लोराइड का मूलानुपाती
सूत्र = FeCl3
प्रश्न 44.
88 ग्राम CO2 में ऑक्सीजन परमाणुओं की संख्या ज्ञात करो। समान ऑक्सीजन परमाणुओं की संख्या से युक्त CO का द्रव्यमान ज्ञात करो।
हल:
CO2 का मोलर द्रव्यमान = 12 + (2 x 16) = 44
अत: CO, के मोल = (frac {88 }{44 } ) = 2
2 मोल CO2 में अणुओं की संख्या = 2 x आवोगाद्रो संख्या
= 2 x 6.022 x 1023 चूँकि CO2 के एक अणु में ऑक्सीजन के दो परमाणु हैं अतः ऑक्सीजन परमाणुओं की संख्या
= 2 x 6.022 x 1023x 2
= 2.4088 x 1024
CO के एक अणु में केवल एक ऑक्सीजन परमाणु है जबकि CO2 के एक अणु में दो ऑक्सीजन परमाणु हैं अतः ऑक्सीजन परमाणुओं की समान संख्या के लिए CO के मोल = CO2 के मोल x 2
= 2 x 2 = 4
तथा CO का द्रव्यमान = 4 x अणुभार
= 4 x 28 = 112 ग्राम
प्रश्न 45.
परमाणु भार, अणु भार एवं तुल्यांकी भार को परिभाषित करो। 500 मिलि. विलयन जिसमें, 20.7 ग्राम पोटैशियम कार्बोनेट घुला हुआ है, की मोलरता ज्ञात करो। (K2CO3 का अणु भार = 138)
हल:
परमाणु भार – किसी तत्त्व का परमाणु भार वह संख्या है। जिससे यह ज्ञात होता है कि उस तत्त्व का एक परमाणु, C – 12 परमाणु के 12वें भाग से कितने गुना भारी है।
अणु भार – किसी पदार्थ का अणु भार वह संख्या है जिससे यह ज्ञात होता है कि उस पदार्थ का एक अणु C -12 के परमाणु के 12वें। भाग से कितने गुना भारी है।
तुल्यांकी भार – किसी पदार्थ का तुल्यांकी भार वह संख्या है जो यह दर्शाती है कि भार की दृष्टि से उसके कितने भाग, हाइड्रोजन के 1.008 भाग या ऑक्सीजन के 8 भाग या क्लोरीन के 35.5 भाग या सिल्वर (Ag) के 108 भाग से प्रत्यक्ष या परोक्ष रूप से संयुक्त होते हैं। अथवा उन्हें यौगिकों में से विस्थापित करते हैं।
प्रश्न 46.
नाइट्रिक अम्ल के व्यावसायिक उत्पादन में 7.33 मोल HNO3 उत्पन्न करने के लिए NO2 के कितने मोल आवश्यक होंगे यदि अभिक्रिया है – NO2 (गैस) + H2O (दव) ⇌ 2HNO3 (जलीय) + NO (गैस)
हल:
अभिक्रिया
NO2(g) + H2O(l) ⇌ 2HNO3(aq) + NO(g) को संतुलित करने पर
3NO2(g) + H2O(l) ⇌ 2HNO3(aq) + NO(g)
इस अभिक्रिया की रससमीकरणमिति के अनुसार 2 मोल HNO3 उत्पन्न करने के लिए आवश्यक NO2 के मोल = 3
अतः 7.33 मोल HNO3 उत्पन्न करने के लिए आवश्यक NO2 के मोल = 3 x 7.33 = 10.995 मोल
प्रश्न 47.
1.68 ग्राम लोहे में कितने मोल आयरन परमाणु होते हैं? आयरन की इसी मात्रा में परमाणुओं की संख्या की भी गणना करो। (लोहे का परमाणु भार = 56)
हल:
आयरन के मोल = (frac {1.68 }{56 } ) = 0.03
0.03 मोल आयरन में परमाणुओं की संख्या
= 0.03 x आवोगाद्रो संख्या
= 0.03 x 6.022 x 1023
= 1.80 x 1022
प्रश्न 48.
CaCO3 जलीय HCI के साथ पूर्णतः अभिक्रिया कर CaCl3 और CO2 बनाता है।
CaCO3(s) + 2HCI(g) → CaCl2(aq) + CO2(g) + H2O(l) 0.75M HCI के 25ml के साथ पूर्णतः अभिक्रिया करने के लिए CaCO3 की कितनी मात्रा की आवश्यकता होगी?
हल:
25 ml, 0.75 M HCI में HCI का द्रव्यमान –![]()
HCI का अणु भार = 1 + 35.5 = 36.5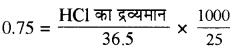
HCI का द्रव्यमान =(frac { 0.75times 36.5times 25 }{ 1000 } )
= 0.68437 g
= 0.6844 g
संतुलित समीकरण के अनुसार –
2 मोल HCI (2 x 36.5 = 73 g) से क्रिया करने वाले CaCO3 की मात्रा = 100 g
अतः 0.6844 g HCI से क्रिया करने वाले CaCO3 की मात्रा
(frac { 100 }{ 73 } ) x 0.6844 g
= 0.9375 g
= 0.94 g
प्रश्न 49.
प्रयोगशाला में क्लोरीन का विरचन मैंगनीज डाइऑक्साइड (MnO2) की जलीय HCI विलयन के साथ अभिक्रिया द्वारा निम्नलिखित समीकरण के अनुसार किया जाता है –
4HCI(aq) + MnO2(S) → 2H2O (l)+MnCl2(aq)+Cl2(g)
5.0 g मैंगनीज डाइऑक्साइड के साथ HCl के कितने ग्राम अभिक्रिया करेंगे?
हल:
1 मोल MnO2 = 55 + (2 x 16) = 87 g
अतः संतुलित समीकरण के अनुसार –
87 g MnO2 (1 मोल), HCI के 4 मोल (4 x 36.5 g = 146 g) से अभिक्रिया करता है।
इसलिए 5 g MnO) से अभिक्रिया करने वाले HCI का भार
= (frac { 146 }{ 87 } ) x 5 g = 8.39 g = 8.40 g HCI
प्रश्न 50.
द्रव्यमान की दृष्टि से व्यावसायिक हाइड्रोक्लोरिक अम्ल 38% होता है। यदि इस विलयन का घनत्व 1.19 ग्राम सेमी हो तो विलयन की मोलरता ज्ञात करो।
हल:
38% (द्रव्यमान) HCI का अर्थ है 100 g विलयन में 38 g HCI उपस्थित है।
(frac { 100 g }{ 1.19 g } ) cm3 = 84.03 cm3 या ml
विलेय (HCI) का भार = 38 g
HCI का अणुभार = 1 + 35.5 = 36.5
All Chapter RBSE Solutions For Class 11 Chemistry Hindi Medium
—————————————————————————–
All Subject RBSE Solutions For Class 11 Hindi Medium
*************************************************
————————————————————
All Chapter RBSE Solutions For Class 11 Chemistry Hindi Medium
All Subject RBSE Solutions For Class 11 Hindi Medium
Remark:
हम उम्मीद रखते है कि यह RBSE Class 11 chemistry Solutions in Hindi आपकी स्टडी में उपयोगी साबित हुए होंगे | अगर आप लोगो को इससे रिलेटेड कोई भी किसी भी प्रकार का डॉउट हो तो कमेंट बॉक्स में कमेंट करके पूंछ सकते है |
यदि इन solutions से आपको हेल्प मिली हो तो आप इन्हे अपने Classmates & Friends के साथ शेयर कर सकते है और HindiLearning.in को सोशल मीडिया में शेयर कर सकते है, जिससे हमारा मोटिवेशन बढ़ेगा और हम आप लोगो के लिए ऐसे ही और मैटेरियल अपलोड कर पाएंगे |
आपके भविष्य के लिए शुभकामनाएं!!