Table of Contents
ठोस की परिभाषा क्या है – What is Solid:
वे पदार्थ जिनका निश्चित आकार, सपष्ट सीमा, स्थिर आयतन होता है उन्हें ठोस कहते हैं.ठोस पदार्थों में उच्च यंग मापांक और अपरूपता मापांक होते है। इसके विपरीत, ज्यादातर तरल पदार्थ निम्न अपरूपता मापांक वाले होते हैं और श्यानता का प्रदर्शन करते हैं।
भौतिक विज्ञान की जिस शाखा में ठोस का अध्ययन करते हैं, उसे ठोस-अवस्था भौतिकी कहते हैं। पदार्थ विज्ञान में ठोस पदार्थों के भौतिक और रासायनिक गुणों और उनके अनुप्रयोग का अध्ययन करते हैं। ठोस-अवस्था रसायन में पदार्थों के संश्लेषण, उनकी पहचान और रासायनिक संघटन का अध्ययन किया जाता है।
- प्रत्येक ठोस अवयवी कणों से मिलकर बनता है। ये अवयवी कण अणु , परमाणु या आयन होते है। ये closely packed(अच्छे से दबाकर पैक किया हुआ) अर्थात निबिड संकुलित होते है तथा असंपीडिय होते है अतः ठोस कठोर होते हैं।
- ठोस के अवयवी कणों के मध्य रिक्त स्थान कम होता है। इनकी स्थिति स्थिर बनी रहती हैं अतः ठोस का आयतन निश्चित बना रहता है।
- इनका घनत्व गैस तथा द्रव की तुलना में अधिक होता है। (d =M/V)
- इनका गलनांक प्राय: अधिक होता है।
- ये माध्य स्थिति के सापेक्ष दोलन करते है।
ठोसों के प्रकार – :
ठोस दो प्रकार के होते है
- क्रिस्टलीय ठोस
- अक्रिस्टलीय ठोस
क्रिस्टलीय ठोस के गुण (Properties of Crystalline Solids):
- क्रिस्टलीय ठोस का melting point (गलनांक) निश्चित होता है।
- क्रिस्टलीय ठोस Anisotropic (विषमदैशिक) होते हैं। अर्थात उनके कुछ physical properties (भौतिक गुणों), यथा electrical resistance (विद्युत प्रतिरोधकता), refractive index (अपवर्तनांक), आदि भिन्न भिन्न दिशाओं में भिन्न भिन्न होते हैं। ऐसा भिन्न भिन्न दिशाओं में क्रिस्टलीय ठोस के अलग अलग व्यवस्था के कारण होता है।
- क्रिस्टलीय ठोस को तेज धार वाले औजार से काटने पर इसके दो भागों में विभक्त टुकड़ों की सतहें सपाट तथा चिकनी होती हैं।
- क्रिस्टलीय ठोस का heat of fusion ( गलन की उष्मा ) निश्चित तथा अभिलाक्षणिक होती है।
- क्रिस्टलीय ठोस वास्तविक ठोस पदार्थ होते हैं
अक्रिस्टलीय ठोस (Amorphous solids) के गुण:
- Amorphous solid ताप के एक निश्चित परास (A range of temperature) पर नरम हो जाते है, इसी कारण Amorphous solid (अक्रिस्टलीय ठोस) को गलाकर साँचे में ढ़ाला जा सकता है, जैसे कि प्लास्टिक, काँच, आदि।
- गर्म करने पर एक निश्चित ताप पर Amorphous solid क्रिस्टलीय बन जाते हैं। अक्रिस्टलीय ठोस के क्रिस्टलीय बन जाने के कारण ही प्राचीन सभ्यता की कुछ काँच के बने वस्तुओं में दुधियापन पाया जाता है।
- अक्रिस्टलीय पदार्थ में तरल की भाँति प्रवाह प्रवृति होती है। हालाँकि अक्रिस्टलीय ठोस में प्रवाह की प्रवृति बहुत ही slow होती है। अक्रिस्टलीय पदार्थ के प्रवाह की प्रवृति के कारण ही बहुत पुराने इमारतों के खिड़कियों आदि में लगे काँच की जड़े ऊपर की अपेक्षा थोड़ा मोटे हो जाते हैं।
- अक्रिस्टलीय ठोस की प्रकृति Isotropic (समदैशिक) होती है, क्योंकि उनमें दीर्घ परासी व्यवस्था (long range order) नहीं होती है, तथा सभी दिशाओं में irregular (अनियमित) arrangement (विन्यास) होता है।
- अक्रिस्टलीय ठोस दैनिक जीवन में काफी उपयोगी हैं, यथा silicon, जो कि एक अक्रिस्टलीय ठोस है, सूर्य के प्रकाश के विद्युत रूपांतरण करने के लिए उपलब्ध श्रेष्टतम photovoltaic पदार्थ है।
क्रिस्टलीय तथा अक्रिस्टलीय ठोसों में अंतर:
| गुण | क्रिस्टलीय (Crystalline) | अक्रिस्टलीय (non crystalline) |
| 1. ज्यामितीय आकार | इनका ज्यामितीय आकार निश्चित होता है। | इनका ज्यामितीय आकार निश्चित नहीं होता। |
| 2. अवयवी कणों की व्यवस्था | परासी व्यवस्था होती होती है। | परासी व्यवस्था होती होती है |
| 3. प्रकृति | ये वास्तविक ठोस है। | ये आभासी ठोस या अतिशीतित द्रव है। अर्थात द्रवों के भाँति बहने वाले। |
| 4. गलनांक | इनका गलनांक निश्चित होता है। | इनका गलनांक निश्चित नहीं होता ये एक ताप परास पर धीरे धीरे पिघलते है। |
| 5. गलन ऊष्मा | गलन ऊष्मा निश्चित होती है। | गलन ऊष्मा निश्चित नहीं होती। |
| 6. विदलन गुण | तेज धार वाले औजार से काटने पर ये सपाट व चिकनी सतह वाले दो भागो में विभक्त हो जाते है। | तेजधार वाले औजार से काटने पर ये समान व चिकनी सतह वाले दो भागो में विभक्त नहीं होते है। |
| 7. दैशिकता | ये विषम दैशिक होते है। उदाहरण : पोटेशियम नाइट्रेट , बेन्जोइक अम्ल , कॉपर , चाँदी , लोहा , सोना , नैफ्थलीन , क्वार्ट्ज़ आदि | ये सम दैशिक होते है। उदाहरण : काँच , लकड़ी , रबड़ , PVC (पोलीविनाइल क्लोराइड) , टेफ्लॉन , रेशा कांच , फाइबर आदि |
क्रिस्टलीय ठोसों का वर्गीकरण (Classification of Crystalline Solids):
क्रिस्टलीय ठोसों को उनमें परिचालित अंतराण्विक बलों (operating intermolecular forces) के आधार पर चार भागों में बाँटा जा सकता है। ये हैं: आण्विक ठोस (Molecular Solids), आयनिक ठोस (Ionic solids), धात्विक ठोस (Metallic solids) तथा सहसंयोजक ठोस (Covalent or Network solids)।
(1) आण्विक ठोस (Molecular Solids)
वैसे क्रिस्टलीय ठोस जिनके अवयवी कण अणु (Molecule) होते हैं, को आण्विक ठोस (Molecular Solid) कहा जाता है। Molecular solids को पुन: तीन भागों में बाँटा जा सकता है। ये हैं: अध्रुवी आण्विक ठोस (Non-polar Molecular solids), ध्रुवीय आण्विक ठोस (Polar Molecular Solids), तथा हाइड्रोजन आबंधित आण्विक ठोस (Hydrogen bonded Molecular Solids)।
(क) अध्रुवी आण्विक ठोस (Non-polar Molecular solids)
परमाणुओं, यथा निम्न ताप पर आर्गन और हीलियम अथवा Non-polar bond से बने अणुओं, यथा निम्न ताप पर H2, Cl2 और I2 द्वारा बने ठोस को अध्रुवीय आण्विक ठोस कहा जाता है।
अध्रुवीय ठोस के परमाणु अथवा अणु Weak Dispersion Forces (दुर्बल परिक्षेपण बलों) या London Forces (लंडन बलों) द्वारा बँधे रहते हैं।
अध्रुवीय ठोस के गलनांक निम्न होते हैं तथा ये सामान्यत: कमरे के ताप और दाब पर द्रव अथवा गैसीय अवस्था में रहते हैं।
(ख) ध्रुवीय आण्विक ठोस (Polar Molecular Solids)
वैसे क्रिस्टलीय ठोस जिनके अणु अपेक्षाकृत प्रबल dipole-dipole interactions (द्विध्रुव-द्विध्रुव अन्योन्यक्रियाओं) द्वारा एक दूसरे से बंधे होते हैं, ध्रुवीय आण्विक ठोस (Polar Molecular Solids) कहलाते हैं। यथा HCl, SO2, SO2, NH3 आदि पदार्थ के अणु ध्रुवीय सहसंयोजक बंधों से बने होते हैं, अत: ये ध्रुवीय आण्विक ठोस कहलाते हैं।
ध्रुवीय आण्विक ठोस के melting point (गलनांक) अध्रुवीय आण्विक ठोस से अधिक होते हैं, फिर भी इनमें से अधिकतर कमरे के ताप और दाब पर गैस अथवा द्रव होते हैं।
(ग) हाइड्रोजन आबंधित आण्विक ठोस (Hydrogen bonded Molecular Solids)
ऐसे क्रिस्टलीय ठोस, जिनके अणुओं में H, और F, O अथवा N परमाणुओं के मध्य ध्रुवीय-सहसंयोजक बंध होते हैं, को हाइड्रोजन आबंधित आण्विक ठोस कहलाते हैं। ऐसे ठोस के अणुओं को प्रबल हाइड्रोजन आबंधन बंधित करते हैं, जैसे कि H2O (बर्फ)। हाइड्रोजन आबंधित आण्विक ठोस विद्युत के अचालक होते हैं। सामान्यत: यह कमरे के ताप और दाब पर वाष्पशील द्रव अथवा मुलायम ठोस होते हैं।
(2) आयनिक ठोस (Ionic Solids)
वैसे ठोस जिनके Constituent particles (अवयवी कण) आयन होते हैं, आयनिक ठोस (Ionic Solid) कहलाते हैं।
आयनिक ठोसों (Ionic Solids) का निर्माण positively charged ions [Anions (धनायनों)] तथा negatively charged ions [Cations (ऋणायनों)] के three dimensional (त्रिआयामी) विन्यासों में strong स्थिर वैद्युत (कूलॉमी) बलों से बंधने पर होता है।
आयनिक ठोस कठोर और भंगुर प्रकृति के होते हैं।
आयनिक ठोस के Melting point (गलनांक) और Boiling point (क्वथनांक) उच्च होते हैं। चूँकि आयनिक ठोस में आयन गमन के लिए स्वतंत्र नहीं होते हैं, अत: ये ठोस अवस्था में विद्युतरोधी होते हैं। आयनिक ठोस गलित अवस्था में अथवा जल में घोलने पर, आयन गमन के लिए मुक्त हो जाते हैं तथा वे विद्युत का संचालन करते हैं। अर्थात आयनिक ठोस, ठोस अवस्था में विद्युत के कुचालक तथा गलित अवस्था तथा जल के विलयन में विद्युत के सुचालक होते हैं।
(3) धात्विक ठोस (Metallic Solid)
धातु, धात्विक ठोस कहलाते हैं। धात्विक ठोस के अवयवी कण धनायन होते हैं। वास्तव में धातुएं मुक्त इलेक्ट्रॉन से धिरे और उनके द्वारा संलग्नित धनायनों का व्यवस्थित संग्रह हैं। ये इलेक्ट्रॉन निरंतर गतिशील होते हैं तथा क्रिस्टल में सर्वत्र समरूप से विस्तारित होते हैं।
धात्विक ठोस के ये मुक्त और गतिशील इलेक्ट्रॉन ही धातुओं की उच्च वैद्युत और उष्मीय चालकता के लिये उत्तरदायी होते हैं। जब धातुओं में विद्युत धारा प्रवाहित की जाती है, तो ये इलेक्ट्रॉन धनायनों के नेटवर्क में सतत प्रवाह करते हैं तथा विद्युत धारा प्रवाहित होने लगती है। उसी प्रकार धातु के एक भाग में उष्मा प्रदान की जाती है तो इसमें वर्तमान मुक्त तथा गतिशील इलेक्ट्रॉन उस उष्मीय उर्जा को धातु के पूरे भाग में समान रूप से विस्तारित कर देती है।
धातुओं की विशेष चमक भी उनमें उपस्थित मुक्त तथा गतिशील इलेक्ट्रॉन के कारण ही होती हैं। धातुएँ अत्यधिक अधातवर्धनीय (malleable) तथा तन्य (ductile) होती हैं।
(4) सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Network Solids)
अधात्विक क्रिस्टलीय ठोस, जिनके संपूर्ण क्रिस्टल में निकटवर्ती परमाणुओं के बीच सहसंयोजक बंध बनने के कारण विस्तृत अनेकरूपता होती है, सहसंयोजक अथवा नेटवर्क ठोस कहलाते हैं।
सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) को Giant Molecule (विशाल अणु) भी कहा जाता है।
सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) के परमाणुओं के बीच सहसंयोजक बंध दिशात्मक (Directional) प्रकृति के होते हैं, इसलिये परमाणु अपनी स्थितिओं पर अति प्रबलता से संलग्न रहते हैं।
सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) के गुण:
सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) अति कठोर तथा भंगुर होते हैं।
सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) का Melting point (गलनांक) काफी उच्च होता है तथा ये गलन से पूर्व विघटित भी हो सकते हैं।
सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) विद्युतरोधी होते हैं, अर्थात विद्युत का संचालन नहीं करते हैं।
Diamond (हीरा) तथा Silicon carbide (सिलिकॉन कार्बाइड) सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) का एक विशिष्ट उदाहरण है।
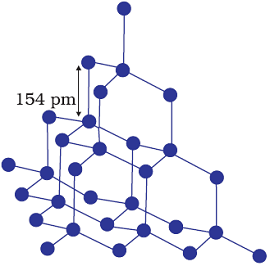
ग्रेफाइट भी सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) का एक उदाहरण है, परंतु अपवाद स्वरूप ग्रेफाइट मुलायम तथा विद्युत का सुचालक है। ग्रेफाइट का यह अपवादी गुण उसकी विशिष्ट संरचना के कारण होता है।











Video chahiye sir
bhai mere ko bhi video chahiye
Classic 12
Fabulous