हेलो स्टूडेंट्स, यहां हमने राजस्थान बोर्ड Class 10 Science Chapter 5 दैनिक जीवन में रसायन सॉल्यूशंस को दिया हैं। यह solutions स्टूडेंट के परीक्षा में बहुत सहायक होंगे | Student RBSE solutions for Class 10 Science Chapter 5 दैनिक जीवन में रसायन pdf Download करे| RBSE solutions for Class 10 Science Chapter 5 दैनिक जीवन में रसायन notes will help you.
| Board | RBSE |
| Textbook | SIERT, Rajasthan |
| Class | Class 10 |
| Subject | Science |
| Chapter | Chapter 5 |
| Chapter Name | दैनिक जीवन में रसायन |
| Number of Questions Solved | 102 |
| Category | RBSE Solutions |
Rajasthan Board RBSE Class 10 Science Chapter 5 दैनिक जीवन में रसायन
(पाठ्यपुस्तक के प्रश्नोत्तर)
बहुचयनात्मक प्रश्न
दैनिक जीवन में रसायन कक्षा 10 1.
क्षार का जलीय विलयन
(क) नीले लिटमस को लाल कर देता है।
(ख) लाल लिटमस को नीला कर देता है।
(ग) लिटमस विलयन को रंगहीन कर देता है।
(घ) लिटमस विलयन पर कोई प्रभाव नहीं डालता है।
RBSE Class 10 Science Chapter 5 Hindi Medium 2.
अम्ल व क्षार के विलयन होते हैं विद्युत के–
(क) कुचालक
(ख) सुचालक
(ग) अर्द्धचालक
(घ) अप्रभावित
RBSE कक्षा 10 विज्ञान अध्याय 5 3.
pH किन आयनों की सान्द्रता का ऋणात्मक लघुगणक होती है?
(क) [H2O]
(ख) [OH-]
(ग) [H+]
(घ) [Na+]
Dainik Jeevan Mein Rasayan Class 10 4.
किसी अम्लीय विलयन की pH होगी
(क) 7
(ख) 14
(ग) 11
(घ) 4
RBSE Solutions For Class 10 Science Chapter 5 5.
हमारे उदर में भोजन की पाचन क्रिया किस माध्यम में होती है
(क) अम्लीय
(ख) क्षारीय
(ग) उदासीन
(घ) परिवर्तनशील
दैनिक जीवन में रसायन कक्षा 10 Pdf 6.
अग्निशामक यंत्र बनाने में निम्न पदार्थ का प्रयोग किया जाता है
(क) सोडियम कार्बोनेट
(ख) सोडियम हाइड्रोजन कार्बोनेट
(ग) प्लास्टर ऑफ पेरिस
(घ) सोडियम क्लोराइड
दैनिक जीवन में रसायन के प्रश्न उत्तर 7.
धावन सोडा होता है..
(क) NaHCO3
(ख) NaCl
(ग) CaSO4.½H2O
(घ) Na2CO3.10 H2O
RBSE Class 10 Science Chapter 5 In Hindi 8.
विरंजक चूर्ण वायु में खुला रखने पर कौन सी गैस देता है?
(क) H2
(ख) O2
(ग) Cl2
(घ) CO2
दैनिक जीवन में रसायन कक्षा 10 पाठ 5 9.
साबुन कार्य करता है
(क) मृदु जल में
(ख) कठोर जल में
(ग) कठोर व मृद दोनों में
(घ) इनमें से कोई नहीं
RBSE Solution Class 10 Science Chapter 5 10.
मिसेल निर्माण में हाइड्रोकार्बन पूंछ होती है
(क) अंदर की तरफ
(ख) बाहर की तरफ
(ग) परिवर्तनशील
(घ) किसी भी तरफ
RBSE Class 10th Science Solution 11.
प्रोटॉन [H+] ग्रहण करने वाले यौगिक होते हैं
(क) अम्ल
(ख) लवण
(ग) इनमें से कोई नहीं
(घ) क्षार
उत्तरमाला-
1. (ख)
2. (ख)
3. (ग)
4. (घ)
5. (क)
6. (ख)
7. (घ)
8. (ग)
9. (क)
10. (क)
11. (घ)।
अतिलघूत्तरात्मक प्रश्न
RBSE 10th Class Science Book प्रश्न 12.
लाल चींटी के डंक में कौनसा अम्ल पाया जाता है?
उत्तर-
लाल चींटी के डंक में फार्मिक अम्ल (HCOOH) पाया जाता है।
RBSE Solutions For Class 10 Science प्रश्न 13.
प्रोटॉन त्यागने वाले यौगिक क्या कहलाते हैं ?
उत्तर-
प्रोटॉन त्यागने वाले यौगिक अम्ल कहलाते हैं।
10th RBSE Science Book प्रश्न 14.
उदासीनीकरण से क्या समझते हैं ?
उत्तर-
अम्ल क्षारों से अभिक्रिया करके अपने गुण खो देते हैं तथा उदासीन हो जाते हैं। यह क्रिया उदासीनीकरण कहलाती है। इसमें लवण तथा जल बनते हैं।
उदाहरण- NaOH + HCl → NaCl + H2O
10th Class Science Notes In Hindi Pdf Download RBSE प्रश्न 15.
पेयजल को जीवाणुमुक्त कैसे किया जा सकता है?
उत्तर-
पेयजल को विरंजक चूर्ण (CaOCl2) द्वारा जीवाणुमुक्त किया जा सकता है।
RBSE Solution Class 10 Science प्रश्न 16.
अम्ल से धात्विक ऑक्साइड की अभिक्रिया किस प्रकार होती है? समीकरण दें।
उत्तर-
अम्ल, धात्विक ऑक्साइड से क्रिया करके लवण व जल बनाते हैं।
उदाहरण- 2HCl अम्ल + MgO धात्विक ऑक्साइड → MgCl2 लवण + H2O
10th Science Book RBSE प्रश्न 17.
pH में p एवं H किसको सूचित करते हैं?
उत्तर-
pH में p एक जर्मन शब्द पुसांस अर्थात् शक्ति तथा H, हाइड्रोजन आयनों का सूचक है।
RBSE 10th Solution Science प्रश्न 18.
हमारे उदर में उत्पन्न अत्यधिक अम्लता से राहत पाने के लिए क्या उपचार लेंगे?
उत्तर-
हमारे उदर में उत्पन्न अत्यधिक अम्लता से राहत पाने के लिए दुर्बल। क्षार जैसे मैग्नीशियम हाइड्रॉक्साइड [Mg(OH)2] जिसे मिल्क ऑफ मैग्नीशिया भी कहते हैं, का प्रयोग किया जाता है जो कि एन्टएसिड होता है।
RBSE 10th Science Solution In Hindi प्रश्न 19.
सोडियम के दो लवणों का नाम लिखें।
उत्तर-
- धावन सोडा (सोडियम कार्बोनेट)-Na2CO2.10H2O
- साधारण नमक (सोडियम क्लोराइड)-NaCl
दैनिक जीवन में रसायन कक्षा 10 Notes प्रश्न 20.
लुइस के अनुसार क्षार की परिभाषा दें।
उत्तर-
इलेक्ट्रॉन धनी या एकाकी इलेक्ट्रॉन युग्म युक्त यौगिक इलेक्ट्रॉन युग्म त्यागते हैं, इन्हें लुइस क्षार कहते हैं। जैसे NH3
दैनिक जीवन में रसायन Pdf प्रश्न 21.
साबुनीकरण किसे कहते हैं ?
उत्तर-
उच्च वसा अम्लों को सोडियम हाइड्रॉक्साइड या पोटेशियम हाइड्रॉक्साइड के जलीय विलयन के साथ गर्म करने पर साबुन बनता है। इस प्रक्रिया को साबुनीकरण कहते हैं।
RBSE Class 10 Science Chapter 5 प्रश्न 22.
अपमार्जक की क्या विशेषता है?
उत्तर-
अपमार्जक कठोर जल तथा मृदु दोनों ही प्रकार के जल में सफाई का कार्य करते हैं।
कक्षा 10 विज्ञान पाठ 5 प्रश्न 23.
हड्डी टूट जाने पर प्लास्टर चढ़ाने में किस यौगिक का प्रयोग किया जाता है?
उत्तरे-
प्लास्टर ऑफ पेरिस (CaSO4.½H2O)
RBSE Solutions For Class 10 Social Science प्रश्न 24.
एक विलयन में हाइड्रोजन आयन की सान्द्रता 1 x 10-4 gm mole L-1 है। विलयन का pH मान ज्ञात करें। बताइए कि यह विलयन अम्लीय होगा या क्षारीय?
उत्तर-
pH = – log [H+]
pH = – log [1 x 10-4]
pH = – (log 1 + log 10-4)
pH = – (0 – 4 log 10)
pH = 4
यह विलयन अम्लीय होगा क्योंकि अम्लीय विलयन की pH, 7 से कम होती है।
लघूत्तरात्मक प्रश्न
RBSE Class 10 Science Solution प्रश्न 25.
दो प्रबल अम्ल एवं दो प्रबल क्षारों के नाम तथा उपयोग लिखें।
उत्तर-
(a) प्रबल अम्ल-
- हाइड्रोक्लोरिक अम्ल (HCl)-यह अम्लराज बनाने में प्रयुक्त होता है जो कि सोने जैसी धातु को भी विलेय कर देता है। अम्लराज बनाने के लिए इसे HNO3 के साथ मिलाया जाता है।
- सल्फ्यूरिक अम्ल (H2SO4)-यह सेल, कार बैटरी तथा उद्योगों में काम आता है।
(b) प्रबल क्षार-
- सोडियम हाइड्रॉक्साइड (NaOH)-इसे बॉक्साइट के धातुकर्म तथा पेट्रोलियम के शोधन में प्रयुक्त किया जाता है।
- पोटैशियम हाइड्रॉक्साइड (KOH)-इसे साबुन तथा अन्य उद्योगों में प्रयुक्त किया जाता है।
RBSE Class 10 Science Solutions प्रश्न 26.
साबुन एवं अपमार्जक में अंतर बताइए।
उत्तर-
साबुन और अपमार्जक में अन्तर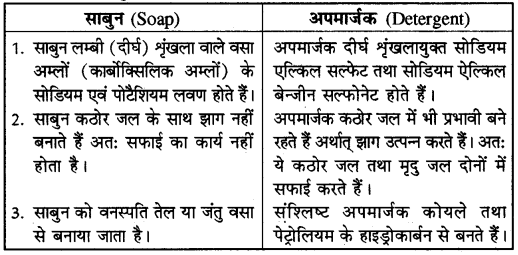
RBSE Science Book Class 10 प्रश्न 27.
आरेनियस के अनुसार अम्ल एवं क्षार की परिभाषाएं लिखिए।
उत्तर-
आरेनियस के अनुसार अम्ल वे पदार्थ हैं जो जलीय विलयन में H+
या H3O+ देते हैं। जलीय विलयन में H+ स्वतंत्र नहीं रहता। यह H2O से क्रिया करके H3O+ बना लेता है। जैसे-HCl, HNO3 इत्यादि।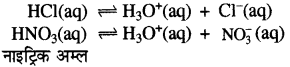
क्षारक वे पदार्थ हैं जो जलीय विलयन में OH- (हाइड्रॉक्साइड). आयन देते हैं। जैसे-NaOH, KOH इत्यादि।![]()
RBSE Class 10 Science प्रश्न 28.
pH किसे कहते हैं? अम्लीय एवं क्षारीय विलयनों की pH परास को स्पष्ट करें।
उत्तर-
pH स्केल किसी विलयन में उपस्थित हाइड्रोजन आयन की सान्द्रता को मापता है।
अर्थात् हाइड्रोजन आयनों की सान्द्रता के ऋणात्मक लागेरिथ्म (लघुगणक) को pH कहते हैं।
pH = – log10 [H+]
H+ जल से क्रिया करके [H3O+] हाइड्रोनियम आयन बनाते हैं। अतः pH को निम्न प्रकार भी दिया जाता है
pH = – log10 [H3O+]
[H+] आयनों की सान्द्रता जितनी अधिक होगी pH का मान उतना ही कम होगा। जल उदासीन होता है जिसके उदासीन लिए [H+] तथा [-OH] आयनों की सान्द्रता 1 x 10-7 मोल/लिटर होती हैं। अतः इसकी pH 7 होगी।
इस प्रकार
pH = 0 से < 7 तक विलयन अम्लीय,
pH = 7 विलयन उदासीन,
pH > 7 से 14 तक विलयन क्षारीय होता है।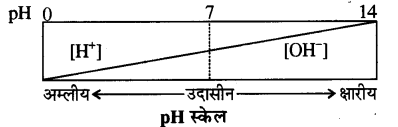
RBSE 10th Science Book प्रश्न 29.
क्रिस्टलन जल किसे कहते हैं? उदाहरण दें।
उत्तर-
किसी लवण के इकाई सूत्र में उपस्थित जल के अणुओं की निश्चित संख्या को क्रिस्टलन जल कहते हैं। जैसे-Na2CO3.10H2O
यहाँ सोडियम कार्बोनेट लवण में 10 अणु जल के क्रिस्टलन जल के रूप में हैं। अन्य उदाहरण –
CaSO4.2H2O, (जिप्सम) K2SO4.Al2(SO4)3.24H2O.(फिटकरी)
Class 10 RBSE Science Book प्रश्न 30.
क्या होता है जब
- दही या खट्टे पदार्थों को धातु के बर्तनों में रखा जाता है?
- रात्रि में भोजन के पश्चात् दाँतों को साफ नहीं किया जाता है?
उत्तर-
- दही एवं खट्टे पदार्थ अम्लीय होते हैं। अतः जब इन्हें पीतल एवं ताँबे जैसी धातुओं के बर्तनों में रखा जाता है, तो ये अम्लों की उपस्थिति के कारण पीतल एवं ताँबा की सतह से क्रिया कर विषैले यौगिकों का निर्माण करते हैं, जो हमारे शरीर के लिए हानिकारक होते हैं।
- रात्रि में भोजन के पश्चात् दाँतों को साफ नहीं करने पर मुख में उपस्थित बैक्टीरिया दाँतों में लगे अवशिष्ट भोजन से क्रिया करके अम्ल उत्पन्न करते हैं, ‘जिससे मुख की pH कम हो जाती है तथा pH का मान 5.5 से कम होने पर दाँतों के इनैमल का क्षय होने लगता है।
RBSE Class 10 Science Book In English प्रश्न 31.
एक यौगिक A अम्ल H2SO4, से क्रिया करता है तथा बुदबुदाहट के साथ गैस B निकालता है। गैस B जलाने पर फट-फट ध्वनि के साथ जलती है। A व B का नाम बताइए तथा अभिक्रिया का समीकरण दें।
उत्तर-
तत्व A, जिंक (Zn) है तथा गैस B, हाइड्रोजन है, जिसे जलाने पर यह फट-फट की ध्वनि के साथ जलती है।
समीकरण- Zn(s) जिंक + H2SO4(aq) सल्फ्यूरिक अम्ल, → ZnSO4(aq) जिंक सल्फेट + H2(g) हाइड्रोजन
निबन्धात्मक प्रश्न
Class 10 Science RBSE प्रश्न 32.
ब्रांस्टेड-लोरी तथा लुइस के अनुसार अम्ल एवं क्षार को स्पष्ट करें।
उत्तर-
ब्रांस्टेड-लोरी संकल्पना–ब्रांस्टेड-लोरी के अनुसार ‘अम्ल प्रोटॉन दाता होते हैं तथा क्षार प्रोटॉन ग्राही होते हैं।” उन्होंने संयुग्मी अम्ल एवं संयुग्मी क्षारक की अवधारणा भी दी।![]()
(HA – A–) को अम्ल-संयुग्मी क्षार युग्म तथा (B – HB+) को क्षारसंयुग्मी अम्ल युग्म कहते हैं।
उदाहरण-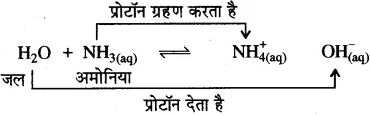
यहाँ जल प्रोटॉन दाता है अतः यह अम्ल है, यह प्रोटॉन देकर संगत संयुग्मी क्षार (OH–) में परिवर्तित हो जाता है। अमोनिया (NH3) प्रोटॉन ग्राही है, अतः यह क्षार है और यह प्रोटॉन ग्रहण करके संगत संयुग्मी अम्ल (NH4+) अमोनियम आयन में परिवर्तित हो जाता है। NH4+ – NH3 तथा H2O – OH– युग्मों को संयुग्मी अम्ल-क्षार युग्म कहते हैं। अतः संयुग्मी अम्ल-क्षार युग्म में केवल एक प्रोटॉन (H+) का अन्तर होता है।
अन्य उदाहरण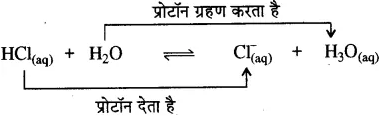
लुइस संकल्पना-लुइस के अनुसार अम्ल वे पदार्थ हैं जो इलेक्ट्रॉन युग्म ग्रहण करते हैं तथा क्षार वे पदार्थ होते हैं जो इलेक्ट्रॉन युग्म त्यागते हैं। अतः अम्ल इलेक्ट्रॉन युग्म ग्राही तथा क्षार इलेक्ट्रॉन युग्म दाता होते हैं।
जैसे- BE3, अम्ल + :NH3, क्षार → F3B ← NH3
लुइस अम्ल तथा लुइस क्षार आपस में मिलकर उपसहसंयोजक बन्ध द्वारा योगात्मक यौगिक बनाते हैं। उपरोक्त उदाहरण में BF3, अपना अष्टक पूर्ण करने के लिए अमोनिया से एक इलेक्ट्रॉन युग्म ग्रहण कर रहा है।
इस संकल्पना के अनुसार इलेक्ट्रॉन की कमी वाले यौगिक अम्ल का कार्य करते हैं। साधारणतया धनायन, या वे यौगिक जिनका अष्टक अपूर्ण होता है, लुइस अम्ल होते हैं। जैसे-BF3, AlCl3, Mg+2, Na+ आदि।
इलेक्ट्रॉन धनी या एकाकी इलेक्ट्रॉन युग्म रखने वाले यौगिक लुइस क्षार का कार्य करते हैं। उदाहरण-H2O::, :NH3, OH–, Cl– आदि।।
अतः केवल H+ या OH- युक्त पदार्थ ही अम्ल एवं क्षार नहीं होते हैं। इन संकल्पनाओं के आधार पर हाइड्रोजन रहित यौगिको के अम्लीय तथा क्षारीय गुणों की व्याख्या भी की जा सकती है।
RBSE Science Solution Class 10 प्रश्न 33.
pH के सामान्य जीवन में उपयोग बताइए।
उत्तर-
हमारे सामान्य जीवन (दैनिक जीवन) में pH के उपयोग निम्नलिखित हैं
- उदर में अम्लता- हमारे पाचन तंत्र में pH का बहुत महत्त्व होता है। हमारे उदर के जठर रस में हाइड्रोक्लोरिक अम्ल (HCl) होता है। यह उदर को हानि पहुँचाए बिना भोजन के पाचन में सहायक होता है। उदर में अम्लता की स्थिति में, उदर अत्यधिक मात्रा में अम्ल उत्पन्न करता है, जिसके कारण उदर में दर्द एवं जलन का अनुभव होता है। इसके लिए ऐन्टैसिड का उपयोग किया जाता है। यह ऐन्टैसिड अम्ल की आधिक्य मात्रा को उदासीन कर देता है। इसके लिए मैग्नीशियम हाइड्रॉक्साइड (मिल्क ऑफ मैगनीशिया) [Mg(OH)2] जैसे दुर्बल क्षारकों को उपयोग किया जाता है।
- दंत क्षय- मुख की pH साधारणतया 6.5 के करीब होती है। खाना खाने के पश्चात् मुख में उपस्थित बैक्टीरिया दाँतों में लगे अवशिष्ट भोजन (शर्करा एवं खाद्य पदार्थ) से क्रिया करके अम्ल उत्पन्न करते हैं, जो कि मुख की pH कम कर देते हैं। pH का मान 5.5 से कम होने पर दाँतों का इनैमल, जो कि कैल्सियम फास्फेट का बना होता है, का क्षय होने लग जाता है। अतः भोजन के पश्चात् दंतमंजन या क्षारीय विलयन से मुख की सफाई अवश्य करनी चाहिए, जिससे अम्ल की आधिक्य मात्रा उदासीन हो जाती है, इससे दंतक्षय पर नियंत्रण पाया जा सकता है।
- कीटों का डंक- मधुमक्खी, चींटी तथा मकोड़े जैसे कीटों के डंक अम्ल स्रावित करते हैं, जो हमारी त्वचा के सम्पर्क में आता है। जिसके कारण ही त्वचा पर जलन तथा दर्द होता है। दुर्बल क्षारकीय लवणों जैसे सोडियम हाइड्रोजन कार्बोनेट (NaHCO3) का प्रयोग उस स्थान पर करने पर अम्ल का प्रभाव नष्ट हो जाता है।
- अम्ल वर्षा- वर्षा के जल को सामान्यतः शुद्ध माना जाता है लेकिन जब वर्षा के जल की pH 5.6 से कम हो जाती है तो इसे अम्लीय वर्षा कहते हैं। इस वर्षा जल से नदी तथा खेतों की मिट्टी प्रभावित होती है, जिससे फसलों, जीवों तथा पारिस्थितिक तंत्र को नुकसान होता है। अतः प्रदूषकों को नियंत्रित करके अम्ल वर्षा को कम किया जा सकता है।
- मृदा की pH- अच्छी उपज के लिए पौधों को एक विशिष्ट pH की आवश्यकता होती है। अतः विभिन्न स्थानों की मिट्टी की pH ज्ञात करके उसमें बोई जाने वाली फसलों का चयन किया जा सकता है तथा आवश्यकता अनुसार उसका उपचार किया जाता है। जब मिट्टी अधिक अम्लीय होती है तो उसमें चूना (CaO) मिलाया जाता है तथा मिट्टी के क्षारीय होने पर उसमें कोई अम्लीय पदार्थ मिलाकर उचित pH पर लाया जाता है। pH के अनुसार ही उपयुक्त उर्वरक का प्रयोग किया जाता है, जिससे अच्छी फसल प्राप्त होती है।
Science RBSE Class 10 प्रश्न 34.
निम्नलिखित के नाम, बनाने की विधि तथा उपयोग लिखिए
(i) NaOH
(ii) NaHCO3
(iii) Na2CO3.10H2O
(iv) CaOCl2,
(v) CaSO4.½H2O
उत्तर-
(i) NaOH-इसका नाम सोडियम हाइड्रॉक्साइड है तथा इसे कास्टिक सोडा भी कहते हैं।
बनाने की विधि-औद्योगिक स्तर पर सोडियम हाइड्रॉक्साइड का उत्पादन सोडियम क्लोराइड के विद्युत अपघटन द्वारा किया जाता है। इस प्रक्रिया में एनोड पर क्लोरीन गैस तथा कैथोड पर हाइड्रोजन गैस बनती है। इसके साथ ही कैथोड पर विलयन के रूप में सोडियम हाइड्रॉक्साइड भी प्राप्त होता है।
2NaCl(aq) + 2H2O → 2NaOH(aq) + Cl2(g) + H(g)
उपयोग- NaOH के उपयोग निम्न हैं
- साबुन, कागज, सिल्क उद्योग तथा अन्य रसायनों के निर्माण में
- बॉक्साइट के धातुकर्म में
- पेट्रोलियम के शोधन में
- वसा तथा तेलों के निर्माण में
- प्रयोगशाला अभिकर्मक के रूप में
(ii) NaHCO3-इसे बेकिंग सोडा या खाने का सोडा कहते हैं। इसका रासायनिक नाम सोडियम हाइड्रोजन कार्बोनेट है।
बनाने की विधि-
(a) NaCl की NH3 तथा CO2 गैस से अभिक्रिया द्वारा NaHCO3 का निर्माण किया जाता है।
NaCl + H2O + CO2 + NH3 → NH4Cl अमोनियम क्लोराइड + NaHCO3
(b) सोडियम कार्बोनेट के जलीय विलयन में कार्बन डाईऑक्साइड गैस प्रवाहित करने से भी NaHCO3 का निर्माण होता है।
Na2CO3 सोडियम कार्बोनेट + CO2 + H2O → 2NaHCO3 सोडियम हाइड्रोजन ,कार्बोनेट
उपयोग-NaHCO3 के उपयोग निम्न प्रकार हैं
- खाद्य पदार्थों में बेकिंग पाउडर के रूप में, जो कि बेकिंग सोडा तथा टार्टरिक अम्ल का मिश्रण होता है।
- सोडा वाटर तथा सोडायुक्त शीतल पेय बनाने में,
- पेट की अम्लता को दूर करने में एन्टा एसिड के रूप में,
- मंद पूतिरोधी के रूप में,
- अग्निशामक यंत्र में,
- प्रयोगशाला अभिकर्मक के रूप में।
(iii) Na2CO3.10H2O-इसे कपड़े धोने का सोडा ( धावन सोडा) कहते हैं। इसका रासायनिक नाम सोडियम कार्बोनेट है।
बनाने की विधि-
(a) सोडियम कार्बोनेट का निर्माण साल्वे विधि से किया जाता है, जिसमें सोडियम क्लोराइड प्रयुक्त किया जाता है।
(b) बेकिंग सोडा को गर्म करने पर भी सोडियम कार्बोनेट प्राप्त होता है। इसका पुनः क्रिस्टलीकरण करने पर कपड़े धोने का सोडा प्राप्त होता है।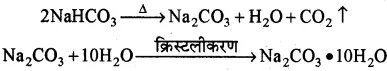
उपयोग- धावन सोडा के उपयोग निम्न हैं
- धुलाई एवं सफाई में,
- कास्टिक सोडा, बेकिंग पाउडर, काँच, साबुन तथा बोरेक्स के निर्माण में,
- अपमार्जक के रूप में,
- कागज, पेन्ट तथा वस्त्र उद्योग में,
- प्रयोगशाला में अभिकर्मक के रूप में।
(iv) CaOCl2– इसे विरंजक चूर्ण कहते हैं तथा इसका रासायनिक नाम कैल्सियम ऑक्सीक्लोराइड है।
बनाने की विधि-शुष्क बुझे हुए चूने पर क्लोरीन गैस प्रवाहित करने से विरंजक चूर्ण बनता है।
Ca(OH)2 + Cl2 → CaOCl2 + H2O
कैल्शियम हाइड्रॉक्साइड
उपयोग-विरंजक चूर्ण के उपयोग निम्न हैं
- वस्त्र उद्योग तथा कागज उद्योग में विरंजक के रूप में,
- पेयजल को शुद्ध करने में,
- रोगाणुनाशक एवं ऑक्सीकारक के रूप में,
- प्रयोगशाला में अभिकर्मक के रूप में।
(v) CaSO4.½H2O-इसे प्लास्टर ऑफ पेरिस (P.O.P) कहते हैं। इसका रासायनिक नाम कैल्सियम सल्फेट अर्धहाइड्रेट (हेमी हाइड्रेट) है। फ्रांस की राजधानी पेरिस में सर्वप्रथम जिप्सम को गर्म करके इसे बनाया गया था अतः इसका नाम प्लास्टर ऑफ पेरिस रख दिया गया।
बनाने की विधि
जिप्सम (CaSO4.2H2O) को 393K ताप पर गर्म करने पर प्लास्टर ऑफ पेरिस प्राप्त होता है।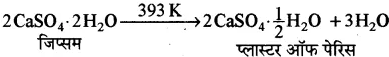
P.O.P. को और अधिक गर्म करने पर सम्पूर्ण क्रिस्टलन जल बाहर निकल जाता है और मृत तापित प्लास्टर [CaSO4] प्राप्त होता है।
उपयोग- प्लास्टर ऑफ पेरिस के उपयोग निम्न हैं
- टूटी हुई हड्डियों को सही स्थान पर स्थिर करने तथा जोड़ने के लिए प्लास्टर चढ़ाने में,
- अग्निसह पदार्थ के रूप में,
- भवन निर्माण में,
- दंत चिकित्सा में,
- मूर्तियाँ तथा सजावटी सामान बनाने में।
Class 10th RBSE Science Solution प्रश्न 35.
मिसेल कैसे बनते हैं? क्रियाविधि भी दें।
उत्तर-
साबुन तथा अपमार्जक, मिसेल बनाकर ही शोधन की क्रिया करते हैं। सर्वप्रथम साबुन (जैसे सोडियम स्टिएरेट) के अणुओं का जल में आयनन होता है।
C17H35COONa → C17H35COO– + Na+
सोडियम स्टिएरेट
इसे सामान्य सूत्र के रूप में इस प्रकार भी लिख सकते हैं|
R COONa → R COO– + Na+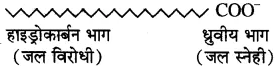
इसमें हाइड्रोकार्बन पूंछ (R) जल विरोधी तथा ध्रुवीय सिरा जल स्नेही होता है। ये दोनों भाग इस प्रकार व्यवस्थित होते हैं कि हाइड्रोकार्बन भाग चिकनाई के अंदर की तरफ तथा ऋणावेशित ध्रुवीय सिरा बाहर की तरफ होता है। इसे मिसेल कहते हैं ।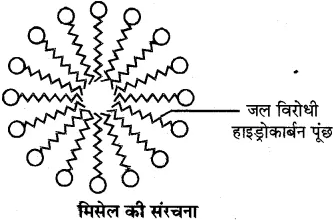
क्रियाविधि-अधिकांश गंदगी, तेल की बूंद तथा चिकनाई जल में अघुलनशील परन्तु हाइड्रोकार्बन में घुलनशील होती है। साबुन के द्वारा सफाई की प्रक्रिया में चिकनाई के चारों तरफ साबुन के अणु मिसेल बनाते हैं। इसमें जल विरोधी हाइड्रोकार्बन भाग चिकनाई को अपनी ओर आकर्षित करता है तथा जलस्नेही ध्रुवीय भाग बाहर की तरफ रहता है। इस प्रकार यह चिकनाई को चारों ओर से घेर कर मिसेल बना लेता है। बाहरी सिरे पर उपस्थित ध्रुवीय सिरे जल से आकर्षित होते हैं, इससे सम्पूर्ण चिकनाई जल की तरफ खिंचकर बाहर निकल जाती है।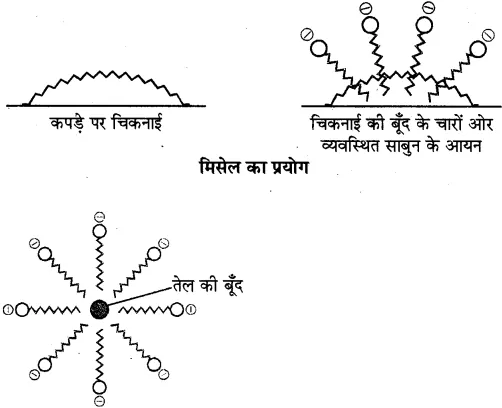
शोधन क्रिया-साबुन के द्वारा घिरी चिकनाई की बूंद (मिसेल)
सभी मिसेल ऋणावेशित (समान आवेशित) होते हैं अतः इनका अवक्षेपण नहीं होता है तथा ये मिसेल, विलयन में कोलॉइडी अवस्था में रहते हैं। इस प्रकार जब गंदे कपड़े को साबुन लगाने के पश्चात् पानी में डालकर निकाला जाता है तो गंदगी कपड़े से पृथक् होकर पानी में आ जाती है तथा कपड़ा साफ हो जाता है।
( अन्य महत्त्वपूर्ण प्रश्नोत्तर )
वस्तुनिष्ठ प्रश्न
1. दाँत साफ करने के लिए प्रयुक्त टूथपेस्ट की प्रकृति किस प्रकार की होती है?
(अ) क्षारीय
(ब) अम्लीय
(स) उदासीन
(द) संक्षारकीय
2. पीने के पानी को जीवाणुओं से मुक्त करने के लिए निम्न में से किसका उपयोग किया जाता है?
(अ) बेकिंग सोडा
(ब) विरंजक चूर्ण
(स) धोने का सोडा
(द) उपरोक्त में से कोई नहीं
3. आसुत जल की pH का मान होता है
(अ) 9
(ब) 7
(स) 5
(द) 3
4. हमारे रुधिर की प्रकृति होती है
(अ) अम्लीय
(ब) क्षारीय
(स) उदासीन
(द) कुछ अम्लीय व कुछ क्षारीय
5. अधातुओं के ऑक्साइडों की प्रकृति होती है
(अ) क्षारीय
(ब) अम्लीय
(स) उदासीन
(द) अक्रिय
6. बेकिंग सोडा को गर्म करने पर निम्न में से कौनसा यौगिक बनता है?
(अ) NaNO3
(ब) Na2CO3
(स) NH4Cl
(द) NaHCO3
7. कोई विलयन अंडे के पिसे हुए कवच से अभिक्रिया कर एक गैस उत्पन्न करता है जो चूने के पानी को दूधिया कर देती है तो इस विलयन में निम्नलिखित में से कौनसा यौगिक होगा?
(अ) NaCl
(ब) HCl
(स) LiCl
(द) KCl
8. तनु सल्फ्यूरिक अम्ल की क्रिया निम्न में से किससे कराने पर हाइड्रोजन गैस निकलती है?
(अ) Zn
(ब) Mg
(स) Fe
(द) उपरोक्त सभी
9. साबुन बनाने की प्रक्रिया में सहउत्पाद है
(अ) NaOH
(ब) ग्लिसरॉल
(स) वसा व अम्ल
(द) ऐल्कोहॉल
10. अपमार्जक सामान्यतः होते हैं
(अ) RCOONa
(ब) RCOOK
(स) RSO4Na .
(द) RCOOR
उत्तरमाला-
1. (अ)
2. (ब)
3. (ब)
4. (ब)
5. (ब)
6. (ब)
7. (ब)
8. (द)
9. (ब)
10. (स)।
अतिलघूत्तरात्मक प्रश्न
प्रश्न 1.
बेकिंग पाउडर के निर्माण में प्रयुक्त प्रमुख घटक लिखिए।
उत्तर-
- NaCl (सोडियम क्लोराइड)
- CO2, NH3 इत्यादि।
प्रश्न 2.
दो अम्लीय ऑक्साइडों के नाम लिखिए जिनके द्वारा अम्ल वर्षा होती
उत्तर-
प्रश्न 3.
ऐसे दो यौगिकों के नाम बताइए जिनमें हाइड्रोजन है, लेकिन वे अम्ल नहीं हैं तथा उनके विलयन में विद्युत का चालन नहीं होता।
उत्तर-
ऐल्कोहॉल (C2H5OH) तथा ग्लुकोज (C6H12O6
प्रश्न 4.
हाइड्रोजन आयन की सान्द्रता मापने की विधि किस वैज्ञानिक द्वारा दी गई थी?
उत्तर-
सोरेन्सन
प्रश्न 5.
टमाटर के रस का pH कितना होता है?
उत्तर-
टमाटर का रस अम्लीय होता है तथा इसके pH का मान 4.0-4.4 होता है।
प्रश्न 6.
मनुष्य के मूत्र के pH का मान बताइए।
उत्तर-
pH = 5.5-7.5
प्रश्न 7.
Zn की NaOH विलयन से क्रिया करवाने पर H2 गैस प्राप्त होती है। इस अभिक्रिया का समीकरण लिखिए।
उत्तर-
Zn(s) + 2NaOH(aq) → Na2ZnO2(aq) सोडियम जिंकेट + H2
प्रश्न 8.
धातुओं के ऑक्साइड की प्रकृति सामान्यतः कैसी होती है? दो उदाहरण दीजिए।
उत्तर-
धातुओं के ऑक्साइड सामान्यतः क्षारीय प्रकृति के होते हैं, जैसे CaO, MgO.
प्रश्न 9.
प्रबल अम्लों तथा प्रबल क्षारों के दो-दो उदाहरण दीजिए।
उत्तर-
प्रबल अम्ल-HCl (हाइड्रोक्लोरिक अम्ल), H2SO4 (सल्फ्यूरिक अम्ल)।
प्रबल क्षार-NaOH (सोडियम हाइड्रॉक्साइड), KOH (पोटैशियम हाइड्रॉक्साइड)।
प्रश्न 10.
दुर्बल अम्ल तथा दुर्बल क्षारों के दो-दो उदाहरण लिखिए।
उत्तर-
दुर्बल अम्ल- CH3COOH, HCN
दुर्बल क्षार- NH4OH, Mg(OH)2
प्रश्न 11.
निम्न में से किसका pH अधिक होता है
(i) रक्त अथवा आसुत जल
(ii) जठर रस अथवा नींबू का रस?
उत्तर-
(i) रक्त
(ii) जठर रस।।
प्रश्न 12.
जठर रस की pH कितनी होती है?
उत्तर-
जठर रस की pH लगभग 1.2 होती है।
प्रश्न 13.
टमाटर में कौनसा अम्ल पाया जाता है?
उत्तर-
टमाटर में ऑक्सैलिक अम्ल पाया जाता है।
प्रश्न 14.
सोडियम वर्ग के चार लवण बताइए।
उत्तर-
सोडियम सल्फेट (Na2SO4), सोडियम क्लोराइड (NaCl), सोडियम नाइट्रेट (NaNO3), सोडियम कार्बोनेट (Na2CO3)
प्रश्न 15.
सोडियम एसीटेट का जलीय विलयन क्षारीय होता है, क्यों?
उत्तर-
सोडियम एसीटेट (CH3COONa), दुर्बल अम्ल (CH3COOH) तथा प्रबल क्षार (NaOH) से बना लवण है अतः इसका जलीय विलयन क्षारीय होता है।
प्रश्न 16.
सोडियम क्लोराइड के जलीय विलयन में विद्युत प्रवाहित करने पर कैथोड तथा एनोड पर कौनसी गैस प्राप्त होती है?
उत्तर-
सोडियम क्लोराइड (NaCl) के जलीय विलयन में विद्युत प्रवाहित करने पर कैथोड पर H, तथा एनोड पर Cl) गैस बनती है।
प्रश्न 17.
बेकिंग सोडा के निर्माण में प्रयुक्त समीकरण लिखिए।
उत्तर-
NaCl + H2O + CO2 + NH3 → NH4Cl अमोनियम क्लोराइड + NaHCO3 बेकिंग सोडा
प्रश्न 18.
CuSO4. 5H2O का विशिष्ट नाम क्या है?
उत्तर-
CuSO4. 5H2O को नीला थोथा कहते हैं।
प्रश्न 19.
संतरे में कौनसा अम्ल उपस्थित होता है?
उत्तर-
एस्कार्बिक अम्ल ।।
प्रश्न 20.
जिप्सम का रासायनिक नाम क्या है?
उत्तर-
जिप्सम (CaSO4. 2H2O) का रासायनिक नाम कैल्सियम सल्फेट डाइहाइड्रेट है।
प्रश्न 21.
कैल्सियम कार्बोनेट (CaCO3) के विभिन्न रूप कौनसे होते हैं?
उत्तर-
चूना पत्थरे (Lime Stone), खड़िया (Chalk) एवं संगमरमर (Marble) ।।
प्रश्न 22.
मिल्क ऑफ मैग्नीशिया [Mg(OH)2] की pH कितनी होती है?
उत्तर-
pH = 10
प्रश्न 23.
विरंजक चूर्ण का रासायनिक सूत्र लिखिए।
उत्तर-
CaOCl2
प्रश्न 24.
धोवन सोडा का जलीय विलयन अम्लीय होता है अथवा क्षारीय?
उत्तर-
क्षारीय।
प्रश्न 25.
ताजे दूध का pH मान 6 होता है। इससे दही बन जाने पर इसका pH मान घटेगा या बढ़ेगा तथा क्यों ?
उत्तर-
दूध से दही बन जाने पर pH मान घटेगा क्योंकि दही में लैक्टिक अम्ल उपस्थित होता है।
प्रश्न 26.
यदि आप लिटमस पत्र (लाल एवं नीला) से साबुन की जाँच करें तो आपका प्रेक्षण क्या होगा?
उत्तर-
साबुन का विलयन क्षारीय होता है क्योंकि यह दुर्बल अम्ल एवं प्रबल क्षार से बना लवण है। अतः यह लाल लिटमस को नीला करता है, लेकिन नीले । लिटमस पर कोई प्रभाव नहीं होता।
प्रश्न 27.
सोडियम स्टिएरेट का सूत्र क्या होता है ?
उत्तर-
C17H35COO–Na+ (सोडियम स्टिएरेट)।
सुमेलन सम्बन्धी प्रश्न
प्रश्न 1.
निम्नलिखित को सुमेलित कीजिए
(i) ब्लीचिंग पाउडर (A) CaSO4. 2H2O
(ii) जिप्सम (B) (NH4)2CO3
(iii) अमोनियम कार्बोनेट (C) CaOCl2
उत्तर-
(i) (C)
(ii) (A)
(iii) (B)
प्रश्न 2.
निम्नलिखित को सुमेलित कीजिए
(i) लेक्टिक अम्ल (A) संतरा में
(ii) एसीटिक अम्ल (B) दही में
(iii) एस्कार्बिक अम्ल (C) सिरका में
उत्तर-
(i) (B)
(ii) (C)
(iii) (A)
लघूत्तरात्मक प्रश्न
प्रश्न 1.
(अ) pH पैमाने को चित्र द्वारा समझाइये।
(ब) (i) कीटों के डंक मारने पर त्वचा पर जलन क्यों होती है?
(ii) उदर में अम्लता बढ़ने पर राहत पाने के लिए दुर्बल क्षारकों का उपयोग क्यों किया जाता है? (माध्य. शिक्षा बोर्ड, मॉडल पेपर, 2017-18 )
उत्तर-
(अ) pH पैमाने का चित्र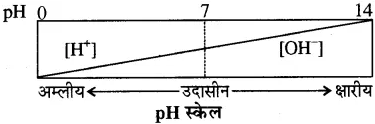
(ब) (i) कीट डंक से अम्ल स्रावित करते हैं, जैसे लाल चींटी फार्मिक अम्ल स्रावित करती है, जिसके सम्पर्क में आने पर त्वचा पर जलन होती है।
(ii) उदर में अम्लता बढ़ने पर राहत पाने के लिए दुर्बल क्षारकों जैसे Mg(OH)2, का उपयोग किया जाता है क्योंकि ये उदर में अम्ल की अधिक मात्रा को उदासीन कर देते हैं।
प्रश्न 2.
निम्नलिखित में से कौन प्रबल अम्ल एवं प्रबल क्षार है?
(अ) ऐसीटिक अम्ल अथवा हाइड्रोक्लोरिक अम्ल
(ब) सोडियम हाइड्रॉक्साइड अथवा कैल्सियम हाइड्रॉक्साइड।
उत्तर-
(अ) प्रबल अम्ल-हाइड्रोक्लोरिक अम्ल (HCl)
(ब) प्रबल क्षार-सोडियम हाइड्रॉक्साइड (NaOH)
प्रश्न 3.
pH स्केल किसे कहते हैं? स्पष्ट करो कि मुँह का pH परिवर्तन दन्त क्षय का कारण है।
उत्तर-
pH स्केल-किसी विलयन में उपस्थित हाइड्रोजन आयनों की सान्द्रता के ऋणात्मक लघुगणक को pH स्केल कहते हैं।
pH स्केल से शून्य (अधिक अम्लता) से 14 (अधिक क्षारीय) तक pH को ज्ञात कर सकते हैं। उदासीन विलयन का pH मान 7 होता है। यदि किसी विलयन का pH मान 7 से कम हो तो विलयन अम्लीय एवं pH को मान 7 से ज्यादा हो तो विलयन क्षारीय प्रकृति का होगा। ।
मुँह की pH का मान 5.5 से कम होने पर दन्त क्षय होना शुरू हो जाता है, क्योंकि मुँह में उपस्थित बैक्टीरिया दाँतों में लगे अवशिष्ट भोजन के कणों से क्रिया करके अम्ल उत्पन्न करते हैं जिससे मुख की pH कम हो जाती है तथा यही दन्त क्षय का कारण है।
प्रश्न 4.
(अ) सोडियम हाइड्राक्साइड की जिंक धातु से होने वाली क्रिया से निकलने वाली गैस का नाम लिखिए। अभिक्रिया का समीकरण भी लिखिए।
(ब) निम्नलिखित में किसका उपयोग किया जाता है?
(i) पीने के जल को जीवाणुओं से मुक्त करने के लिए
(ii) रसोईघर में स्वादिष्ट खस्ता पकौड़े बनाने में।
(iii) जल की स्थाई कठोरता दूर करने में ।
(iv) खिलौने तथा सजावट का सामान बनाने में।
उत्तर-
(अ) सोडियम हाइड्रॉक्साइड की जिंक धातु से क्रिया होने पर हाइड्रोजन (H2) गैस निकलती है।
2 NaOH + Zn → Na2ZnO2 (सोडियम जिंकेट) + H2
(ब) (i) विरंजक चूर्ण ।
(ii) बेकिंग सोडा ।
(iii) धोने का सोडा।
(iv) प्लास्टर ऑफ पेरिस।
प्रश्न 5.
स्तम्भ A से B को सुमेलित कीजिए
उत्तर-
(i) = f
(ii) = e.
(iii) = h
(iv) = d
(v) = g
(vi) = a
(vii) = b
(viii) = c
प्रश्न 6.
विज्ञान की प्रयोगशाला में उपस्थित हाइड्रोक्लोरिक अम्ल (HCl), सल्फ्यूरिक अम्ल (H2SO4), नाइट्रिक अम्ल (HNO3), ऐसीटिक अम्ल (CH3COOH), सोडियम हाइड्रॉक्साइड (NaOH), कैल्सियम हाइड्रॉक्साइड [Ca(OH)2], पोटैशियम हाइड्रॉक्साइड (KOH), मैग्नीशियम हाइड्रॉक्साइड [Mg(OH)2] एवं अमोनियम हाइड्रॉक्साइड (NH4OH) में से अम्ल तथा क्षार छाँटिए।
उत्तर-
उपरोक्त यौगिकों में से अम्ल तथा क्षार निम्न प्रकार हैं
अम्ल-HCl, H2SO4, HNO3, CH3COOH
क्षार-NaOH, Ca(OH)2, KOH, Mg(OH)2, NH4OH
प्रश्न 7.
आपको तीन परखनलियाँ दी गई हैं। इनमें से एक में आसवित जल एवं शेष दो में से एक में अम्लीय विलयन तथा दूसरे में क्षारीय विलयन है। यदि आपको केवल लाल लिटमस पत्र दिया जाता है तो आप प्रत्येक परखनली में रखे गए पदार्थों की पहचान कैसे करेंगे?
उत्तर-
तीनों परखनलियों में स्थित विलयन की क्रिया लाल लिटमस पत्र से करवाते हैं। जिस विलयन द्वारा यह लिटमस पत्र नीला हो जाएगा, वह विलयन क्षारीय होगा। अब इस नीले लिटमस पत्र की क्रिया शेष दोनों विलयनों से करवाते हैं। जिस विलयन द्वारा यह लिटमस पत्र पुनः लाल हो जाएगा, वह विलयन अम्लीय होगा तथा तीसरी परखनली में स्थित विलयन आसवित जल है क्योंकि आसवित जल उदासीन होता है अतः यह किसी भी लिटमस पत्र से कोई क्रिया नहीं करता।
प्रश्न 8.
कोई धातु यौगिक ‘A’ तनु हाइड्रोक्लोरिक अम्ल के साथ अभिक्रिया करता है तो बुदबुदाहट उत्पन्न होती है। इससे उत्पन्न गैस जलती हुई मोमबत्ती को बुझा देती है। यदि उत्पन्न यौगिकों में एक कैल्सियम क्लोराइड है तो इस अभिक्रिया के लिए संतुलित रासायनिक समीकरण लिखिए।
उत्तर-
धातु यौगिक ‘A’ कैल्सियम कार्बोनेट होगा। अभिक्रिया में उत्पन्न एक यौगिक कैल्सियम क्लोराइड है अतः यौगिक कैल्सियम युक्त होगा तथा उत्पन्न गैस जलती हुई मोमबत्ती को बुझा देती है जो कि CO2, होती है अतः यौगिक ‘A’ जो कि CaCO3 है, की तनु हाइड्रोक्लोरिक अम्ल से अभिक्रिया इस प्रकार होगी|
CaCO3(s) + 2HCl(aq) → CaCl2(aq)(कैल्सियम क्लोराइड) + H2O(l) + CO2(g)↑
प्रश्न 9.
HCl, HNO3 आदि जलीय विलयन में अम्लीय अभिलक्षण क्यों प्रदर्शित करते हैं, जबकि ऐल्कोहॉल एवं ग्लूकोज जैसे यौगिकों के विलयनों में अम्लीयता के अभिलक्षण प्रदर्शित नहीं होते हैं?
उत्तर-
HCl, HNO3 आदि जलीय विलयन में आयनित होकर H+ आयन देते हैं अतः ये अम्लीय गुण दर्शाते हैं क्योंकि अम्ल वे होते हैं जो जलीय विलयन में H+ आयन देते हैं। लेकिन ऐल्कोहॉल एवं ग्लुकोज के जलीय विलयन में H+ आयन नहीं बनते क्योंकि इनमें सहसंयोजी गुण होता है अतः ये अम्लीयता प्रदर्शित नहीं
प्रश्न 10.
शुष्क हाइड्रोक्लोरिक गैस शुष्क लिटमस पत्र के रंग को क्यों नहीं बदलती है?
उत्तर-
शुष्क हाइड्रोक्लोरिक गैस का आयनन नहीं होता अतः यह H+ नहीं देगी अर्थात् अम्लीय गुण प्रदर्शित नहीं होगा। अतः H+ आयनों की अनुपस्थिति अर्थात् अम्लीय गुण की अनुपस्थिति के कारण शुष्क लिटमस पत्र के रंग में परिवर्तन नहीं होगा।
प्रश्न 11.
अम्ल को तनुकृत करते समय यह क्यों अनुशंसित करते हैं कि अम्ल को जल में मिलाना चाहिए, न कि जल को अम्ल में?
उत्तर-
अम्ल को तनुकृत करते समय अम्ल को जल में मिलाना चाहिए, न कि जल को अम्ल में, क्योंकि जल में अम्ल या क्षारक के घुलने की प्रक्रिया अत्यंत ऊष्माक्षेपी होती है। इसलिए जल में किसी सान्द्र अम्ल को सावधानीपूर्वक मिलाना चाहिए। अम्ल को हमेशा धीरे-धीरे तथा विलयन को लगातार हिलाते हुए जल में मिलाना चाहिए।
इसके विपरीत सान्द्र अम्ल में जल मिलाने पर उत्पन्न ऊष्मा के कारण मिश्रण उछलकर बाहर आ सकता है। इससे समीप खड़े व्यक्ति को हानि भी पहुँच सकती है। इससे स्थानीय ताप भी बढ़ जाता है, जिसके कारण उपयोग किया जाने वाला कॉच का पात्र भी टूट सकता है।
प्रश्न 12.
सोडियम हाइड्रोजन कार्बोनेट के विलयन को गर्म करने पर क्या होगा? इस अभिक्रिया के लिए समीकरण लिखिए।
उत्तर-
सोडियम हाइड्रोजन कार्बोनेट के विलयन को गर्म करने पर Na2CO3 H2O तथा CO2 गैस प्राप्त होते हैं।
अभिक्रिया का समीकरण
2NaHCO3 सोडियम हाइड्रोजन कार्बोनेट → Na2CO3 सोडियम कार्बोनेट + H2O + CO2↑
प्रश्न 13.
क्या क्षारकीय विलयन में H+(aq) आयन होते हैं? अगर हाँ, तो यह क्षारकीय क्यों होता है?
उत्तर-
हाँ, क्षारकीय विलयन में H+(aq) आयन होते हैं लेकिन क्षारकीय विलयन में H+(aq) स्वतंत्र अवस्था में नहीं होते। क्षारकीय विलयन में H+ तथा OH- के मध्य साम्य होता है तथा H+(aq) की तुलना में OH- (aq) आयन अधिक मात्रा में होते हैं। अतः विलयन क्षारीय होता है।
प्रश्न 14.
कोई किसान खेत की मृदा की किस परिस्थिति में उसके उपचार के लिए बिना बुझा हुआ चूना (कैल्सियम ऑक्साइड), बुझा हुआ चूना (कैल्सियम हाइड्रॉक्साइड) या चॉक (कैल्सियम कार्बोनेट) का उपयोग करेगा?
उत्तर-
किसान अपने खेत की मिट्टी को बिना बुझा हुआ चूना (कैल्सियम ऑक्साइड), बुझा हुआ चूना (कैल्सियम हाइड्रॉक्साइड) या चॉक (कैल्सियम कार्बोनेट) से उस समय उपचारित करेगा, जब मिट्टी में अम्ल की मात्रा आवश्यकता से अधिक हो जाती है, क्योंकि ये सभी पदार्थ क्षारकीय प्रकृति के हैं, जो मिट्टी की अम्लीयता को समाप्त कर देते हैं।
प्रश्न 15.
निम्न अभिक्रियाओं के लिए पहले शब्द-समीकरण तथा संतुलित समीकरण लिखिए
(a) तनु सल्फ्यूरिक अम्ल दानेदार जिंक के साथ अभिक्रिया करता है।
(b) तनु हाइड्रोक्लोरिक अम्ल मैग्नीशियम के फीते के साथ अभिक्रिया करता है।
(c) तनु सल्फ्यूरिक अम्ल ऐलुमिनियम चूर्ण के साथ अभिक्रिया करता है।
(d) तनु हाइड्रोक्लोरिक अम्ल लौह चूर्ण के साथ अभिक्रिया करता है।
उत्तर-
(a) जिंक + तनु सल्फ्यूरिक अम्ल – जिंक सल्फेट + हाइड्रोजन गैस
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g) ↑
(b) मैग्नीशियम + तनु हाइड्रोक्लोरिक अम्ल → मैग्नीशियम क्लोराइड + हाइड्रोजन गैस
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g) ↑
(c) ऐलुमिनियम + तनु सल्फ्यूरिक अम्ल → ऐलुमिनियम सल्फेट + हाइड्रोजन गैस
2Al(s) + 3 H2SO4(aq) + Al2(SO4)3(aq) + 3H2(g) ↑
(d) लोहा + तनु हाइड्रोक्लोरिक अम्ल → फेरस क्लोराइड + हाइड्रोजन गैस
Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g) ↑
प्रश्न 16.
आसवित जल विद्युत का चालक नहीं होता जबकि वर्षा का जल होता है, क्यों?
उत्तर-
आसवित जल पूर्ण रूप से शुद्ध होता है तथा इसमें H+ आयन नहीं होते। अतः यह उदासीन होता है, इस कारण इसमें विद्युत को चालन नहीं होता जबकि वर्षा जल अम्लीय होता है अतः इसमें हाइड्रोजन आयन (H+) होते हैं। इसी कारण वर्षा जल विद्युत का चालन करता है।
प्रश्न 17.
जल की अनुपस्थिति में अम्ल अपना अम्लीय व्यवहार प्रदर्शित नहीं करता, क्यों?
उत्तर-
जलं की अनुपस्थिति में कोई भी अम्ल आयनित नहीं होता, अतः अम्ल से हाइड्रोजन आयन (H+) पृथक् नहीं हो पाते। चूँकि हाइड्रोजन आयन ही अम्ल के अम्लीय व्यवहार के लिए उत्तरदायी होते हैं, अतः जल की अनुपस्थिति में अम्ल, अम्लीय व्यवहार प्रदर्शित नहीं करता।
प्रश्न 18.
पाँच विलयनों A, B, C, D तथा E की जब सार्वत्रिक सूचक से जाँच की जाती है तो pH के मान क्रमशः 4,1, 11, 7 एवं 9 प्राप्त होते हैं, तो कौन-सा विलयन-
(a) उदासीन है?
(b) प्रबल क्षारीय है?
(c) प्रबल अम्लीय है?
(d) दुर्बल अम्लीय है?
(e) दुर्बल क्षारीय है?
pH के मानों को हाइड्रोजन आयन की सांद्रता के आरोही क्रम में व्यवस्थित कीजिए।
उत्तर-
(a) उदासीन– pH 7 वाला विलयन D उदासीन है।
(b) प्रबल क्षारीय- pH 11 वाला विलयन C प्रबल क्षारीय है।
(c) प्रबल अम्लीय– pH 1 वाला विलयन B प्रबल अम्लीय है।
(d) दुर्बल अम्लीय- pH 4 वाला विलयन A दुर्बल अम्लीय है।
(e) दुर्बल क्षारीय– pH 9 वाला विलयन E दुर्बल क्षारीय है।।
इन विलयनों की हाइड्रोजन आयन सान्द्रता का बढ़ता क्रम निम्न प्रकार होगाविलयन C< विलयन E< विलयन D < विलयन A< विलयन B
अर्थात् pH 11 < pH 9< pH 7 < pH 4 < pH 1
प्रश्न 19.
परखनली ‘A’ एवं ‘B’ में समान लंबाई का मैग्नीशियम का फीता लेकर परखनली ‘A’ में हाइड्रोक्लोरिक अम्ल (HCl) तथा परखनली B’ में ऐसिटिक अम्ल (CH3COOH) डालने पर किस परखनली में अधिक तेजी से बुदबुदाहट होगी तथा क्यों?
उत्तर-
परखनली ‘A’ में अधिक तेजी से बुदबुदाहट होगी क्योंकि Mg से HCl तथा CH3COOH दोनों ही क्रिया करके H2 गैस देते हैं। लेकिन CH3COOH की तुलना में HCl अधिक तेजी से क्रिया करता है क्योंकि यह प्रबल अम्ल है, अर्थात् HCl में हाइड्रोजन आयन की सान्द्रता अधिक होती है।
प्रश्न 20.
ताजे दूध के pH का मान 6 होता है। दही बन जाने पर इसके pH के मान में क्या परिवर्तन होगा?
उत्तर-
ताजे दूध के pH का मान 6 होता है अर्थात् यह हल्का-सा अम्लीय होता है। जब इसका किण्वन होकर यह दही बन जाता है तो pH का मान 6 से कम हो जाता है क्योंकि दही में अम्लीय गुण अधिक होता है तथा अम्लीय गुण बढ़ने पर pH के मान में कमी आती है।
प्रश्न 21.
एक ग्वाला ताजे दूध में थोड़ा बेकिंग सोडा मिलाकरे
(a) ताजा दूध के pH मान को 6 ( अम्लीय) से बदलकर थोड़ा क्षारीय बना देता है, क्यों?
(b) इस दूध को दही बनने में अधिक समय क्यों लगता है?
उत्तर-
(a) ताजा दूध में थोड़ा बेकिंग सोडा मिलाने पर दूध का pH मान 6 (अम्लीय) से बदलकर थोड़ा क्षारीय हो जाता है अर्थात् pH का मान बढ़ जाता है। क्योंकि बेकिंग सोडा (NaHCO3) क्षारीय होता है। बेकिंग सोडा दुर्बल अम्ल तथा प्रबल क्षार का लवण है। क्षारीय प्रकृति के कारण दूध के परिरक्षण के दौरान बनने वाला अम्ले उदासीन हो जाता है, जिससे दूध जल्दी खराब नहीं होता।
(b) बेकिंग सोडायुक्त दूध को दही बनने में अधिक समय लगता है क्योंकि दूध से दही बनना किण्वन की प्रक्रिया है, जो कि एक निश्चित pH मान पर ही होती है, जो कि लगभग 7 (उदासीन माध्यम) होना चाहिए जबकि NaHCO3 (बेकिंग सोडा) मिलाने पर pH बढ़ जाती है। इससे दूध से दही बनने की प्रक्रिया धीमी हो जाती है अर्थात् दूध को क्षारीय से अम्लीय होने में अधिक समय लगता है।
प्रश्न 22.
प्लास्टर ऑफ पेरिस को नमी-रोधी बर्तन में क्यों रखा जाना चाहिए?
उत्तर-
प्लास्टर ऑफ पेरिस नमी के सम्पर्क में आकर जल (H2O) के अणुओं से क्रिया करके शीघ्रता से कठोर ठोस पदार्थ जिप्सम में बदल जाता है। इस कारण इसे नमीरोधी बर्तन में रखा जाना चाहिए।
2CaSO4.½H2O प्लास्टर ऑफ पेरिस + 3H2O → 2CasO4 जिप्सम.2H2O
प्रश्न 23.
धातुओं की अम्ल तथा क्षार से अभिक्रिया कैसे होती है? क्या यह सभी धातुओं की सभी अम्लों से होती है? उदाहरण सहित समझाइए।
उत्तर-
धातुएँ अम्ल से क्रिया करके हाइड्रोजन गैस देती हैं तथा अम्ल के शेष भाग के साथ मिलकर धातु एक यौगिक बनाता है, जिसे लवण कहते हैं। अम्ल के साथ धातु की अभिक्रिया को इस प्रकार व्यक्त कर सकते हैं| अम्ल + धातु → लवण + हाइड्रोजन गैस
Mg(s) + H2SO4(aq) → MgSO4(s) + H2↑
केवल सक्रिय धातुएँ ही हाइड्रोजन अम्लों से क्रिया करके H2 देती हैं। कुछ धातुएँ क्षारों से भी क्रिया करके H2 गैस देती हैं तथा लवण भी बनाती हैं, जैसे Zn, Al इत्यादि।
Zn(s) + 2 NaOH(aq) → Na2ZnO2 सोडियम जिंकेट (लवण) + H2↑
किन्तु ऐसी अभिक्रियाएँ सभी धातुओं के साथ नहीं होती हैं।
प्रश्न 24.
धातु कार्बोनेट (Na2CO3) तथा धातु हाइड्रोजन कार्बोनेट (NaHCO3) की तनु HCl से क्रिया करवाने पर कौनसी गैस बनती है तथा इसे चूने के पानी में प्रवाहित करने पर क्या होता है? समीकरण सहित समझाइए।
उत्तर-
धातु कार्बोनेट तथा धातु हाइड्रोजन कार्बोनेट की तनु HCl से क्रिया करवाने पर CO2 गैस निकलती है तथा लवण व जल बनता है।
Na2CO3(s) + 2HCl(aq) → 2NaCl(aq) + H2O(l) + CO2(g)
NaHCO3(s) + HCl(aq) → NaCl(aq) + H2O(l) + CO2(g)
प्राप्त CO2 गैस को चूने के पानी में प्रवाहित करने पर CaCO3 का श्वेत अवक्षेप (दूधिया विलयन) बनता है लेकिन अत्यधिक मात्रा में CO2 गैस प्रवाहित करने पर कैल्सियम हाइड्रोजन कार्बोनेट [Ca(HCO3)2] बनने के कारण विलयन पुनः रंगहीन हो जाता है।
Ca(OH)2(aq) चूने का पानी + CO2(g) → CaCO3(s) कैल्सियम कार्बोनेट + H2O(l)
CaCO3(s) + H2O(l) + CO2(g) → Ca(HCO3)2(aq)(जले में विलेय)
प्रश्न 25.
धात्विक ऑक्साइड की प्रकृति अम्लीय होती है या क्षारीय? इनकी अम्ल से क्रिया कराने पर क्या होगा? उदाहरण सहित समझाइए।
उत्तर-
धात्विक ऑक्साइड सामान्यतः क्षारीय प्रकृति के होते हैं। ये अम्लों से क्रिया करके लवण तथा जल बनाते हैं, जैसे-धातु ऑक्साइड + अम्ल → लवण + जल
CuO(s) कॉपर ऑक्साइड + 2HCl(aq) →CuCl2(aq) (नील हरित रंग) कॉपर (II) क्लोराइड + H2O(l)
क्षार एवं अम्ल की अभिक्रिया के समान ही धात्विक ऑक्साइड अम्ल के साथ अभिक्रिया करके लवण तथा जल बनाते हैं। अतः धात्विक ऑक्साइडों को क्षारीय ऑक्साइड भी कहते हैं।
प्रश्न 26.
CO2 जो कि कार्बन (अधातु ) को ऑक्साइड है, क्षार Ca(OH)2 से क्रिया करके लवण व जल बनाता है। इससे क्या सिद्ध होता है?
उत्तर-
CO2 (कार्बन डाइऑक्साइड) Ca(OH)2 (क्षार) से क्रिया करके लवण व जल बनाता है। इससे यह सिद्ध होता है कि CO2 अम्लीय प्रकृति की होती है। यह क्षार एवं अम्ल के मध्य होने वाली अभिक्रिया के समान है। अतः अधातुओं के ऑक्साइड अम्लीय प्रकृति के होते हैं।
CO2(g) + Ca(OH)2(aq) →CaCO3(s) + H2O(l)
प्रश्न 27.
अम्ल एवं क्षार की शक्ति किस पर निर्भर करती है? प्रबल एवं दुर्बल अम्ल तथा प्रबल एवं दुर्बल क्षार से क्या अभिप्राय है?
उत्तर-
अम्ल एवं क्षार की शक्ति जलीय विलयन में क्रमशः H+ आयन तथा OH- आयन की संख्या पर निर्भर करती है।
प्रबल एवं दुर्बल अम्ल-जलीय विलयन में अधिक मात्रा में H+ आयन उत्पन्न करने वाले अम्ल, प्रबल अम्ल कहलाते हैं, जैसे-हाइड्रोक्लोरिक अम्ल (HCl); जबकि कम H+ आयन उत्पन्न करने वाले अम्ल, दुर्बल अम्ल कहलाते हैं, जैसे-ऐसीटिक अम्ल [CH3COOH]
प्रबल एवं दुर्बल क्षार-जलीय विलयन में अधिक मात्रा में OH- आयन देने वाले क्षार, प्रबल क्षार कहलाते हैं, जैसे-NaOH, KOH आदि; जबकि कम मात्रा में OH- आयन उत्पन्न करने वाले क्षार, दुर्बल क्षार कहलाते हैं, जैसे-NH4OH, Mg(OH)2 आदि।।
प्रश्न 28.
प्राकृतिक स्रोतों से प्राप्त होने वाले कुछ अम्लों की सूची बनाइए।
उत्तर-
प्राकृतिक स्रोतों से प्राप्त होने वाले अम्ल निम्न हैं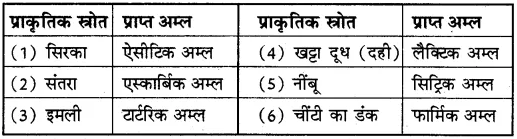
प्रश्न 29.
(a) हाइड्रोजन आयन की सान्द्रता ज्ञात करने में प्रयुक्त स्केल का नाम लिखिए।
(b) अम्ल वर्षा का कारण तथा इसके दो कुप्रभावों को लिखिए।
उत्तर-
(a) हाइड्रोजन आयन की सान्द्रता ज्ञात करने में प्रयुक्त स्केल को pH स्केल कहते हैं।
(b) अम्ल वर्षा-जब वर्षा के जल की pH का मान 5.6 से कम हो जाता है, तो इसे अम्ल वर्षा कहते हैं।
अम्ल वर्षा के कुप्रभाव-
- अम्ल वर्षा का जल जब नदी में प्रवाहित होता है तो नदी के जल का pH मान भी कम हो जाता है। ऐसे जल में जलीय जीवधारियों का जीवन कठिन हो जाता है।
- अम्ल वर्षा के सम्पर्क में आने पर चर्म रोग हो सकता है।
प्रश्न 30.
Zn धातु की तनु H2SO4, से होने वाली रासायनिक अभिक्रिया का नामांकित चित्र बनाइए। (माध्य. शिक्षा बोर्ड, 2018)
उत्तर-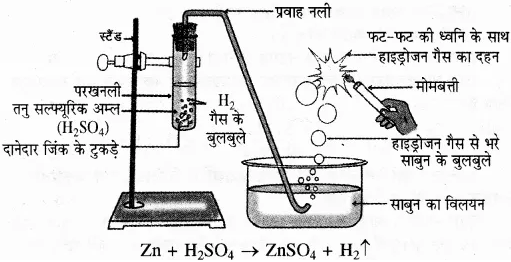
प्रश्न 31.
अम्ल-क्षार की ब्रांस्टेड-लोरी संकल्पना की कमी बताइए।
उत्तर-
अम्ल-क्षार की ब्रांस्टेड-लोरी संकल्पना अप्रोटिक अम्लों एवं क्षारों जैसे CO2SO2, BF3, Cl- इत्यादि के बारे में कुछ भी स्पष्ट नहीं करती है। अतः अम्ल-क्षार की नई इलेक्ट्रॉनिक संकल्पना दी गई।
प्रश्न 32.
बेकिंग सोडा (NaHCO3) के गुण बताइए।
उत्तर-
बेकिंग सोडा के गुण निम्नलिखित हैं
(i) बेकिंग सोडा श्वेत क्रिस्टलीय ठोस है।
(ii) यह जल में अल्प विलेय है।।
(iii) इसका जलीय विलयन क्षारीय होता है।
(iv) NaHCO3 को गर्म करने पर कार्बन डाईऑक्साइड गैस निकलती है। तथा Na2CO3 बनता है।
2NaHCO3 गर्म करने पर → Na2CO3 + H2O + CO2 ↑
प्रश्न 33.
(a) विरंजक चूर्ण की तनु अम्लों से क्रिया के समीकरण लिखिए।
(b) विरंजक चूर्ण का सूत्र लिखिए। इसकी विरंजन क्रिया को समझाइए। (माध्य. शिक्षा बोर्ड, 2018)
उत्तर-
(a) विरंजक चूर्ण तनु अम्लों से क्रिया करके क्लोरीन गैस देता है।
CaOCl2 +H2SO4 → CaSO4 + H2O + Cl2↑
CaOCl2 +2 HCl → CaCl2 + H2O + Cl2↑
(b) विरंजक चूर्ण का सूत्र CaOCl2, (कैल्सियम ऑक्सीक्लोराइड) होता है। यह वायु में क्लोरीन गैस देता है जो कि जल से क्रिया कर नवजात ऑक्सीजन [O] देती है। यह ऑक्सीजन ही विरंजन क्रिया करती है और ऑक्सीकारक की भाँति व्यवहार करती है।
Cl2 + H2O → 2HCl + [O] परमाण्विक ऑक्सीजन
रंगीन पदार्थ + [O] → रंगहीन पदार्थ
प्रश्न 34.
धावन सोडा के गुण बताइए।
उत्तर-
(i) धावन सोडा सफेद क्रिस्टलीय ठोस है।
(ii) यह जल में विलेय होता है।
(iii) इसका जलीय विलयन क्षारीय होता है।
(iv) धावन सोडा को गर्म करने पर यह क्रिस्टलन जल त्याग कर सोडा एश। बनाता है।
Na2CO3.10H2O →373k→ Na2CO3 +10H2O
प्रश्न 35.
बेकिंग सोडा को खाद्य पदार्थों में मिलाकर गर्म करने पर ये फूलकर हल्के हो जाते हैं, क्यों?
उत्तर-
बेकिंग सोडा को खाद्य पदार्थों में मिलाकर गर्म करने पर कार्बनडाइ ऑक्साइड गैस बुलबुलों के रूप में बाहर निकलती है। इससे केक जैसे खाद्य पदार्थ फूलकर हल्के हो जाते हैं और उनमें छिद्र भी पड़ जाते हैं।
प्रश्न 36.
क्या आप डिटरजेंट का उपयोग कर बता सकते हैं कि कोई जल कठोर है अथवा नहीं?
उत्तर-
डिटरजेंट के उपयोग से यह ज्ञात नहीं कर सकते कि जल कठोर है। अथवा नहीं क्योंकि डिटरजेंट कठोर जल के साथ भी झाग उत्पन्न करता है तथा कोई अवक्षेप भी नहीं देता।
प्रश्न 37.
लोग विभिन्न प्रकार से कपड़े धोते हैं। सामान्यतः साबुन लगाने के बाद लोग कपड़े को पत्थर पर पटकते हैं, डंडे से पीटते हैं, ब्रश से रगड़ते हैं या वाशिंग मशीन में कपड़े रगड़े जाते हैं। कपड़ा साफ करने के लिए उसे रगड़ने की आवश्यकता क्यों होती है?
उत्तर-
साबुन से कपड़े साफ करने के लिए उन्हें रगड़ने की आवश्यकता इसलिए पड़ती है ताकि साबुन के अणु तेल के धब्बों, मैल के कण आदि को हटने के लिए मिसेल बना सके । मिसेल गन्दे मैल या तेल के धब्बों को हयने में सहायक होता है। अतः कपड़ों को विभिन्न प्रकार से रगड़ने से इनसे गंदगी के कणों को निकालने में सहायता मिलती है।
प्रश्न 38.
कास्टिक सोडा के गुण बताइए।
उत्तर-
(i) कास्टिक सोडा श्वेत चिकना ठोस पदार्थ होता है।
(ii) इसका गलनांक 591 K होता है।
(iii) यह जल में शीघ्र विलेय हो जाता है।
(iv) यह प्रबल क्षार है तथा अपने जलीय विलयन में आयनित रूप में (Na– (aq) + OH– (aq)) रहता है। अतः यह एक प्रबल विद्युत अपघट्य भी है।
(v) इसके क्रिस्टल प्रस्वेद्य होते हैं।
प्रश्न 39.
(i) क्या साबुन एथेनॉल में मिसेल का निर्माण करता है, यदि नहीं तो क्यों?
(ii) अपमार्जक का प्रयोग कठोर जल में भी किया जा सकता है, क्यों?
उत्तर-
(i) साबुन, एथेनॉल (एथिल ऐल्कोहॉल) में मिसेल का निर्माण नहीं करता क्योंकि यह एथेनॉल में घुल जाता है।
(ii) अपमार्जक लम्बी कार्बन श्रृंखला युक्त सोडियम ऐल्किल सट तथा सोडियम ऐल्किल बेन्जीन सल्फोनेट होते हैं। इन अपमार्जकों के सोडियम आयन, कठोर जल में उपस्थित Ca2+ या Mg+2 आयनों से प्रतिस्थापित होकर कैल्सियम या मैग्नीशियम सल्फोनेट बनाते हैं जो कि जल में घुलनशील है। अतः ये साबुन के समान अवक्षेपित नहीं होते। इस प्रकार ये कठोर जल में भी प्रयुक्त किए जा सकते हैं। तथा सफाई क्रिया में कोई बाधा नहीं आती है।
प्रश्न 40.
साबुन कठोर जल में सफाई का कार्य नहीं करते हैं, क्यों?
उत्तर-
साबुन मृदु जल में सफाई का कार्य करते हैं, कठोर जल में नहीं क्योंकि कठोर जल में उपस्थित Ca2+ तथा Mg2+ आयन, साबुन के सोडियम आयनों (Na+) को प्रतिस्थापित कर उच्च वसीय अम्लों के कैल्सियम एवं मैग्नीशियम । लवण बनाते हैं जो कि जल में अविलेय होते हैं। अतः ये अवक्षेपित हो जाते हैं अतः सफाई की क्रिया आसानी से नहीं हो पाती तथा झाग उत्पन्न करने के लिए अधिक मात्रा में साबुन का उपयोग करना पड़ता है।
प्रश्न 41.
जीवन के विभिन्न क्षेत्रों में रसायनों के उपयोग का वर्णन कीजिए।
उत्तर-
रसायनों का उपयोग जीवन के प्रत्येक क्षेत्र में किया जाता है। हमारी सभी जैविक क्रियाओं का संचालन भी रसायनों द्वारा ही होता है। साबुन, अपमार्जक, वस्त्र, घरेलू उपयोग के अनेकों सामान भी रासायनिक पदार्थ ही हैं। भवन निर्माण में प्रयुक्त सीमेन्ट, विद्युत उपकरण, उपग्रह, मोटर वाहन से लेकर कृषि के क्षेत्र में रसायनों तथा रसायन विज्ञान के सिद्धान्तों का उपयोग किया जाता है। विभिन्न बीमारियों में प्रयुक्त औषधियाँ भी रसायन ही हैं। अनेकों प्रकार के खाद्य पदार्थ, खाद्य पदार्थों के परिरक्षक आदि भी रसायनों का मिश्रण ही है। अतः यह कहा जा सकता है। कि रसायनों के बिना दैनिक जीवन की कल्पना भी नहीं की जा सकती है।
प्रश्न 42.
(a) तनु तथा सान्द्र अम्ल या क्षार क्या होते हैं?
(b) विभिन्न प्रकार के लवणों की अम्लीय तथा क्षारीय प्रकृति बताइए।
उत्तर-
(a) अम्ल और क्षार जल में विलेय होते हैं। जब इनमें जल की मात्रा अधिक होती है तो ये तनु कहलाते हैं और जब जल की तुलना में अम्ल या क्षार की मात्रा अधिक होती है तो ये सान्द्र कहलाते हैं।
(b) प्रबल अम्ल तथा प्रबल क्षार से बने लवण उदासीन होते हैं। लेकिन प्रबल अम्ल तथा दुर्बल क्षार से बने लवण अम्लीय तथा दुर्बल अम्ल व प्रबल क्षार से बने लवण क्षारीय होते हैं।
प्रश्न 43.
(i) अम्ल-क्षार की आरेनियस संकल्पना की कमियाँ बताइए।
(ii) संयुग्मी अम्ल-क्षार युग्म किसे कहते हैं? उदाहरण सहित समझाइए।
उत्तर-
(i) आरेनियस की संकल्पना उन अम्लों एवं क्षारों के लिए उपयुक्त है। जिनमें क्रमशः H+ व OH– आयन होते हैं परन्तु इससे हाइड्रोजन आयन विहीन अम्लों तथा हाइड्रॉक्सिल आयन विहीन क्षारों की प्रकृति का स्पष्टीकरण नहीं होता।
(ii) जब किसी अम्ल तथा क्षार के युग्म में एक प्रोटॉन का अन्तर होता है, तो इसे संयुग्मी अम्ल क्षार युग्म कहते हैं, जैसे![]()
प्रश्न 44.
कुछ प्रमुख विलयनों की pH परास बताइए।
उत्तर-
प्रमुख विलयनों की pH परास निम्न प्रकार है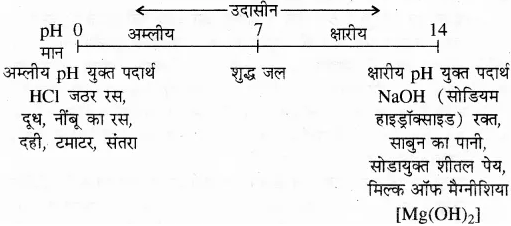
प्रश्न 45.
प्लास्टर ऑफ पेरिस के गुण बताइए।
उत्तर-
प्लास्टर ऑफ पेरिस श्वेत ठोस चिकना पदार्थ होता है। इसमें जल मिलाने पर यह 15 से 20 मिनट में जमकर ठोस तथा कठोर हो जाता है। इस अभिक्रिया में जिप्सम बनता है।
2CaSO4.½H2O प्लास्टर ऑफ पेरिस + 3H2O → 2CaSO4 जिप्सम .2H2O
निबन्धात्मक प्रश्न
प्रश्न 1.
अम्ल व क्षार की आरेनियस संकल्पना को विस्तार से समझाइए।
उत्तर-
आरेनियस (1887) के अनुसार जलीय विलयन में आयनित होकर हाइड्रोजन आयन देने वाले पदार्थ अम्ल तथा हाइड्रॉक्सिल आयन देने वाले पदार्थ क्षार कहलाते हैं।
अम्ले के उदाहरण–
HCl(aq) हाइड्रोक्लोरिक अम्ल → H+(aq) +Cl–(aq)
CH3COOH(aq) एसीटिक अम्ल → CH3COO–(aq) + H+(aq)
HNO3(aq) नाइट्रिक अम्ल → H+(aq) + NO3–(aq)
यहाँ प्राप्त प्रोटॉन (H+) अत्यधिक क्रियाशील होता है अतः यह जल से क्रिया करके हाइड्रोनियम आयन बना लेता है। |
H+ +H2O →H3O+(aq)
वे अम्ल जो जलीय विलयन में पूर्णतः आयनित हो जाते हैं, उन्हें प्रबल अम्ल कहते हैं जैसे-HCl, H2SO4, HNO3, इत्यादि जबकि वे अम्ल जो जलीय विलयन में पूर्णतः आयनित नहीं होते तथा कुछ मात्रा में अवियोजित अवस्था में भी रहते हैं, उन्हें दुर्बल अम्ल कहते हैं जैसे-CH3COOH, H2CO3, इत्यादि।
क्षार के उदाहरण-
NaOH सोडियम हाइड्रॉक्साइड → Na+(aq) + OH– (aq)
NH4OH अमोनियम हाइड्रॉक्साइड → NH4+ (aq) + OH– (aq)
अम्लों के समान वे क्षार जिनका जलीय विलयन में पूर्ण आयनन हो जाता है. उन्हें प्रबल क्षार कहते हैं, जैसे-NaOH, KOH इत्यादि तथा वे क्षार जिनका जलीय विलयन में पूर्ण आयनने नहीं होता, उन्हें दुर्बल क्षार कहते हैं, जैसे– NH4OH, Mg(OH)2 इत्यादि।
वे अम्ल जिनमें H+ नहीं होता तथा वे क्षार जिनमें OH- नहीं होता, उनका स्पष्टीकरण आरेनियस की धारणा से नहीं होता है।
प्रश्न 2.
सोडियम क्लोराइड के बनाने की विधि, गुण तथा उपयोग लिखिए।
उत्तर-
बनाने की विधि-सोडियम क्लोराइड को साधारण नमक कहते हैं। यह प्रबल अम्ल तथा प्रबल क्षार से बना लवण है अतः इसके विलयन की pH 7
होती है, अर्थात् यह उदासीन प्रकृति का होता है। सोडियम क्लोराइड व्यापारिक तौर पर समुद्र के जले या खारे पानी को सुखा कर बनाया जाता है। इस प्रकार प्राप्त नमक में कई अशुद्धियाँ जैसे मैग्नीशियम क्लोराइड (MgCl2), कैल्शियम क्लोराइड (CaCl2) होती हैं। अतः इसे शुद्ध रूप में प्राप्त करने के लिए NaCl के संतृप्त विलयन से भरी बड़ी-बड़ी टंकियों में हाइड्रोजन क्लोराइड गैस (HCl) प्रवाहित की जाती है, जिससे शुद्ध नमक (NaCl) अवक्षेपित हो जाता है, जिसे एकत्रित कर लिया जाता है।
NaCl के गुण-
- यह श्वेत ठोस पदार्थ है।
- इसका गलनांक उच्च (1081 K) होता है।
- NaCl जल में अत्यधिक विलेय होता है।
- जलीय विलयन में यह आयनित होकर Na+ तथा Cl- देता है।
उपयोग-
- NaCl का उपयोग साधारण नमक के रूप में भोजन में किया जाता है।
- इसका खाद्य परिरक्षण में भी प्रयोग किया जाता है।
- इससे हिमीकरण मिश्रण बनाया जाता है।
- NaOH, Na2CO3, NaHCO3 तथा विरंजक चूर्ण बनाने में कच्चे पदार्थ के रूप में भी NaCl को प्रयुक्त किया जाता है।
प्रश्न 3.
दैनिक जीवन में विभिन्न अम्लों, क्षारों तथा लवणों के उपयोगों पर टिप्पणी लिखिए।
उत्तर-
दैनिक जीवन में अम्लों, क्षारों तथा लवणों का उपयोग बहुत व्यापक है, जिसका वर्णन निम्न प्रकार है|
(a) अम्लों के उपयोग
- H2SO4, HCl तथा HNO3 को खनिज अम्ल कहा जाता है, जबकि पौधों तथा जन्तुओं में प्राकृतिक रूप से पाये जाने वाले अम्लों को कार्बनिक अम्ल कहते हैं। जैसे-सिट्रिक अम्ल, टार्टरिक अम्ल, एसिटिक अम्ल, लैक्टिक अम्ल आदि। खनिज अम्ल विभिन्न उद्योग-धन्धों जैसे औषधि, पेन्ट तथा उर्वरक आदि में प्रयुक्त होते हैं।
- हाइड्रोक्लोरिक अम्ल अनेक उद्योगों में, बॉयलर को साफ करने में, सिंक तथा सेनिटरी को साफ करने में विशेष रूप से प्रयुक्त किया जाता है।
- नाइट्रिक अम्ल उर्वरक बनाने, चाँदी व सोने के गहनों को साफ करने में। काम आता है। एक भाग HNO3, तथा तीन भाग HCl को मिलाने पर अम्लराज (Aqua regia) बनता है जो कि एक अत्यन्त महत्वपूर्ण मिश्रण है। अम्लराज सोने जैसे धातु को भी विलेय कर देता है।
सल्फ्यूरिक अम्ल सेल, कार बैटरी तथा उद्योगों में काम आता है। सल्फ्यूरिक अम्ल को अम्लों का राजा (King of acids) भी कहा जाता है। - कार्बनिक अम्ल जैसे एसीटिक अम्ल सिरके के रूप में खाद्य पदार्थों तथा अचार आदि को संरक्षित करने में एवं लकड़ी के फर्नीचर आदि को साफ करने में काम आता है।
(b) क्षारों के उपयोग
- विभिन्न क्षारों का भी उपयोग उद्योगों में प्रमुखता से होता है। साबुन, अपमार्जक, कागज उद्योग तथा वस्त्र उद्योगों में सोडियम हाइड्रॉक्साइड का उपयोग होता है।
- कैल्शियम हाइड्रॉक्साइड का उपयोग मिट्टी की अम्लता को दूर करने में किया जाता है। Ca(OH)2; सफेदी अर्थात् चूना तथा कीटनाशक का एक घटक भी है।
- मैग्नीशियम हाइड्रॉक्साइड [Mg(OH)2] को मिल्क ऑफ मैग्नीशिया भी कहा जाता है। यह एन्टएसिड के रूप में पेट की अम्लता और कब्ज दूर करने में उपयोग में लिया जाता है।
(c) लवणों के उपयोग
- दैनिक जीवन में लवणों के भी महत्वपूर्ण उपयोग हैं-कैल्शियम कार्बोनेट (CaCO3) को संगमरमर के रूप में फर्श बनाने में, धातुकर्म में लोहे के निष्कर्षण में तथा सीमेन्ट बनाने में उपयोग में लिया जाता है।
- सिल्वर नाइट्रेट (AgNO3) को फोटोग्राफी में, अमोनियम नाइट्रेट उर्वरक व विस्फोटक बनाने में तथा फिटकरी (K2SO4. Al2 (SO4)3. 24H2O) को जल के शोधन में प्रयुक्त किया जाता है।
प्रश्न 4.
साबुन एवं अपमार्जक क्या होते हैं तथा इन्हें किस प्रकार बनाया जाता है?
उत्तर-
अपमार्जक लैटिन भाषा का शब्द है, जिसका अर्थ है स्वच्छ करने वाला। इसमें साबुन तथा अपमार्जकों को लिया जाता है।
साबुन (Soap)-साबुन सबसे पुराना अपमार्जक है। ये दीर्घ श्रृंखलायुक्त (12 से 18 कार्बन परमाणु) वसा अम्लों जैसे स्टियरिक अम्ल, पामिटिक अम्ल तथा
ओलिक अम्लों के सोडियम अथवा पोटैशियम लवण होते हैं। इन्हें वसा अम्लों को सोडियम हाइड्रॉक्साइड या पोटैशियम हाइड्रॉक्साइड के जलीय विलयन के साथ गर्म करके बनाया जाता है। इस क्रिया को साबुनीकरण कहते हैं।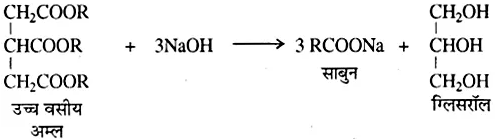
प्राप्त विलयन में NaCl मिलाने पर साबुन अवक्षेपित हो जाता है। केवल उच्च वसीय अम्लों के सोडियम और पोटैशियम लवणों से बने साबुन ही जल में विलेय होते हैं। पोटैशियम साबुन सोडियम साबुन से अधिक मृदु होते हैं, अतः इन्हें शेविंग साबुन तथा शैम्पू आदि बनाने में काम लेते हैं। पारदर्शी साबुन बनाने के लिए ग्लिसरीन का प्रयोग किया जाता है।
अपमार्जक (Detergent)-अपमार्जक साबुन के समान ही होते हैं परन्तु ये कठोर तथा मृदु दोनों ही प्रकार के जल में कार्य करते हैं। अतः अपमार्जकों को सफाई के लिए व्यापक रूप से प्रयुक्त किया जाता है।
अपमार्जक दीर्घ श्रृंखलायुक्त सोडियम एल्किल सल्फेट (R-O-overset { ominus }{ { SO }_{ 3 } } overset { oplus }{ Na } ) तथा सोडियम एल्किल बेंजीन सल्फोनेट (R-{ C }_{ 6 }{ H }_{ 4 }-overset { ominus }{ { SO }_{ 3 } } overset { oplus }{ Na } ) होते हैं।
संश्लेषित अपमार्जकों के द्वारा जल प्रदूषण की समस्या उत्पन्न होती है क्योंकि जीवाणुओं द्वारा इनको आसानी से विघटन नहीं हो पाता है।
यदि हाइड्रोकार्बन श्रृंखला (R समूह) कम शाखित हो तो इनका जीवाणुओं द्वारा विघटन या निम्नीकरण आसानी से हो जाता है। अतः लंबी तथा कम शाखित हाइड्रोकार्बन श्रृंखला युक्त बेंजीन सल्फोनेट अपमार्जक का प्रयोग किया जाता है। आजकल अपमार्जकों की क्षमता एवं गुणवत्ता बढ़ाने के लिए इनमें अकार्बनिक फॉस्फेट, सोडियम परऑक्सीबोरेट तथा कुछ प्रतिदीप्त यौगिक भी मिलाये जाते हैं। साबुन एवं अपमार्जक के द्वारा सफाई की क्रिया मिसेल बनाकर की जाती है।
प्रश्न 5.
अम्लों एवं क्षारों के सामान्य गुणों का वर्णन कीजिए।
उत्तर-
अम्लों एवं क्षारों में निम्नलिखित गुण पाए जाते हैं
(i) अम्ल नीले लिटमस को लाल करते हैं तथा क्षार लाल लिटमस को नीला कर देते हैं।
(ii) अम्ल धातुओं के साथ क्रिया करके हाइड्रोजन गैस देते हैं।
Zn धातु (जिंक) + H2SO4 सल्फ्यूरिक अम्ल → ZnSO4 + H2 ↑
इसी कारण खट्टे अम्लीय पदार्थों को धातु के बर्तनों में नहीं रखा जाता है।
Zn धातु की NaOH (क्षार) के साथ अभिक्रिया से भी लवण तथा हाइड्रोजन गैस बनती है।
Zn + 2NaOH — Na2ZnO2 सोडियम जिंकेट + H2 ↑
परन्तु सभी धातुओं की क्षारों के साथ अभिक्रिया में H2 गैस नहीं बनती है।
(iii) अम्लों के साथ धातु ऑक्साइड की अभिक्रिया से लवण और जल बनते हैं।
धातु ऑक्साइड + अम्ल → लवण + जल ।
CuO + 2HCl → CuCl2 + H2O
अतः ये क्षारीय प्रवृत्ति के होते हैं। क्षारों की अधात्विक ऑक्साइड के साथ अभिक्रिया से लवण और जल बनते हैं अतः ये अम्लीय प्रवृत्ति के होते हैं।
अधातु ऑक्साइड + क्षार → लवण + जल
CO2 + Ca(OH)2 → CaCO3 + H2O
(iv) सभी अम्लों एवं क्षारों के जलीय विलयन विद्युत के सुचालक होते हैं। अतः इनका उपयोग विद्युत अपघट्य के रूप में भी किया जाता है।
(v) सभी अम्ल क्षारों के साथ अभिक्रिया करके अपने गुण को खोकर उदासीन हो जाते हैं। यह अभिक्रिया उदासीनीकरण कहलाती है।
अम्ल + क्षार → लवण + जल
HCl + NaOH → NaCl + H2O
All Chapter RBSE Solutions For Class 10 Science Hindi Medium
All Subject RBSE Solutions For Class 10 Hindi Medium
Remark:
हम उम्मीद रखते है कि यह RBSE Class 10 Science Solutions in Hindi आपकी स्टडी में उपयोगी साबित हुए होंगे | अगर आप लोगो को इससे रिलेटेड कोई भी किसी भी प्रकार का डॉउट हो तो कमेंट बॉक्स में कमेंट करके पूंछ सकते है |
यदि इन solutions से आपको हेल्प मिली हो तो आप इन्हे अपने Classmates & Friends के साथ शेयर कर सकते है और HindiLearning.in को सोशल मीडिया में शेयर कर सकते है, जिससे हमारा मोटिवेशन बढ़ेगा और हम आप लोगो के लिए ऐसे ही और मैटेरियल अपलोड कर पाएंगे |
आपके भविष्य के लिए शुभकामनाएं!!