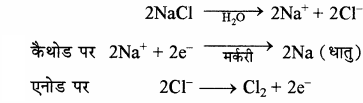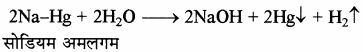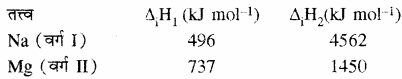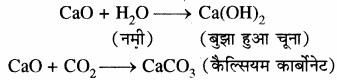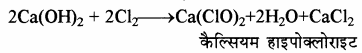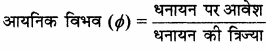हेलो स्टूडेंट्स, यहां हमने राजस्थान बोर्ड कक्षा 11वीं की रसायन विज्ञान सॉल्यूशंस को दिया हैं। यह solutions स्टूडेंट के परीक्षा में बहुत सहायक होंगे | Student RBSE solutions for Class 11 Chemistry Chapter 10 s-ब्लॉक तत्त्व pdf Download करे| RBSE solutions for Class 11 Chemistry Chapter 10 s-ब्लॉक तत्त्व notes will help you.
Table of Contents
Rajasthan Board RBSE Class 11 Chemistry Chapter 10 s-ब्लॉक तत्त्व
RBSE Class 11 Chemistry Chapter 10 पाठ्यपुस्तक के अभ्यास प्रश्न
RBSE Class 11 Chemistry Chapter 10 वस्तुनिष्ठ प्रश्न
प्रश्न 1.
निम्न में से कौनसा क्षारीय मृदा धातु कार्बोनेट ताप के प्रति सबसे अधिक स्थायी है –
(अ) MgCO3
(ब) CaCO3
(स) SrCO3
(द) BaCO3
प्रश्न 2.
निम्न में से कौनसा यौगिक साल्वे अमोनिया प्रक्रम में सह उत्पाद के रूप में प्राप्त होता है –
(अ) कार्बन डाइ ऑक्साइड
(ब) अमोनिया
(स) कैल्सियम क्लोराइड
(द) कैल्सियम कार्बोनेट
प्रश्न 3.
क्षार धातु हेलाइडों में सबसे कम जालक ऊर्जा होती है –
(अ) LiF
(ब) NaCl
(स) KBr
(द) CsI
प्रश्न 4.
निम्न में से किसके द्वारा ज्वाला परीक्षण नहीं दिया जाता है –
(अ) Be
(ब) K
(स) Sr
(द) Na
प्रश्न 5.
निम्नलिखित में से किस धातु का गलनांक न्यूनतम है –
(अ) Na
(ब) K
(स) Rb
(द) Cs
उत्तरमाला:
1. (द)
2. (स)
3. (द)
4. (अ)
5. (द)
RBSE Class 11 Chemistry Chapter 10 अतिलघूत्तरात्मक प्रश्न
प्रश्न 6.
वर्ग I के तत्त्व क्षार धातु क्यों कहलाते हैं?
उत्तर:
ये मुलायम, विद्युत के सुचालक एवं धात्विक प्रकृति के होते हैं एवं ये जल के साथ अभिक्रिया करके क्षारीय प्रकृति के हाइड्रॉक्साइड बनाते हैं। अतः इन्हें क्षार धातु कहते हैं।
प्रश्न 7.
एक आवर्त में क्षार धातुओं के गलनांक क्षारीय मृदा धातुओं से कम क्यों होते हैं?
उत्तर:
क्षार धातुओं के संयोजकता कोश में एक इलेक्ट्रॉन उपस्थित होने के कारण इनके बीच दुर्बल धात्विक बन्ध पाये जाते हैं परन्तु बायें से तत्त्वदायें अर्थात् क्षारीय मृदा धातुओं में परमाणु क्रमांक बढ़ने के कारण आकार छोटा एवं अधिक निबिड़ संकुलित संरचना के कारण इनके गलनांक क्षारीय धातुओं से अधिक होते हैं।
प्रश्न 8.
क्षार धातुएँ प्रकृति में प्रबल विद्युत धनी हैं, क्यों?
उत्तर:
क्षार धातुओं के बाह्यतम कोश में केवल एक इलेक्ट्रॉन होता है जो कि थोड़ी सी ऊर्जा देने पर वे आसानी से निकल जाते हैं अतः ये प्रकृति में प्रबल विद्युत धनी हैं।
प्रश्न 9.
कौनसे धातु आयन हमारे शरीर में रक्त का थक्का जमने के लिए उत्तरदायी है?
उत्तर:
Ca++ आयन शरीर में रक्त का थक्का जमने के लिए काम आता है।
प्रश्न 10.
क्षार धातुओं के इलेक्ट्रॉनिक विन्यास दीजिये।
उत्तर: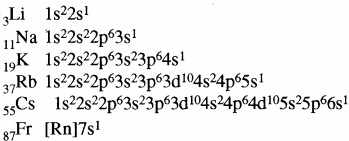
प्रश्न 11.
Na2O2 में सोडियम की ऑक्सीकरण अवस्था ज्ञात कीजिए।
उत्तर:
Na2O2
2x + 2(-1) = 0
2x – 2 = 0
2x = 2
x = 1 अर्थात् +1 होती है।
प्रश्न 12.
पोटेशियम की तुलना में सोडियम कम क्रियाशील है क्यों?
उत्तर:
11Na 1s22s22p63s1
19K 1s22s22p63s23p64s1
सोडियम की आयनिक एन्थेल्पी पोटेशियम से कम होती है एवं पोटेशियम सोडियम की अपेक्षा अधिक विद्युत धनात्मक है। सोडियम एवं पोटेशियम दोनों के बाहरी कोश में 1 इलेक्ट्रॉन है परन्तु पोटेशियम का आकार सोडियम से बड़ा होने के कारण पोटेशियम से आसानी से इलेक्ट्रॉन निकाला जा सकता है, अतः पोटेशियम सोडियम की तुलना में ज्यादा क्रियाशील होता है।
प्रश्न 13.
क्षार धातुएँ तथा क्षारीय मृदा धातुएँ रासायनिक अपचयन विधि से क्यों नहीं प्राप्त किए जा सकते हैं?
उत्तर:
क्षार धातुएँ एवं क्षारीय मृदा धातुएँ बहुत अधिक अपचायक एजेन्ट हैं, अतः इनके ऑक्साइड या हेलाइड को किसी भी अन्य तत्त्व या यौगिक से अपचयित नहीं किया जा सकता है।
प्रश्न 14.
पोटेशियम कार्बोनेट साल्वे विधि द्वारा नहीं बनाया जा सकता है? क्यों?
उत्तर:
साल्वे विधि द्वारा पोटेशियम कार्बोनेट का निर्माण नहीं किया जा सकता है क्योंकि इससे बनने वाला पोटेशियम हाइड्रोजन कार्बोनेट KCl विलेयन में विलेय होता है।
प्रश्न 15.
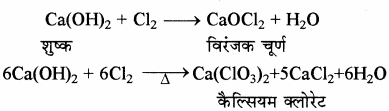
बिना बुझे चूने को जब सिलिका के साथ गरम किया जाता है तब क्या अभिक्रिया होती है?
उत्तर:![]()
प्रश्न 16.
क्षार धातुओं के द्वितीय आयनन विभव के मान प्रथम से अधिक क्यों होते हैं?
उत्तर:
प्रथम इलेक्ट्रोन निकालने के बाद इलेक्ट्रोन की संख्या प्रोटोन से कम हो जाती है अतः उस परमाणु का आकार छोटा हो जाता है जिससे अब उस परमाणु से इसका इलेक्ट्रॉन निकालने के लिए अधिक ऊर्जा की आवश्यकता होती है इसी कारण द्वितीय आयनन विभव प्रथम से अधिक होता है।
प्रश्न 17.
लीथियम यौगिक सहसंयोजक प्रकृति के क्यों होते हैं?
उत्तर:
लीथियम का आकार अन्य क्षार धातुओं की अपेक्षा छोटा होता है। इस कारण यह हेलाइडों का ध्रुवण कर देते हैं जिससे इनमें सह संयोजक गुण प्रदर्शित करते हैं।
प्रश्न 18.
लीथियम एल्युमिनियम हाइड्राइड कैसे निर्मित करते हैं?
उत्तर:
लीथियम हाइड्राइड की एल्यूमिनियम क्लोराइड के इथरी विलयन से अभिक्रिया कराते हैं तो लीथियम एल्यूमिनियम हाइड्राइड का निर्माण होता है।
4LiH + AlCl3 → LiAlH4 + 3LiCl
प्रश्न 19.
हाइड्रोलिथ क्या है? यह जल से कैसे क्रिया करता है?
उत्तर:
कैल्सियम हाइड्राइड (CaH2) को हाइड्रोलिथ कहते हैं।
CaH2 + HO4 → Ca(OH)2 + H2O
यह पानी से क्रिया करके तेजी से हाइड्रोजन गैस देता है।
प्रश्न 20.
NaOH और Mg(OH)2 में से कौनसा प्रबल क्षार है?
उत्तर:
NaOH, Mg(OH)2 की तुलना में प्रबल क्षार होता है। क्योंकि Mg की तुलना में Na की आयनन एन्थैल्पी कम होती है अतः इसकी इलेक्ट्रोन देने की प्रवृत्ति अधिक होती है इसलिए NaOH के आयनन से OH– आसानी से प्राप्त होते हैं।
RBSE Class 11 Chemistry Chapter 10 लघूत्तरात्मक प्रश्न
प्रश्न 21.
निम्नलिखित के सन्दर्भ में क्षार धातुओं एवं क्षारीय मृदा धातुओं की तुलना कीजिए –
- आयनन एन्थैल्पी
- परमाण्वीय व आयनिक त्रिज्जाएँ।
उत्तर:
| क्षार धातु | क्षारीय मृदा धातु | |
| आयनन एन्थैल्पी | इनकी आयनन एन्थैल्पी कम होती है क्योंकि इनका इनका आकार बड़ा होता है एवं नाभिकीय आवेश कम होता है। | आयनन एन्थैल्पी अपेक्षाकृत उच्च होती है क्योंकि इनका नाभिकीय आवेश अधिक होता है। |
| परमाण्वीय त्रिज्या | इनका नाभिकीय आवेश अपेक्षाकृत कम होने के कारण परमाण्वीय त्रिज्या अधिक होती है। | नाभिकीय आवेश अपेक्षाकृत अधिक होने के कारण परमाण्वीय त्रिज्या अपेक्षाकृत कम होती है। |
प्रश्न 22.
प्रकाश विद्युत सेल में लीथियम के स्थान पर पोटेशियम एवं सीजियम क्यों प्रयुक्त किये जाते हैं?
उत्तर:
पोटेशियम एवं सीजियम का आकार लीथियम की तुलना में काफी अधिक होता है अतः इनमें इलेक्ट्रॉन ढीले बन्धे होते हैं इसलिए इनका आयनन विभव भी बहुत कम होता है। इसी कारण थोड़ी सी भी प्रकाशीय ऊर्जा से इसके इलेक्ट्रोन बाहर निकल जाते हैं अर्थात् इनमें प्रकाश विद्युत प्रभाव आसानी से होता है, अतः इनका उपयोग प्रकाश विद्युत सेल में किया जाता है जबकि लीथियम का आकार काफी छोटा होने के कारण इलेक्ट्रोन नहीं निकल पाते हैं।
प्रश्न 23.
सोडियम क्लोराइड से प्रारम्भ करके निम्नलिखित को आप कैसे बनायेंगे –
- सोडियम हाइड्रोक्साइड
- सोडियम कार्बोनेट।
उत्तर:
- सोडियम हाइड्रॉक्साइड (NaOH):
औद्योगिक स्तर पर NaOH का निर्माण कास्टनर कैलनर सेल में NaCl के जलीय विलयन का विद्युत अपघटन करके किया जाता है। इस सेल में Hg का कैथोड तथा ग्रेफाइट का एनोड लिया जाता है। जब विलयन में विद्युत धारा प्रवाहित करते हैं तो Na धातु मर्करी कैथोड पर विसर्जित होकर मर्करी के साथ मिलकर सोडियम अमलगम बनाता है तथा एनोड पर क्लोरीन मुक्त होती है। रासायनिक अभिक्रियाएँ निम्न प्रकार होती हैं –
इस प्रकार से बना सोडियम अमलगम जल से क्रिया करके NaOH तथा H2 गैस देता है।
- सोडियम कार्बोनेट (Na2CO3):
सोडियम कार्बोनेट को साल्वे प्रक्रम द्वारा बनाया जाता है। इसके लिए पहले NaCl से (NH4)2 CO3 बनाते हैं फिर NH4HCO3 तथा अंत में Na2CO3 बनाते हैं। अभिक्रियाएँ निम्न प्रकार होती हैं –
2NH3 + CO2 + H2O → (NH4)2CO3
(NH4)2CO3 + CO2 + H2O → 2NH4HCO3
NH4HCO3 + NaCl → NH4Cl + NaHCO3
2NaHCO3 (overrightarrow { Delta } ) Na2CO3 + CO2↑+ H2O
प्रश्न 24.
निम्नलिखित की संरचना बताइए –
- BaCl2 (वाष्प)
- BeCl2 (ठोस )
उत्तर:
ठोस अवस्था में यह बहुलक श्रृंखला संरचना प्रदर्शित करता है जिसमें Be परमाणु चार क्लोरीन परमाणुओं से घिरा रहता है – दो क्लोरीन परमाणु सहसंयोजक बन्धों से जबकि दो उपसहसंयोजक बन्धों द्वारा आबंधित होता है।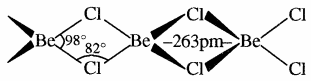
लेकिन वाष्प अवस्था में BeCl2 क्लोरो सेतु द्विलक बनाता है जो 1200K के उच्च ताप पर रेखीय एकलक में वियोजित हो जाता है।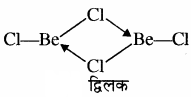
प्रश्न 25.
क्षार धातुएँ द्रव अमोनिया में नीला रंग क्यों देती हैं?
उत्तर:
क्षार धातुएँ द्रव NH3 में विलेय होती हैं एवं इस विलयन का रंग गहरा नीला होता है। यह विलयन मुक्त इलेक्ट्रॉन के कारण विद्युत का सुचालक होता है।
M + (x + y) NH3+ [M(NH3)x]+ + [e(NH3)y]–
इस विलयन का नीला रंग अमोनीकृत इलेक्ट्रॉन के कारण होता है। ये इलेक्ट्रॉन प्रकाश के दृश्य क्षेत्र की ऊर्जा का अवशोषण करके विलयन को नीला रंग प्रदान करते हैं।
प्रश्न 26.
H2 अणु है लेकिन He2 अणु अज्ञात है। समझाइए क्यों?
उत्तर:
हाइड्रोजन परमाणु की बाहरी कक्षा में एक इलेक्ट्रॉन होता है अतः दो हाइड्रोजन परमाणु आपस में अतिव्यापन करके H2 अणु का निर्माण करते हैं जिसमें कोश पूर्ण हो जाता है (2n2) परन्तु He के परमाणु की बाहरी कक्षा में 2 इलेक्ट्रॉन होते हैं एवं यह स्थायी कोश है अतः दोनों He परमाणुओं में अतिव्यापन नहीं हो पाता है इसलिए He2 अणु का निर्माण नहीं होता है।
प्रश्न 27.
ऑक्साइड, परऑक्साइड और सुपर ऑक्साइड क्या हैं? उदाहरण सहित समझाइए।
उत्तर:
ऑक्साइड में ऑक्सीकरण स्टेट – 2 होता है जैसे Na2O, Fe2O3, BaO परऑक्साइडों में [- O – O -]2- आयन होता है इसी कारण ये प्रतिचुम्बकीय तथा प्रबल सुपर ऑक्सीकारक होते हैं। ऑक्साइडों में [O2–] आयन होता है इसलिए ये अयुग्मित इलेक्ट्रोन की उपस्थिति के कारण अनुचुम्बकीय तथा रंगीन (LiO2 NaO2– पीला, KO2 नारंगी, RbO2– भूरा तथा CSO2 नारंगी) होते हैं। अर्थात् ऑक्साइड में ऑक्सीकरण स्टेट – 2 होती है, परॉक्साइड में -1 होती है जबकि सुपर, ऑक्साइड में (frac { { -{ 1 } } }{ 2 } ) होती है।
प्रश्न 28.
निर्जल कैल्सियम क्लोराइड निर्जली कारक के रूप में प्रयुक्त होता है, क्यों?
उत्तर:
कैल्सियम क्लोराइड एक विशेष प्रकार का धात्विक हेलाइड है जो कि आर्द्रताग्राही होता है। इसकी पानी सोखने की क्षमता लगभग 90% होती है अतः पानी अणुओं को वायुमण्डल से भी आकर्षित कर लेता है। इस कारण इस यौगिक को जिस विलयन में डाला जाता है उसमें से पानी को सोख लेता है। इस कारण इसको निर्जलीकारक के रूप में प्रयुक्त किया जाता है।
प्रश्न 29.
LiF जल में लगभग अविलय होता है जबकि LiCl न सिर्फ जल में, बल्कि एसीटोन में भी विलेय होता है। कारण बताइए।
उत्तर:
LiF आयनिक यौगिक है लेकिन Li+ तथा F– के छोटे आकार के कारण इसकी जालक एन्थैल्पी अधिक होती है अत: इसकी जलयोजन एन्थैल्पी, जालक एन्थैल्पी से अधिक नहीं होती। इसलिए LiF जल में अविलेय है जबकि LiCl में Cl– के बड़े आकार के कारण Li+ के द्वारा इसका ध्रुवण हो जाता है। अत: LiCl में आंशिक आयनिक तथा आंशिक सहसंयोजी गुण होता है इस कारण यह जल तथा कम ध्रुवीय विलायक जैसे ऐसीटोन में भी विलेय होता है।
प्रश्न 30.
Na2CO3 का विलयन क्षारीय होता है, क्यों?
उत्तर:
Na2CO3 को जल में डालने पर, जल अपघटन के कारण प्रबल क्षार (NaOH) तथा दुर्बल अम्ल (H2CO3) बनता है। चूँकि NaOH से प्राप्त (overset { – }{ O } )H आयन, H2CO3 से प्राप्त H+ आयनों से अधिक होते हैं अतः Na2CO3 का जलीय विलयन क्षारीय होता है। यहाँ वास्तव में CO32- जल से क्रिया करके OH– की सान्द्रता बढ़ाते हैं।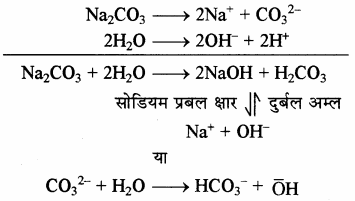
प्रश्न 31.
निम्नलिखित के उपयोग लिखिए –
- चूना पत्थर
- सोडियम कार्बोनेट।
उत्तर:
1. चूना पत्थर के उपयोग निम्नलिखित हैं –
- संगमरमर के रूप में भवन निर्माण
- बुझे चूने का निर्माण
- आयन के निष्कर्षण में गालक के रूप में
- कागज के निर्माण में
- एन्टासिड, टूथपेस्ट, च्यूइंगम तथा सौन्दर्य प्रसाधनों के निर्माण में।
2. सोडियम कार्बोनेट –
- जल को मृदु (soft) करने में
- कपड़े धोने के साबुन बनाने में
- काँच, बोरेक्स, साबुन एवं कास्टिक सोडा बनाने में
- प्रयोगशाला में गुणात्मक एवं मात्रात्मक विश्लेषण में अभिकर्मक के रूप में।
प्रश्न 32.
निम्नलिखित तथ्यों को समझाइये –
- BeO जल में अविलेय है जबकि BeSO4 विलेय है।
- BaO जल में विलेय है जबकि BaSO4 अविलेय है।
उत्तर:
- BeO में O2- के छोटे आकार के कारण जालक:
एन्थैल्पी का मान जलयोजन एन्थैल्पी से अधिक होता है। अतः यह जल में अविलेय है जबकि BeSO4 में SO42- के बड़े आकार के कारण इसकी जालक एन्थैल्पी, जलयोजन एन्थैल्पी से कम होती है अतः यह जल में विलेय है। - BaO में Ba2+ के बड़े आकार के कारण इसकी जालक एन्थैल्पी, जलयोजन एन्थैल्पी की तुलना में कम होती है। अतः यह जल में विलेय है जबकि BaSO4 में Ba2+ तथा SO42- दोनों के बड़े आकार के कारण इसकी जलयोजन एन्थैल्पी का मान जालक एन्थैल्पी से बहुत कम होता है अतः यह अविलेय है।
प्रश्न 33.
निम्नलिखित के मध्य क्रियाओं के सन्तुलित समीकरण लिखिये –
- Be2C एवं जल
- KO2 एवं जल
- लीथियम एवं नाइट्रोजन।
उत्तर:
- बेरीलियम कार्बाइड की जल के साथ अभिक्रिया कराने पर मेथेन गैस का निर्माण होता है –
Be2C + 4H2O → 2Be(OH)2 + CH4 - KO2 एवं जल की क्रिया से KOH तथा H2O2 का निर्माण होता है।
2KO2 (s) + 2H2O(2) → 2KOH (aq) + O2 (g) + H2O2 (aq) - Li (s) + N2 (g) → 2Li3N (s)
प्रश्न 34.
विकर्ण सम्बन्ध क्या है? बेरीलियम किस प्रकार एल्यूमिनियम से समानता दर्शाता है?
उत्तर:
बेरीलियम के गुण अन्य क्षार मृदा धातुओं के गुणों से भिन्न होते हैं परन्तु यह एल्यूमिनियम के गुणों से अधिक समानता प्रदर्शित करता है जो कि वर्ग III का दूसरा तत्त्व है एवं बेरोलियम की विकर्ण स्थिति पर होता है। बेरीलियम एवं एल्यूमिनियम के इस सम्बन्ध को विकर्ण सम्बन्ध कहते हैं।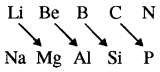
- Be एवं Al के यौगिकों में सहसंयोजी गुण होता है अतः वे कार्बनिक विलायकों में विलेय होते हैं।
- Be(OH)2 तथा Al(OH)3 उभयधर्मी होते हैं।
- Be एवं Al दोनों ही हाइड्रोजन से सीधे क्रिया करके हाइड्राइड नहीं बनाते हैं।
प्रश्न 35.
लीथियम अपने वर्ग के अन्य तत्त्वों से समानता नहीं रखता, इसका क्या कारण है?
उत्तर:
लीथियम निम्न कारणों से अपने वर्ग के अन्य तत्त्वों से समानता नहीं रखता है –
- लीथियम परमाणु तथा उसके आयन (Li+) का अत्यधिक आकार छोटा होता है।
- लीथियम आयन (Li+) की अधिक ध्रुवण क्षमता के परिणामस्वरूप लीथियम यौगिकों में सहसंयोजक गुण अधिक पाये जाते
- लीथियम की उच्च आयनन ऊर्जा तथा सबसे कम विद्युत धनी प्रकृति।
- d कक्षकों की अनुपस्थिति के कारण अधिकतम चार संयोजकता प्रदर्शित कर सकता है।
RBSE Class 11 Chemistry Chapter 10 निबन्धात्मक प्रश्न
प्रश्न 36.
वर्ग I तथा वर्ग II धातुओं के गुण बताइए। बेरोलियम हाइड्राइड की संरचना को समझाइये।
उत्तर: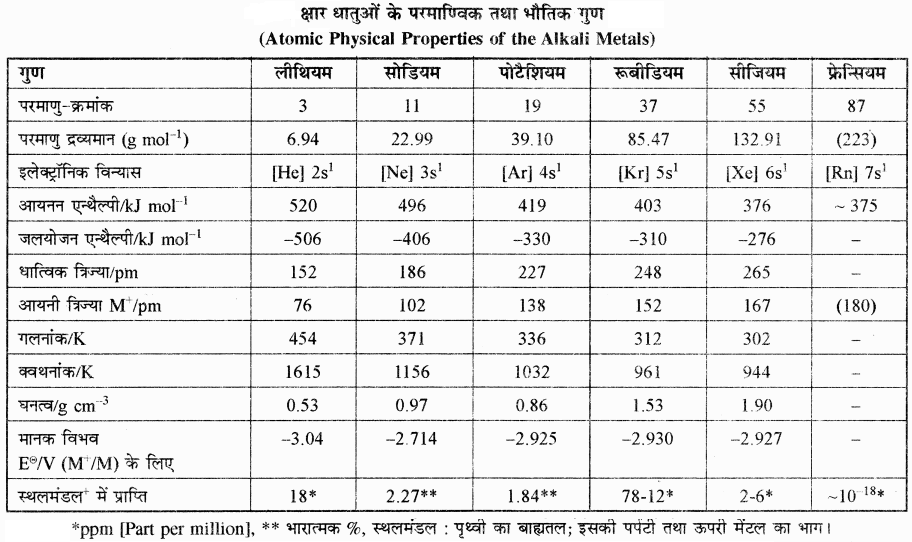
- परमाणु एवं आयनिक त्रिज्या:
क्षार धातुओं की परमाणु त्रिज्या (आकार) आवर्त सारणी के किसी आवर्त में सर्वाधिक होती है। इनके एक संयोजी आयन (M+) का आकार अपने जनक परमाणु के आकार की तुलना में छोटा होता है। क्षार धातुओं की परमाणु तथा आयनिक त्रिज्या वर्ग में ऊपर से नीचे जाने पर बढ़ती है, अर्थात् इनका आकार Li से Cs तक बढ़ता है, क्योंकि कोशों की संख्या बढ़ती जाती है। - घनत्व:
क्षार धातुओं के बड़े आकार के कारण इनका घनत्व कम होता है अतः ये हल्के होते हैं। वर्ग में नीचे जाने पर घनत्व का मान कम होता जाता है, क्योंकि आयतन की तुलना में द्रव्यमान अधिक बढ़ता है।
d = (frac { M }{ V } )
लेकिन पोटैशियम का घनत्व सोडियम के घनत्व से कम होता है क्योंकि K के तीसरे कोश में 8 इलेक्ट्रॉन हैं जबकि इसकी क्षमता 18 इलेक्ट्रॉन (2n2) की है अतः इलेक्ट्रॉनों का फैलाव होकर, द्रव्यमान की तुलना में आयतन अधिक बढ़ जाता है। अतः वर्ग -1 के तत्त्वों के घनत्व का क्रम निम्न प्रकार होता है –
Li < K < Na < Rb < Cs - गलनांक एवं क्वथनांक:
क्षार धातुओं के गलनांक तथा क्वथनांक कम होते हैं, क्योंकि इनके संयोजी कोश में मात्र एक इलेक्ट्रॉन उपस्थित होता है अतः परमाणुओं के मध्य धात्विक बंध दुर्बल होता है। वर्ग में ऊपर से नीचे जाने पर परमाणु आकार बढ़ने के कारण धात्विक बन्ध की प्रबलता कम होती जाती है अतः इनके गलनांक तथा क्वथनांक के मान भी कम होते जाते हैं। - आयनन एन्थैल्पी:
क्षार धातुओं की आयनन एन्थैल्पी का मान बहुत कम होता है अतः ये आसानी से एक इलेक्ट्रॉन देकर उत्कृष्ट गैस विन्यास प्राप्त कर लेते हैं। आयनन एन्थैल्पी का मान वर्ग में लीथियम से सीजियम की ओर नीचे जाने पर कम होता जाता है क्योंकि बढ़ते हुए नाभिकीय आवेश की तुलना में बढ़ते हुए परमाणु – आकार का प्रभाव अधिक होता है तथा परिरक्षण प्रभाव भी बढ़ता है। क्षार धातुओं की आयनन एन्थैल्पी का मान अपने आवर्त में न्यूनतम होता है। प्रथम वर्ग के सभी तत्त्व धातु हैं। ये अपने बाह्यतम कोश में उपस्थित s इलेक्ट्रॉन को आसानी से त्याग देते हैं अतः ये अत्यधिक विद्युत धनी तथा क्रियाशील तत्त्व हैं। (हाइड्रोजन को छोड़कर) वर्ग में ऊपर से नीचे जाने पर आयनन एन्थैल्पी का मान कम होता है अतः इनका. धात्विक गुण (विद्युत धनी गुण) तथा क्रियाशीलता बढ़ती है। क्षार धातुओं की द्वितीय आयनन एन्थैल्पी का मान बहुत उच्च होता है क्योंकि –
1. M+ आयन का विन्यास स्थायी (ns2np6) होता है।
2. M+ आयन का आकार नाभिकीय आवेश में वृद्धि के कारण छोटा होता है। - ज्वाला परीक्षण:
क्षार धातुएँ तथा इनके लवण ऑक्सीकारक ज्वाला को विशेष रंग प्रदान करते हैं क्योंकि ज्वाला की ऊष्मा इनके बाह्यतम इलेक्ट्रॉन को उच्च ऊर्जा – स्तर तक उत्तेजित कर देती है। जब यह इलेक्ट्रॉन पुनः अपनी मूल अवस्था में आता है, तो दृश्य क्षेत्र में विकिरण के उत्सर्जन के कारण ज्वाला को रंग प्रदान करते हैं जो कि भिन्न – भिन्न धातुओं के लिए भिन्न – भिन्न होता है। अतः क्षार धातुओं को इनके ज्वाला परीक्षण द्वारा पहचाना जा सकता है तथा इनकी सान्द्रता का निर्धारण ज्वाला प्रकाशमापी द्वारा किया जाता है।
ज्वाला के रंग की तीव्रता ‘फोटो विद्युत सेल’ द्वारा नापी जा सकती है जो कि धातु की सान्द्रता पर निर्भर करती है। क्षार धातुओं को परमाणवीय अवशोषण स्पेक्ट्रोमिति द्वारा भी पहचाना जा सकता है। - प्रकाश विद्युत प्रभाव:
धातु की सतह पर प्रकाश के गिरने पर इलेक्ट्रॉनों का उत्सर्जन प्रकाश विद्युत प्रभाव कहलाता है तथा उत्सर्जित इलेक्ट्रॉनों को फोटो इलेक्ट्रॉन कहते हैं। क्षार धातुओं में K तथा Cs की आयनन एन्थैल्पी का मान बहुत कम होता है अतः ये प्रकाश विद्युत प्रभाव दर्शाते हैं। - अपचायक गुण:
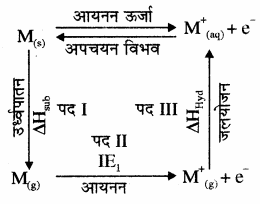
क्षार धातुओं के मानक इलेक्ट्रॉड विभव के मान उच्च ऋणात्मक होते हैं अतः ये प्रबल अपचायक होते हैं। आयनन एन्थैल्पी के आधार पर लीथियम का अपचायक गुण सबसे कम होना चाहिए लेकिन वास्तव में लीथियम सबसे प्रबल अपचायक होता है क्योंकि इसका मानक इलेक्ट्रॉड विभव उच्चतम ऋणात्मक होता है। इसका कारण Li+ को छोटा आकार है। जिसके कारण इसकी जलयोजन एन्थैल्पी का मान बहुत अधिक होता है।
इलेक्ट्रॉड विभव = जल योजन एन्थैल्पी – (आयनन एन्थैल्पी + ऊर्ध्वपातन एन्थैल्पी)
अतः क्षार धातुओं के अपचायक गुण का क्रम निम्न प्रकार होता है –
Na < K < Rb < Cs < Li
Li+ > Na+ > K+ > Rb+ > Cs+
(जलयोजन ऊर्जा का क्रम)
पद III में उत्सर्जित जलयोजन ऊर्जा पद II की उच्च आयनन ऊर्जा को समायोजित कर देती है, इससे इलेक्ट्रॉन का परित्याग आसानी से हो जाता है। इस प्रकार लीथियम का न्यूनतम अपचयन विभव मान उसकी प्रबलतम अपचायक प्रवृत्ति को प्रदर्शित करता है। - ऑक्सीकरण अवस्था:
सभी क्षार धातुएँ एक संयोजी धनायन (M+) बनाती हैं क्योंकि ये एक इलेक्ट्रॉन त्याग कर उत्कृष्ट गैस के समान स्थायी विन्यास प्राप्त कर लेती हैं। - रंगहीन तथा प्रतिचुम्बकीय आयन:
सभी क्षार धातु धनायनों (M) में उत्कृष्ट गैस विन्यास होने के कारण इनमें सभी इलेक्ट्रॉन युग्मित होते हैं अतः ये रंगहीन तथा प्रतिचुम्बकीय होते हैं।
क्षारीय मृदा धातुओं के भौतिक गुण: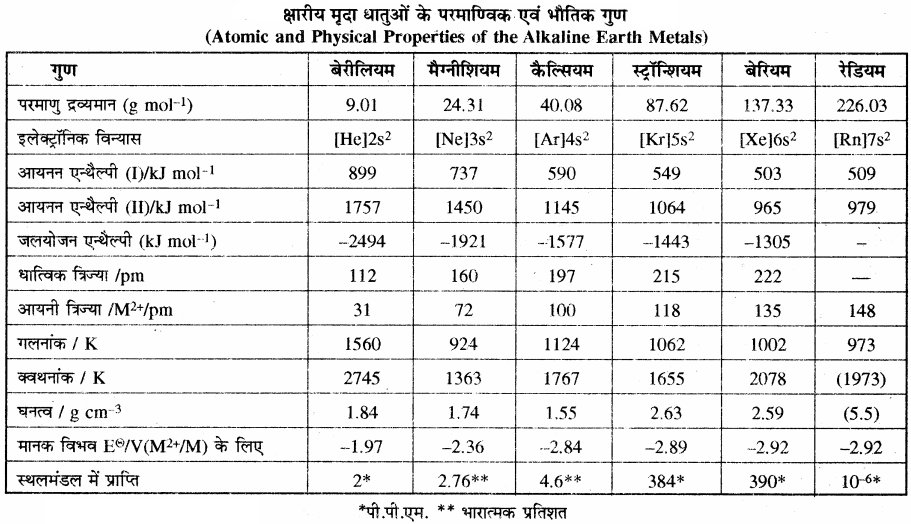
क्षारीय मृदा धातुएँ भी बहुत अधिक क्रियाशील होती हैं अतः ये मुक्त अवस्था में नहीं पायी जाती हैं परन्तु सिलिकेट, कार्बोनेट, सल्फेट एवं फास्फेट के रूप में प्रकृति में पायी जाती हैं।
बेरीलियम भू – पर्पटी पर भारात्मक रूप में पाया जाने वाला 51वां तत्त्व है। यह कुछ मात्रा में बेरिल (Be3Al2Si6O18) तथा फिनासाइट (Be2SiO4) में भी पाया जाता है। इसी प्रकार भूपर्पटी में कैल्सियम एवं मैग्नीशियम का क्रमश: इवां एवं छठा स्थान है। मैग्नीशियम कार्बोनेट सिलिकेट एवं सल्फेट के रूप में पाया जाता है। यह समुद्री जल में भी (0.13%) कुछ भाग में क्लोराइड एवं सल्फेट के रूप में पाया जाता है।
कैल्सियम मुख्य रूप से लाइम स्टोन, संगमरमर एवं चॉक CaCO3 के रूप में पाया जाता है। फ्लुओरो पैराइट [3CCa3(PO4)2CaF2] तथा जिप्सम [CaSO4.2H2O] कैल्सियम के मुख्य अयस्क हैं। Sr एवं Ba कम मात्रा में पाये जाते हैं। रेडियम एक रेडियोधर्मी तत्त्व है जो आग्नेय शैल में केवल 10-10% पाये जाते हैं।
इलेक्ट्रॉनिक विन्यास:
वर्ग 2 के तत्त्वों का बाह्यतम सामान्य इलेक्ट्रॉनिक विन्यास ns2 होता है। यहाँ n = 2 से 7 अर्थात् क्षारीय मृदा धातुओं के बाह्यतम कोश (संयोजी कोश) में दो इलेक्ट्रॉन होते हैं तथा इसके पूर्व के कोश में उत्कृष्ट गैस के समान विन्यास पाया जाता है।
- परमाणु तथा आयनिक त्रिज्या:
क्षार धातुओं की तुलना में क्षारीय मृदा धातुओं की परमाणु तथा आयनिक त्रिज्या कम होती है क्योंकि आवर्त सारणी में किसी आवर्त में बाएँ से दाएँ जाने पर नाभिकीय आवेश में वृद्धि से नाभिकीय आकर्षण बल बढ़ जाता है जिससे त्रिज्या कम हो जाती है। प्रथम वर्ग के समान इनमें भी वर्ग में ऊपर से नीचे जाने पर परमाणु तथा आयनिक त्रिज्या बढ़ती है। लेकिन आयनिक त्रिज्या का मान परमाणु त्रिज्या से काफी कम होता है, क्योंकि धनायन (M2+) बनते समय बाह्यतम कोश ही समाप्त हो जाता है। - घनत्व:
वर्ग 2 के तत्त्वों का घनत्व, वर्ग 1 के तत्त्वों की तुलना में अधिक होता है क्योंकि इनका आकार छोटा होता है। वर्ग में ऊपर से नीचे जाने पर क्षारीय मृदा धातुओं के घनत्व में नियमितता नहीं होती है। Be से Ca तक घनत्व कम होता है, इसके पश्चात् बढ़ता है, इसका कारण इनकी क्रिस्टल संरचना में अन्तर है। अतः क्षारीय मृदा धातुओं में घनत्व का क्रम इस प्रकार है –
Ca < Mg < Be < Sr < Ba - गलनांक तथा क्वथनांक:
क्षारीय मृदा धातुओं के गलनांक तथा क्वथनांक क्षार धातुओं की तुलना में उच्च होते हैं, क्योंकि इनका आकार छोटा होता है। वर्ग में ऊपर से नीचे जाने पर गलनांक तथा क्वथनांक का मान कम होता है। क्योंकि परमाणु आकार बढ़ने के कारण धात्विक बन्ध की प्रबलता कम होती है। लेकिन कैल्सियम का गलनांक तथा क्वथनांक अपेक्षाकृत अधिक होते हैं क्योंकि इसमें d – कक्षक बन्ध बनाने में प्रयुक्त होते हैं। जिनके अधिक दिशात्मक गुण के कारण बन्ध की प्रबलता अधिक होती है तथा d – कक्षक कैल्सियम से ही प्रारम्भ होते हैं। अत: वर्ग 2 के तत्वों के गलनांक तथा क्वथनांक को क्रम निम्न प्रकार होता है –
गलनांक Be > Ca > Sr > Ba > Mg
क्वथनांक Be > Ba > Ca > Sr > Mg - आयनन एन्थैल्पी:
क्षारीय मृदा धातुओं के बड़े परमाणु आकार के कारण इनकी आयनने एन्थैल्पी के मान कम होते हैं। वर्ग में ऊपर से नीचे जाने पर परमाणु आकार बढ़ता है, अतः इनकी आयनन एन्थैल्पी कम होती जाती है। क्षारीय मृदा धातुओं की प्रथम आयनन एन्थैल्पी क्षार धातुओं की प्रथम आयनन एन्थैल्पी की तुलना में अधिक होती है। यह इनके क्षार धातुओं की तुलना में छोटे आकार के कारण होती है, लेकिन इनके द्वितीय आयनन एन्थैल्पी के मान क्षार धातुओं के द्वितीय आयनन एन्थैल्पी के मानों की तुलना में कम होते हैं क्योंकि दो इलेक्ट्रॉन निकलने से इनमें उत्कृष्ट गैसों के समान स्थायी विन्यास प्राप्त हो जाता है।
सोडियम धातु में दूसरा इलेक्ट्रॉन एक संयोजी धनायन से [उत्कृष्ट गैस (Ne)] निकलता है जबकि मैग्नीशियम एक संयोजी धनायन से दूसरा इलेक्ट्रॉन आसानी से त्याग कर उत्कृष्ट गैस Ne – विन्यास प्राप्त करता है। वर्ग में ऊपर से नीचे जाने पर क्षारीय मृदा धातुओं की आयनन ऊर्जा का मान
आकार तथा परिरक्षण प्रभाव बढ़ने के कारण कम होता जाता है। - ज्वाला परीक्षण:
क्षार धातुओं के समान क्षारीय मृदा धातु भी ज्वाला को निम्न प्रकार से रंग प्रदान करती है –
बेरीलियम तथा मैग्नीशियम के अतिरिक्त अन्य क्षारीय मृदा धातु ज्वाला परीक्षण देते हैं क्योंकि ज्वाला में उच्च ताप पर (वाष्प – अवस्था में) क्षारीय मृदा धातुओं के बाह्यतम कोश के इलेक्ट्रॉन उत्तेजित होकर उच्च ऊर्जा – स्तर में चले जाते हैं। ये इलेक्ट्रॉन जब पुनः अपनी मूल अवस्था में आते हैं, तो दृश्य प्रकाश के रूप में ऊर्जा उत्सर्जित करते हैं, जिससे ज्वाला को विशेष रंग प्राप्त होता है। कैल्सियम (Ca) ईंट जैसा लाल (Brick Red), स्ट्रॉन्शियम (Sr) किरमिजी लाल (Crimson Red) तथा बेरियम (Ba) ज्वाला को सेब जैसा हरा (Apple Green) रंग प्रदान करता है। इसी कारण गुणात्मक विश्लेषण में इन मूलकों की पुष्टि ज्वाला परीक्षण के आधार पर की जाती है। बेरिलियम तथा मैग्नीशियम के बाह्यतम कोशों के इलेक्ट्रॉन इतनी दृढ़ता से बँधे होते हैं कि ज्वाला की ऊर्जा द्वारा ये उत्तेजित नहीं हो पाते हैं अतः ये ज्वाला को कोई विशेष रंग प्रदान नहीं करते हैं। - धात्विक तथा धनविद्युती गुण:
निम्न आयनन एन्थैल्पी के कारण क्षारीय मृदा धातु प्रबल धन – विद्युती होते हैं तथा धन – विद्युती गुण ऊपर से नीचे जाने पर (Be से Ba) बढ़ता है। इनका धनविद्युती गुण (धात्विक गुण) क्षार धातुओं की तुलना में कम होता है, क्योंकि छोटे आकार के कारण इनकी आयनन एन्थैल्पी का मान अपेक्षाकृत अधिक होता है। - ऑक्सीकरण अवस्था:
सभी क्षारीय मृदा धातु द्विसंयोजी धनायन (M2+) बनाती हैं, क्योंकि ये दो इलेक्ट्रॉन देकर उत्कृष्ट गैस के समान स्थायी विन्यास प्राप्त कर लेती हैं। - रंगहीन तथा प्रतिचुम्बकीय आयन:
क्षारीय मृदा धातुओं के धनायन (M2+) रंगहीन तथा प्रतिचुम्बकीय होते हैं क्योंकि इनमें स्थायी उत्कृष्ट गैस विन्यास पाया जाता है जिसमें सभी इलेक्ट्रॉन युग्मित होते हैं। - मानक इलेक्ट्रॉड विभव:
क्षारीय मृदा धातुओं के मानक इलेक्ट्रॉड विभव के मान उच्च ऋणात्मक होते हैं (क्षार धातुओं की अपेक्षा कम), अतः ये अपचायक होते हैं। वर्ग में ऊपर से नीचे जाने पर यह मान कम होता जाता है। इसलिए इनकी क्रियाशीलता भी कम होती है। इसी कारण Be सबसे कम तथा Ba सर्वाधिक क्रियाशील क्षारीय मृदा धातु है।
हाइड्रोजन से अभिक्रिया:
बेरिलियम के अतिरिक्त अन्य सभी क्षारीय मृदा धातुओं को हाइड्रोजन के साथ गर्म करने पर संगत हाइड्राइड बनते हैं। BeH2 को BeCl2 तथा LiAlH4 की अभिक्रिया से बनाया जाता है।
M + H2 (overrightarrow { Delta } ) MH2
2BeCl2 + LiAlH4 → 2BeH2 + LiCl + AlCl3
BeH2 सहसंयोजी होता है लेकिन अन्य हाइड्राइड आयनिक होते हैं। ये हाइड्राइड्स जल से क्रिया करके हाइड्रोजन गैस मुक्त करते हैं।
MH2 + 2H2O → M(OH)2 + 2H2↑
इन हाइड्राइडों का तापीय स्थायित्व वर्ग में कम होता है।
BeH2 > MgH2 > CaH2 > SrH2 > BaH2
BeH2 तथा MgH2 इलेक्ट्रॉन न्यून एवं सहसंयोजक यौगिक होते हैं। इलेक्ट्रॉन न्यूनता के कारण ये बहुलकी संरचना प्रदर्शित करते हैं।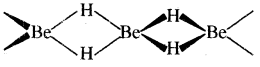
CaH2, SrH2 तथा CaH2 आयनिक प्रकृति के होते हैं। CaH2 को ‘हाइड्रोलिथ’ कहते हैं। क्षारीय मृदा धातु हाइड्राइड जल के साथ क्रिया करके H2 गैस निकालते हैं। इस प्रकार ये अपचायक की तरह व्यवहार प्रदर्शित करते हैं।
MH2 + 2H2O → M (OH)2 + 2H2
CaH2 + 2H2O → Ca(OH)2 + 2H2
प्रश्न 37.
जैव द्रवों में Na, K, Mg तथा Ca के महत्त्व को समझाइये।
उत्तर:
सोडियम तथा पोटेशियम का जैविक महत्त्व:
Na+ तथा K+ दोनों ही आयन जैविक तरल (Fluid) के लिए बहुत महत्त्वपूर्ण अवयव हैं। 70kg वजन वाले एक सामान्य व्यक्ति में लगभग 90gm सोडियम तथा 170gm पोटैशियम पाया जाता है। कोशिका में कई ऋणावेशित वृहद् अणु पाये जाते हैं उन पर उपस्थित ऋण आवेश को सन्तुलित करने के लिए अधिक मात्रा में I वर्ग एवं II वर्ग के धातु धनायनों की आवश्यकता होती है।
- सोडियम आयन मुख्यतः अंतराकाशीय द्रव में उपस्थित रक्त प्लाज्मा, जो कोशिकाओं को घेरे रहता है, में पाया जाता है।
- सोडियम आयन तंत्रिका (शिरा) आवेग संकेतों के संचरण में भाग लेते हैं, जो कोशिका झिल्ली में जलप्रवाह को नियमित करते हैं तथा कोशिकाओं में शर्करा एवं एमीनो अम्लों के प्रवाह को भी नियंत्रित करते हैं।
- सोडियम तथा पोटैशियम रासायनिक दृष्टि से समान होते हैं लेकिन इनकी कोशिका झिल्ली को पार करने की तथा एन्जाइम को सक्रिय करने की क्षमता भिन्न होती है। इसीलिए कोशिका द्रव में पोटैशियम आयन अधिक होते हैं; जहाँ ये एन्जाइम को सक्रिय करते हैं तथा ग्लूकोज के ऑक्सीकरण से ATP बनने में भी भाग लेते हैं।
- कोशिका झिल्ली के अन्य भागों में पाए जाने वाले सोडियम तथा पोटैशियम आयनों की सान्द्रता भिन्न – भिन्न होती है। जैसे रक्त प्लाज्मा में लाल रक्त कोशिकाओं में सोडियम की मात्रा 143 m molL-1 होती है, जबकि पोटैशियम की मात्रा केवल 5 m molL-1 होती है। Na में यह सान्द्रता 10 m molL-1 तक तथा K+में यह 105 m molL-1 तक परिवर्तित हो सकती है। इस असाधारण आयनिक उतार – चढ़ाव को ‘सोडियम पोटैशियम पम्प’ कहते हैं।
- यह उतार – चढ़ाव सेल झिल्ली पर होता है, जिसमें मनुष्य की विश्रामावस्था में प्रयुक्त ATP का एक – तिहाई से अधिक का उपयोग हो जाता है तथा यह विश्राम की अवस्था वाले मनुष्य में 15 Kg प्रति 24 घण्टे तक हो सकता है।
- 70 किलोग्राम वजन वाले एक सामान्य व्यक्ति में लगभग 90 ग्राम सोडियम तथा 170 ग्राम पोटैशियम होता है। जबकि आयरन केवल 5 ग्राम तथा कॉपर 0.06 ग्राम होता है।
मैग्नीशियम तथा कैल्सियम की जैव महत्ता:
- समस्त एन्जाइम, जो फॉस्फेट के संचरण में ATP का उपयोग करते हैं, वे सह – घटक के रूप में मैग्नीशियम का उपयोग करते हैं।
- पौधों में प्रकाश – अवशोषण के लिए आवश्यक मुख्य रंजक क्लोरोफिल में भी मैग्नीशियम उपस्थित होता है।
- शरीर में कैल्सियम का 99% भाग दाँतों तथा हड्डियों में होता है।
- कैल्सियम, तंत्रिकीय पेशीय कार्यप्रणाली, अंतर तंत्रिकीय प्रेषण, कोशिक झिल्ली अखण्डता तथा रक्त के स्कंदन में भी महत्त्वपूर्ण भूमिका निभाता है।
- प्लाज्मा में कैल्सियम की सान्द्रता लगभग 100 mgL होती है जिसे बनाए रखने के लिए दो हार्मोन कैल्सिटोनिन तथा पैराथायराइड उत्तरदायी होते हैं।
- मनुष्य में हड्डियों में लगभग 400 mg कैल्सियम प्रतिदिन विलेय तथा निक्षेपित होता है जो कि प्लाज्मा में से होकर ही गुजरता है।
- एक सामान्य वयस्क व्यक्ति के शरीर में करीब 25 ग्राम मैग्नीशियम एवं 1200 ग्राम कैल्सियम होता है। मानव शरीर में इनकी दैनिक आवश्यकता 200 – 300 mg तक होती है।
प्रश्न 38.
औद्योगिक स्तर पर सोडियम कार्बोनेट बनाने की विधि का वर्णन कीजिए।
उत्तर:
कैल्सियम के मुख्य यौगिक:
कैल्सियम के महत्त्वपूर्ण यौगिक कैल्सियम ऑक्साइड (CaO) कैल्सियम हाइड्रॉक्साइड [Ca(OH)2], कैल्सियम सल्फेट (CaSO4), कैल्सियम कार्बोनेट (CaCO3) तथा सीमेन्ट हैं। ये सभी यौगिक औद्योगिक रूप से महत्त्वपूर्ण हैं। इन यौगिकों का व्यापारिक मात्रा में निर्माण, गुण तथा उपयोग निम्नलिखित हैं –
- कैल्सियम ऑक्साइड या बिना बुझा चूना:
कैल्सियम ऑक्साइड को बिना बुझा चूना भी कहते हैं। CaO का वाणिज्यिक निर्माण घूर्णित भट्टी (Rotary Kiln) में चूने के पत्थर को गर्म करके किया जाता है। अभिक्रिया की तीव्रता को बनाये रखने के लिए CO2 को हटाते रहते हैं तथा उच्च ताप (1070 – 1270 K) को बनाये रखते हैं। अभिक्रिया निम्न प्रकार होती है
CaCO3 (underrightarrow { Delta } ) CaO + CO2↑ ΔH = + 179.9 kJK
यह अभिक्रिया उत्क्रमणीय होती है इस कारण CO2 को अभिक्रिया से शीघ्रातिशीघ्र हटाते रहते हैं जिससे अभिक्रिया अग्र दिशा में अग्रसर होती रहे। अभिक्रिया का ताप 1270K से अधिक नहीं होना चाहिये नहीं तो लाइम स्टोन में अशुद्धि के रूप में उपस्थित सिलिका CaO से क्रिया करके कैल्सियम सिलिकेट बना देता है।
CaO + SiO2 (underrightarrow { { >{ 1270 } } } ) 1270K CaSiO3
गुण:
1. यह श्वेत अक्रिस्टलीय ठोस है। इसका गलनांक 2870K
2. ऑक्सी – हाइड्रोजन ज्वाला में गर्म करने पर चमकीला सफेद प्रकाश उत्सर्जित होता है जिसे लाइम प्रकाश भी कहते हैं।
3. वायुमण्डल में खुला छोड़ने पर यह वायुमण्डल से नमी एवं कार्बनडाइ ऑक्साइड अवशोषित कर लेता है।
4. सामान्यतया, यह कठोर पिंडक (Lumps) के रूप में प्राप्त होता है। इसमें जल मिलाने पर चूने के पिंडक टूट जाते हैं। इस प्रक्रिया में बुझने की आवाज आती है और ऊष्मा उत्पन्न होती है, जो जल को वाष्प में बदल देती है। इस प्रक्रिया को ‘चूना बुझाने की प्रक्रिया’ (Slaking of lime) कहते हैं। इस क्रिया में जो पाउडर प्राप्त होता है उसे बुझा चूना (slaked lime) कहते हैं।
CaO + H2O → Ca(OH)2 ; ΔH = – 64.5 kJmol-1
5. बिना बुझा चूना जब कास्टिक सोडा के साथ बुझाया जाता है तो सोडालाइम (CaO + Na(OH) का निर्माण होता है।
6. CaO एक क्षारीय ऑक्साइड है इस कारण अम्ल और अम्लीय ऑक्साइड से उच्च ताप पर क्रिया कर लवण का निर्माण करता है।
CaO + 2HCl → CaCl2 + H2O
CaO + SiO2 (underrightarrow { Delta } ) CaSiO3
6CaO+P4O10 (underrightarrow { Delta } ) 2Ca3 (PO4)2
CaO+ SO2 → CaSO3
7. कैल्सियम ऑक्साइड अमोनियम लवणों के साथ गर्म करने पर NH3 प्रदान करता है।
CaO + 2NH4Cl → CaCl2 + 2NH3 + H2O
8. कोक के साथ विद्युत भट्टी में 2273 – 3273K तक गर्म करने पर कैल्सियम कार्बाइड का निर्माण होता है।
CaO + 3C (underrightarrow { { { 2273-3273{ K } } } } ) CaC2 + COउपयोग:
1. यह प्राथमिक पदार्थ के रूप में बहुत उपयोगी होता है एवं क्षारों से सस्ता होता है।
2. ऐल्कोहॉल तथा गैसों को सुखाने में।
3. सोडालाइम, कैल्सियम, सीमेन्ट, काँच, रंजक तथा विरंजक चूर्ण आदि के निर्माण में।
4. कास्टिक सोडा से सोडियम कार्बोनेट बनाने में।
5. धातुकर्म में गालक के रूप में।
6. भट्टियों में बेसिक अस्तर लगाने में।
7. शर्करा के शुद्धिकरण में।
8. मृदा की अम्लीयता दूर करने में। - कैल्सियम कार्बोनेट:
कैल्सियम कार्बोनेट प्रकृति में कई रूपों में पाया जाता है, जैसेचूना पत्थर (Lime Stone), खड़िया (Chalk) तथा संगमरमर (Marble) इत्यादि। कैल्सियम कार्बोनेट को चूने का पत्थर (lime stone) भी कहते हैं। यह प्रकृति में चॉक, संगमरमर, कैल्साइट के रूप में पाया जाता है। यह MgCO3 के साथ डोलोमाइट (CaCO3 + MgCO3) के रूप में मिलता है।
विरचन:
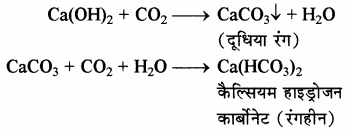
1. बुझे हुए चूने पर CO2 गैस प्रवाहित करने पर CaCO3 बनता है।
Ca(OH)2 + CO2 → CaCO3 + H2O
इस अभिक्रिया में कार्बन डाइऑक्साइड का आधिक्य नहीं होना चाहिए, क्योंकि इसकी अधिकता से जल विलेय, कैल्सियम हाइड्रोजन – कार्बोनेट Ca(HCO3)2 बन सकता है।
2. कैल्सियम के किसी लवण की सोडियम, पोटैशियम या अमोनियम कार्बोनेट के साथ क्रिया से भी CaCO3 प्राप्त होता है।
CaCl2 + Na2CO3 → CaCO3 + 2NaCl
Ca(NO)2 + K2CO3 → CaCO3 + 2KNO3
गुण:
1. कैल्सियम कार्बोनेट सफेद चूर्ण होता है, जिसे 1200 K तक गर्म करने पर यह विघटित हो जाता है।
2. यह जल में लगभग अविलेय होता है।
3. CO2 युक्त जल में विलेय होकर यह कैल्सियम हाइड्रोजन कार्बोनेट बनाता है।
CaCO3 + H2O + CO2 → Ca(HCO3)2
4. CaCO3 की तनु अम्लों के साथ क्रिया से CO2 गैस मुक्त होती है।
CaCO3 + 2HCl → CaCl + H2O + CO2
CaCO3 + H2SO4 → CaSO4 +H2O + CO2उपयोग:
CaCO3 के महत्त्वपूर्ण उपयोग निम्नलिखित
1. CaCO3 से पाउडर, टूथपेस्ट तथा चॉक का निर्माण किया जाता है।
2. इसे संगमरमर के रूप में भवन तथा मूर्ति निर्माण में प्रयुक्त किया जाता है।
3. यह सीमेन्ट, चूना, काँच आदि के निर्माण में भी प्रयुक्त होता है।
4. इसको मैग्नीशियम कार्बोनेट के साथ लोहे जैसी धातुओं के निष्कर्षण में गालक (Flux) के रूप में प्रयुक्त किया जाता है।
5. यह उच्च गुणवत्ता वाले कागज के निर्माण में भी प्रयुक्त होता है।
6. CaCO3 च्यूइंगम का एक घटक होता है।
7. यह सौन्दर्य प्रसाधनों में पूरक के रूप में प्रयुक्त होता है।
8. CaCO3 को प्रति अम्ल (Ant acid) के रूप में भी प्रयुक्त किया जाता है। - कैल्सियम हाइड्रॉक्साइड (बुझा चूना):
विरचन:
1. कैल्सियम हाइड्रॉक्साइड को CaO की जल से अभिक्रिया द्वारा बनाया जाता है। यह अभिक्रिया ऊष्माक्षेपी होती है। इसे बुझा हुआ चूना भी कहते हैं।
CaO + H2O + Ca(OH)2
2. CaCl2 की NaOH के साथ अभिक्रिया द्वारा भी इसे बनाया जा सकता है।
CaCl2 + 2NaOH → Ca(OH)2 + 2NaCl
गुणधर्म:
1. कैल्सियम हाइड्रॉक्साइड एक श्वेत चूर्ण है, जो कि जल में आंशिक रूप से विलेय है। इसे 673K तक गर्म करने पर यह CaO में बदल जाता है।
Ca(OH)2 (overrightarrow { Delta } ) CaO + H2O
2. Ca(OH)2 के जलीय निलम्बन (Suspension) को दूधिया चूना या चूने का दूध (Milk of Lime) कहते हैं, जिसका प्रयोग भवनों की सफेदी करने (White wash) में किया जाता है। चूने का जल में स्वच्छ विलयन, जिसमें चूने की मात्रा बहुत कम होती है, उसे चूने का पानी (Lime Water) कहते हैं।
3. CO2 से क्रिया:
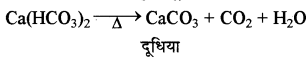
चूने के पानी में CO2 गैस प्रवाहित करने पर CaCO3 बनने के कारण यह दूधिया हो जाता है लेकिन इसमें अधिक मात्रा में CO2 गैस प्रवाहित करने पर विलेय कैल्सियम हाइड्रोजन कार्बोनेट बनने के कारण दूधियापन गायब हो जाता है।
इस विलयन को गर्म करने पर पुनः कैल्सियम कार्बोनेट बन जाता है जिससे विलयन पुनः दूधिया हो जाता है।
इस अभिक्रिया का उपयोग CO32- मूलक के परीक्षण में किया जाता है।
4. Cl2 से क्रिया:
ठण्डे चूने के पानी पर Cl2 की क्रिया से कैल्सियम हाइपोक्लोराइट बनता है जो कि विरंजक चूर्ण का एक अवयव है।
लेकिन शुष्क Ca(OH)2 पर क्लोरीन गैस प्रवाहित करने पर विरंजक चूर्ण (Bleaching Powder) बनता है तथा गरम चूने के पानी पर Cl2 की क्रिया से CaCl2 तथा कैल्सियम क्लोरेट बनते हैं।
Uses:
कैल्सियम हाइड्रॉक्साइड के मुख्य उपयोग निम्नलिखित हैं –
1. वृहद स्तर पर चूना लेप (Mortar) के रूप में भवन निर्माण में।
2. शर्करा के शोधन में।
3. दीवारों पर सफेदी करने में क्योंकि यह रोगाणुनाशी है।
4. काँच एवं विरंजक चूर्ण के निर्माण में।
5. चमड़े की टैनिंग में।
6. अम्लीय ऑक्साइडों के अवशोषण में। - कैल्सियम सल्फेट प्लास्टर ऑफ पेरिस:
परिचय:
कैल्सियम सल्फेट प्रकृति में दो रूपों में पाया जाता है –
अनार्दै (CasO4) तथा जलयोजित (CasO4.2H2O), जलयोजित अवस्था में इसे जिप्सम कहते हैं। इनके अतिरिक्त इसका एक रूप कैल्सियम सल्फेट अर्धहाइड्रेट (Hemihydrate) भी होता है। जिसे प्लास्टर ऑफ पेरिस कहते हैं।
बनाने की विधियाँ:
1. CaCl2 पर H2SO4 तथा Na2SO4 की क्रिया से CaSO4 बनता है।
CaCl + H2SO4 → CaSO4 + 2HCl
CaCl + Na2SO4 → CaSO4 + 2NaCl
2. CaSO4.2H2O को 393K पर गरम करने से प्लास्टर ऑफ पेरिस बनता है।
2(CaSO4.2H2O) (overrightarrow { Delta } ) (CasO4)2H2O + 3H2O
3. 393 K से उच्च ताप पर इसमें क्रिस्टलन जल नहीं बचता है तथा शुष्क कैल्सियम सल्फेट (CasO4) प्राप्त होता है, इसे ‘मृत तापित प्लास्टर’ (Dead Burnt Plaster) कहा जाता है। इसमें पानी मिलाने पर यह पुनः कठोर नहीं होता है।
4. पर्याप्त मात्रा में जल मिलाने पर यह एक प्लास्टिक जैसा द्रव्य बनाता है, जो 5 से 15 मिनट में जमकर कठोर तथा ठोस हो जाता है।
(CaSO4)2H2O + 3H2O → 2(CasO4.2H2O)
गुण:
जिप्सम, श्वेत क्रिस्टलीय ठोस पदार्थ है। यह जल में अल्प विलेय होता है। ताप बढ़ने के साथ – साथ इसकी जल में विलेयता बढ़ती है। यह तनु अम्लों में विलेय रहता है तथा द्विक लवण बनाता है। गर्म करने पर इसका विघटन हो जाता है।
CaSO4 (underrightarrow { 673{ K } } ) CaO + SO3
उपयोग:
1. जिप्सम को प्लास्टर आफ पेरिस, सीमेन्ट तथा अमोनियम सल्फेट बनाने में उपयोग में लिया जाता है।
2. प्लास्टर ऑफ पेरिस के उपयोग निम्नलिखित हैं –
• मूर्तियाँ तथा खिलौने बनाने में।
• दंत चिकित्सा में, दाँतों का सेट बनाने में।
• भवन निर्माण में सजावट कार्य में।
• टूटी हुई हड्डियों पर प्लास्टर चढ़ाने में। - सीमेन्ट:
सीमेन्ट एक महत्त्वपूर्ण भवन – निर्माण सामग्री है। इसका उपयोग सर्वप्रथम ब्रिटेन में 1824 में जोसेफ एस्पिडन ने किया था। इसे ‘पोर्टलैंड सीमेन्ट’ भी कहते हैं, क्योंकि यह ब्रिटेन के पोर्टलैंड टापू पर प्राप्त प्राकृतिक चूने के पत्थर के समान है।
सीमेन्ट का बनाना:
सीमेन्ट बनाने के लिए चूने के आधिक्य वाले पदार्थ, CaO को मिट्टी के साथ मिलाया जाता है। मिट्टी में SiO2, Al, Fe तथा Mg के ऑक्साइड उपस्थित होते हैं।
मानक दशा में पोर्टलैण्ड सीमेन्ट का संगठन निम्न प्रकार होता है –
CaO → 50 से 60%
MgO → 2 से 3%
SiO2 → 20 से 25%
SO3 → 1 से 2%
Al2O3 → 5 से 10%
Fe2O3 → 1 से 2%
एक अच्छी गुणवत्ता वाले सीमेन्ट में SiO2 तथा Al2O3 का अनुपात 2.5 से 4, CaO तथा अन्य ऑक्साइडों (SiO2,Al2O3 तथा Fe2O3) का अनुपात लगभग 2 होना चाहिए। सीमेन्ट के निर्माण में कच्चे माल के रूप में चूने के पत्थर (Limestone) तथा चिकनी मिट्टी का प्रयोग किया जाता है। जब इन्हें तेजी से गरम करते हैं तो ये संगलित होकर अभिक्रिया करते हैं तथा सीमेन्ट क्लिंकर बनता है। इस क्लिंकर में 2 – 3% (भारात्मक) जिप्सम (CaSO4.2H2O) मिलाकर सीमेन्ट बनाया जाता है। - इस प्रकार पोर्टलैंड सीमेन्ट के मुख्य घटक डाइकैल्सियम सिलिकेट (Ca2SiO4) 26%, ट्राइकैल्सियम सिलिकेट (Ca3SiO5) 51% तथा ट्राइकैल्सियम ऐलुमिनेट (Ca2Al2O6) 11% हैं।
सीमेन्ट का जमना – जल मिलाने पर सीमेन्ट जमकर कठोर हो जाता है। इसका कारण घटक पदार्थों के अणुओं का जलयोजन तथा पुनः व्यवस्थित होना है। सीमेन्ट के जमने की प्रक्रिया को धीमा करने के लिए। ही इसमें जिप्सम मिलाया जाता है ताकि यह पूरी तरह ठोस हो सके।
उपयोग:
लोहा तथा स्टील के पश्चात् सीमेन्ट ही एक ऐसा पदार्थ है, जो किसी देश की उपयोगी वस्तुओं की श्रेणी में रखा जा सकता है। सीमेन्ट का उपयोग कंक्रीट (Concrete), प्रबलित कंक्रीट (Reinforced Concrete), प्लास्टरिंग, पुल – निर्माण तथा – भवन निर्माण इत्यादि में किया जाता है।
प्रश्न 39.
क्षार धातुओं के रासायनिक गुणों का वर्णन कीजिए तथा इनमें Li की आयनन ऊर्जा सर्वाधिक है फिर भी यह प्रबलतम अपचायक है, क्यों?
उत्तर:
क्षार धातुओं के रासायनिक गुण:
क्षार धातुओं के बड़े परमाणु आकार तथा निम्न आयनन एन्थैल्पी के कारण ये अत्यधिक क्रियाशील होती हैं तथा वर्ग में ऊपर से नीचे जाने पर इनकी क्रियाशीलता बढ़ती है क्योंकि परमाणु आकार बढ़ता है, अतः आयनन एन्थैल्पी का मान कम होता जाता है। क्षार धातुओं की वायु तथा नमी के साथ उच्च क्रियाशीलता के कारण इन्हें कैरोसिन में रखा जाता है।
- वायु के साथ अभिक्रिया:
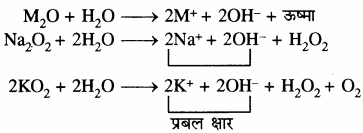
क्षार धातुएँ नम वायु में उपस्थित O2 तथा H2O से क्रिया करके ऑक्साइड तथा हाइड्रॉक्साइड बनाती हैं, जिनकी परत धातुओं पर जम जाती है। जिससे ये मलिन (Tarmish) हो जाती हैं। ये ऑक्सीजन से तेजी से क्रिया करके ऑक्साइड बनाती हैं। लीथियम और सोडियम क्रमशः मोनोऑक्साइड, Li2O (कुछ परॉक्साइड Li2O2) तथा परॉक्साइड, Na2O2 (कुछ सुपर ऑक्साइड) बनाती हैं, जबकि अन्य धातुएँ (K, Rb तथा Cs) सुपर ऑक्साइड बनाती हैं।
4Li + O2 → 2Li2O (लीथियम मोनोऑक्साइड)
2Na + O2 → Na2O2 (सोडियम परॉक्साइड)
M + O2 → MO2 (सुपर ऑक्साइड)
(M = K, Rb तथा Cs) सुपर ऑक्साइडों में अयुग्मित इलेक्ट्रॉन उपस्थित होता है अतः ये अनुचुम्बकीय तथा रंगीन होते हैं। Li+ आयन का आकार छोटा होने के कारण छोटे ऐनायन, एवं O2–, के साथ संयुक्त होकर स्थायी आयनिक आबंध बना लेता है जबकि K, Rb+ तथा Cs+ आयन का आकार बड़ा होने के कारण बड़े ऐनायन एवं O2–, के साथ सुपर ऑक्साइड बनाता है। इस प्रकार सभी क्षारीय धातुओं में सुपर ऑक्साइड बनाने की प्रवृत्ति धातु आयनों का आकार बढ़ने के साथ – साथ बढ़ती जाती है। इसे जालक ऊर्जा प्रभाव (Lattice energy effect) कहते हैं।
(i) धन विद्युती गुण बढ़ने के साथ – साथ ऑक्साइडों का क्षारीय गुण तथा तापीय स्थायित्व बढ़ता जाता है।
(ii) परऑक्साइडों में [- O – O -]2- आयन होता है इसी कारण ये प्रतिचुम्बकीय तथा प्रबल ऑक्सीकारक गुण प्रदर्शित करते हैं।
(iii) सुपर ऑक्साइडों में [O2–] आयन होता है, इसलिए ये अयुग्मित इलेक्ट्रॉन की उपस्थिति के कारण अनुचुम्बकीय तथा रंगीन (LiO2, NaO2– पीला, KO2– नारंगी, RbO2–भूरा तथा CsO2– नारंगी) होते हैं।
(iv) लीथियम वायु में उपस्थित नाइट्रोजन से अभिक्रिया करके आयनिक नाइट्राइड (Li3N) बनाता है।
इस प्रकार लीथियम का व्यवहार अन्य क्षार धातुओं से भिन्न है। Li3N को उच्च ताप पर गर्म करने पर यह अपने तत्त्वों में अपघटित हो। जाता है तथा जल अपघटन से अमोनिया एवं लीथियम हाइड्रॉक्साइड देता है।
Li3N + 3H2O → 3LiOH + NH3
क्षार धातुओं को वायु एवं जल के प्रति अति क्रियाशील होने के कारण सामान्यतया इन्हें कैरोसीन में रखा जाता है। - जल के साथ क्रियाशीलता:
क्षार धातुएँ जल एवं अन्य अम्लीय हाइड्रोजन परमाणु युक्त यौगिकों (एल्कोहल, गैसीय अमोनिया, ऐल्काइन आदि) के साथ क्रिया करके हाइड्रोजन गैस प्रदान करती हैं।
2Na + 2H2O → 2NaOH + H2
2Na + 2HX → 2NaX+ H2 (X = हैलोजन)
2Na + 2CH ≡ CH → 2NaC ≡ CH + H2
2M + 2H2O → 2M+ + 2OH– + H2
M = (Li, Na, K, Rb, Cs)
जैसे –
2Na + 2H2O → 2Na + OH– + H2
यद्यपि लीथियम के मानक इलेक्ट्रॉड विभव (E⊝) का मान उच्चतम ऋणात्मक होता है, लेकिन इसकी जल के साथ क्रिया सोडियम की तुलना में धीमी होती है, जबकि सोडियम के मानक इलेक्ट्रॉड विभव का मान अन्य क्षार धातुओं की अपेक्षा कम ऋणात्मक होता है। लीथियम के इस व्यवहार का कारण इसका छोय आकार तथा अधिक जलयोजन ऊर्जा का होना है। सोडियम तथा पोटैशियम की जल के साथ अभिक्रिया तेजी से होती है एवं Rb तथा Cs की अभिक्रिया तो इतनी तेज होती है कि विस्फोट होता है। - ऑक्साइडों की क्षारीय प्रकृति:
क्षार धातुओं के ऑक्साइड जल द्वारा अपघटित होने पर हाइड्राक्साइड देते हैं।
प्रबल क्षार इनके हाइड्रॉक्साइड प्रबल क्षार होते हैं। Na, K, Rb तथा Cs के हाइड्रॉक्साइड जल में अत्यधिक विलेयशील तथा माप के प्रति स्थायी होते हैं। जबकि लीथियम हाइड्रॉक्साइड जल में बहुत कम विलेय होते हैं एवं गर्म करने पर तीव्रता से अपघटित हो जाते हैं।
2LiOH → Li2O+ H2O
क्षार धातुओं के हाइड्रॉक्साइडों की क्षारीय प्रकृति वर्ग में ऊपर से नीचे जाने पर बढ़ती जाती है, क्योंकि आयनन ऊर्जाओं में कमी के कारण क्षार धातु तथा हाइड्रॉक्साइड आयन के मध्य आबंध कमजोर हो जाता है। जिससे विलयन में OH– आयन सान्द्रता बढ़ जाती है। - डाई हाइड्रोजन से क्रियाशीलता:
क्षार धातुएँ लगभग 673K ताप पर हाइड्रोजन के साथ क्रिया करके हाइड्राइड बनाती हैं। लेकिन लीथियम की क्रियाशीलता कम होने के कारण इसके लिए 1073K ताप की आवश्यकता होती है।
2M+ H2 → 2M+H–
M = Li, Na, K
ये हाइड्राइड ठोस, आयनिक तथा प्रबल अपचायक होते हैं। इनके गलनांक भी उच्च होते हैं। इन हाइड्राइडों के तापीय स्थायित्व का क्रम निम्न प्रकार होता है
LiH > NaH > KH > RbH > CsH - हैलोजन के साथ अभिक्रिया:
क्षार धातुएँ हैलोजनों के साथ तेजी से अभिक्रिया करके हैलाइड बनाती हैं जो कि आयनिक होते हैं। लेकिन लीथियम हैलाइड में आंशिक सहसंयोजी लक्षण होता है।
2M + X2 → 2M+X–
लीथियम हैलाइड में सहसंयोजी लक्षण होने का कारण लीथियम की उच्च ध्रुवण क्षमता है क्योंकि Li+ के छोटे आकार के कारण इसकी ध्रुवण क्षमता अधिक होती है। लीथियम के हैलाइडों में LiI का सहसंयोजक गुण सर्वाधिक होता है क्योंकि I– के बड़े आकार के कारण यह आसानी से ध्रुवित हो जाता है।
क्षार धातु हैलाइडों में सहसंयोजक गुण निम्न प्रकार से है –
LiCl > NaCl > KCI > RbCl > CsCl
Lil > LiBr > LiCl > LiF
क्षार धातु हैलाइड उच्च गलनांक व क्वथनांक (उच्च जालक ऊर्जा के कारण) वाले रंगहीन, क्रिस्टलीय ठोस पदार्थ हैं। इन हैलाइडों को ऑक्साइड, हाइड्रॉक्साइड या कार्बोनेट की HX के साथ अभिक्रिया करके बनाया जाता है। इस प्रकार प्राप्त हैलाइडों की संभवन एन्थैल्पी उच्च ऋणात्मक होती है। क्षार धातुओं के फ्लुओराइडों की संभवन ऊर्जा ΔHf0 का मान वर्ग के रूप में नीचे की ओर बढ़ने पर कम ऋणात्मक होता जाता है। अतः क्षार धातु फ्लुओराइड सबसे अधिक स्थायित्व को प्रदर्शित करते हैं।
फ्लुओराइड की संभवन ऊर्जा के ऋणात्मक मान Li से Cs तक जाने पर कम होते जाते हैं। अतः इनके स्थायित्व का क्रम निम्न प्रकार से होता है
LiF > NaF > KF > RbF > CsF
सभी क्षार धातु हैलाइड जल में विलयशील होते हैं। जल में LiF की निम्न विलेयता इसकी उच्च जालक ऊर्जा के कारण तथा CSI की निम्न विलेयता Cs+ तथा I– की निम्न जलयोजन ऊर्जा के कारण होती है। लीथियम के अन्य हैलाइड एथेनॉल, ऐसीटोन तथा एथिल ऐसीटेट में विलेय होते हैं। - द्रव अमोनिया में विलेयता:
क्षार धातुएँ द्रव NH3 में विलेय होती हैं, तथा इस विलयन का रंग गहरा नीला होता है। यह विलयन विद्युत का सुचालक होता है, जिसका कारण मुक्त इलेक्ट्रॉन है। क्षार धातुओं की द्रव NH3 में विलेयता का कारण आयनों तथा इलेक्ट्रॉनों का विलायकन है।
M + (x + y)NH3 → [M(NH3)x]+ + [e(NH3)y]–
इस विलयन का नीला रंग अमोनीकृत इलेक्ट्रॉनों के कारण होता है। ये इलेक्ट्रॉन प्रकाश के दृश्य क्षेत्र की ऊर्जा का अवशोषण करके विलयन को नीला रंग प्रदान करते हैं। यह विलयन अनुचुम्बकीय प्रकृति का होता है क्योंकि इसमें स्वतन्त्र (अमोनीकृत) इलेक्ट्रॉन उपस्थित होते हैं। इस विलयन को कुछ समय तक पड़े रहने पर ऐमाइड बनते हैं तथा हाइड्रोजन गैस मुक्त होती है।
(यहाँ ‘am’ अमोनीकृत विलयन को दर्शाता है।)
क्षार धातुओं के अमोनिया में विलयन की सान्द्रता बढ़ाने पर नीला रंग, ब्रॉन्ज रंग में परिवर्तित हो जाता है तथा विलयन अनुचुम्बकीय से प्रतिचुम्बकीय हो जाता है। - ऑक्सो – अम्लों के लवण:
वे अम्ल जिनमें अम्लीय प्रोटोन से युक्त हाइड्रॉक्सिल समूह (OH) तथा ऑक्सो समूह (= O) एक ही परमाणु से जुड़े होते हैं, उन्हें ऑक्सो अम्ल कहते हैं, जैसे – कार्बोनिक अम्ल H2CO3 [OC(OH)2], सल्फ्यूरिक अम्ल H2SO4 [O2S(OH)2] इत्यादि।
क्षार धातुएँ सभी ऑक्सो अम्लों के साथ लवण बनाती हैं। ये सामान्यतः जल में विलेय होते हैं तथा ताप के प्रति स्थायी होते हैं। इनके कार्बोनेट (M2CO3) तथा हाइड्रोजन कार्बोनेटों (MHCO3) का तापीय स्थायित्व अधिक होता है एवं वर्ग में ऊपर से नीचे जाने पर स्थायित्व बढ़ता है। लेकिन ठोस LiHCO3 का अस्तित्व नहीं होता है। - धातु कार्बोनेटों को स्थायित्व तथा विलेयता:
क्षार धातु कार्बोनेट उच्च ताप पर भी स्थायी होते हैं लेकिन लीथियम कार्बोनेट का स्थायित्व अपेक्षाकृत कम होता है क्योंकि Li+ के छोटे आकार के कारण यह बड़े ऋणायन CO32- का ध्रुवण कर देता है। अतः इसको गर्म करने पर यह अपघटित होकर ऑक्साइड देता है।
Li2CO3 (overrightarrow { Delta } ) Li2O + CO2
वर्ग में ऊपर से नीचे जाने पर कार्बोनेटों का स्थायित्व बढ़ता है, जिसका कारण धातु आयन के आयनिक विभव का कम होना है।
वर्ग में धनायन की त्रिज्या बढ़ती है जिससे आयनिक विभव का मान कम होता है। अतः धातु आयन की कार्बोनेट आयन में से ऑक्साइड आयन को आकर्षित करने की क्षमता कम हो जाती है अर्थात् CO32- का ध्रुवण नहीं हो पाता है इसलिए धातु कार्बोनेट का विघटन नहीं होता है। प्रथम समूह के तत्त्वों के कार्बोनेट जल में विलेय होते हैं (Li2CO3 के अलावा) तथा वर्ग में विलेयता बढ़ती है। - नाइट्रेटों को स्थायित्व तथा विलेयता:
क्षार धातु नाइट्रेटों को गर्म करने पर ये नाइट्राइट तथा ऑक्सीजन देते हैं।
2NaNO3 (overrightarrow { Delta } ) 2NaNO2 + O2
2KNO3 (underrightarrow { Delta } ) 2KNO2 + O2
लेकिन लीथियम नाइट्रेट को गरम करने पर यह Li2O देता है।
4LiNO3 → 2Li2O + 4NO2 + O2
क्षार धातु नाइट्रेट जल में विलेय होते हैं तथा वर्ग में नीचे जाने पर विलेयता बढ़ती है। - सल्फेटों को स्थायित्व तथा विलेयता:
क्षार धातुओं के सल्फेट स्थायी होते हैं। तथा ये जल में विलेय होते हैं। वर्ग में ऊपर से नीचे जाने पर सल्फेटों की विलेयता बढ़ती है।
क्षार धातुओं के यौगिकों के सामान्य अभिलक्षण –
क्षार धातुओं के अधिकांश यौगिक आयनिक होते हैं। इनमें से कुछ मुख्य यौगिकों के सामान्य अभिलक्षण निम्नलिखित हैं –
ऑक्साइड एवं हाइड्रॉक्साइड:
क्षार धातुओं का वायु के आधिक्य के साथ दहन करने पर Li, मुख्य रूप से मोनोऑक्साइड, Li2O (कुछ परॉक्साइड), Na, परॉक्साइड Na2O2 (कुछ सुपर ऑक्साइड) बनाते हैं जबकि K, Rb तथा Cs सुपर ऑक्साइड (MO2) बनाते हैं। विभिन्न प्रकार के ऑक्साइडों के स्थायित्व का क्रम निम्न प्रकार होता है –
सामान्य ऑक्साइड > परॉक्साइड > सुपर ऑक्साइड
शुद्ध अवस्था में सामान्य ऑक्साइड तथा परॉक्साइड रंगहीन श्वेत क्रिस्टलीय ठोस होते हैं लेकिन सुपर ऑक्साइड पीले या नारंगी होते हैं। सुपर ऑक्साइडों में अयुग्मित इलेक्ट्रॉन उपस्थित होने के कारण ये अनुचुम्बकीय होते हैं तथा Na2O2 (सोडियम परॉक्साइड) ऑक्सीकारक होता है। प्रथम वर्ग की सभी धातुओं के ऑक्साइड क्षारीय होते हैं तथा वर्ग में ऊपर से नीचे जाने पर इनका क्षारीय गुण बढ़ता है क्योंकि M – O बन्ध की आयनिक प्रकृति बढ़ने के कारण M+ तथा O2- आसानी से बनते हैं जिससे इनकी OH– देने की प्रवृत्ति बढ़ती है।
ऑक्साइडों की जल से अभिक्रिया:
सभी प्रकार के क्षार धातु ऑक्साइड जल से अभिक्रिया करके हाइड्रॉक्साइड बनाते हैं।
सामान्य ऑक्साइड –
M2O + H2O → 2M+ + 2OH–
परॉक्साइड –
M2O2 + 2H2O → 2M+ + 2OH– + H2O
सुपर ऑक्साइड
2MO2 + 2H2O → 2M+ + 2OH– + H2O2 + O2
ये हाइड्रॉक्साइड धातुओं की जल के साथ अभिक्रिया द्वारा भी बनते हैं। क्षार धातुओं के हाइड्रॉक्साइड प्रबल क्षार होते हैं तथा ये जले में आसानी से घुल जाते हैं जिसका कारण तीव्र जलयोजन है। इस प्रक्रम में ऊष्मा उत्सर्जित होती है तथा वर्ग में हाइड्रॉक्साइडों की विलेयता बढ़ती है। ऑक्साइडों के समान क्षार धातु हाइड्रॉक्साइडों का क्षारीय गुण भी वर्ग में ऊपर से नीचे जाने पर बढ़ता है क्योंकि धातु की आयनन एन्थैल्पी का मान कम होने से OH आयन बनाने की प्रवृत्ति बढ़ती है।
अतः इन हाइड्रॉक्साइडों के क्षारीय गुण का क्रम निम्न प्रकार होता है –
LiOH < NaOH < KOH < RbOH < CsOH
हाइड्रॉक्साइडों का तापीय स्थायित्व भी वर्ग में बढ़ता है।
हैलाइड (Halides):
क्षार धातुएँ, हैलोजनों के साथ क्रिया करके MX प्रकार के हैलाइड बनाती हैं।
2M + X2 → 2M+X–
इन हैलाइडों को उपयुक्त ऑक्साइड, हाइड्रॉक्साइड या कार्बोनेट की हाइड्रोहेलिक अम्ल (HX) के साथ अभिक्रिया द्वारा भी बनाया जा सकता है। सभी हैलाइडों की संभवन एन्थैल्पी (ΔfH⊝) का मान उच्च ऋणात्मक होता है। क्षार धातुओं के फ्लुओराइडों की संभवन एन्थैल्पी का मान वर्ग में ऊपर से नीचे जाने पर कम ऋणात्मक होता जाता है, जबकि अन्य हैलाइडों के लिए इसका विपरीत होता है। लेकिन किसी धातु के लिए संभवन एन्थैल्पी का मान फ्लुओराइड से आयोडाइड तक कम ऋणात्मक होता जाता है।
ये हैलाइड उच्च गलनांक युक्त रंगहीन, क्रिस्टलीय ठोस होते हैं। तथा सामान्यतः ये आयनिक होते हैं लेकिन धनायन का आकार कम होने तथा ऋणायन का आकार बढ़ने पर इनमें सहसंयोजी गुण आता है। इन हैलाइडों के गलनांक तथा क्वथनांक का सामान्य क्रम निम्न प्रकार होता है –
MF > MCI > MBr > MI
क्षार धातुओं के सभी हैलाइड जल में विलेय होते हैं लेकिन LiF की जल में विलेयता कम होती है, क्योंकि इसकी जालक ऊर्जा उच्च होती है। इसी प्रकार CsI की जल में विलेयता भी कम होती है क्योंकि Cs+ तथा I– के बड़े आकार के कारण जलयोजन ऊर्जा का मान कम होता है। लीथियम के अन्य हैलाइड कार्बनिक विलायकों जैसे एथेनॉल, ऐसीटोन तथा एथिल ऐसीटेट में विलेय होते हैं क्योंकि ये सहसंयोजक होते हैं। अतः क्षार धातु हैलाइडों की जल में विलेयता का क्रम निम्न प्रकार होता है –
LiF < LICI < LiBr < Lil
LiF < NaF < KF < RbF < CsF
LiCl, जल से क्रिया करके (जल अपघटन) LiOH तथा HCl देता है जबकि अन्य क्षार धातु हैलाइडों का जल अपघटन कम होता है।
LiCl + H2O → LiOH + HCl
प्रश्न 40.
वर्ग I के निम्नलिखित यौगिकों की तुलना वर्ग II के संगत यौगिकों में विलेयता एवं तापीय स्थायित्व के आधार पर कीजिए –
- नाइट्रेट
- सल्फेट
- कार्बोनेट।
उत्तर:
- नाइट्रेट:
क्षार धातु नाइट्रेटों को गर्म करने पर ये नाइट्राइट तथा ऑक्सीजन देते हैं।
2NaNO3 (overrightarrow { Delta } ) 2NaNO2+ O2
2KNO3 (underrightarrow { Delta } ) 2KNO2 + O2
लेकिन लीथियम नाइट्रेट को गरम करने पर यह Li2O देता है।
4LiNO3 → 2Li2O + 4NO2 + O2
क्षार धातु नाइट्रेट जल में विलेय होते हैं तथा वर्ग में नीचे जाने पर विलेयता बढ़ती है।- सल्फेट:
क्षार धातुओं के सल्फेट स्थायी होते हैं। तथा ये जल में विलेय होते हैं। वर्ग में ऊपर से नीचे जाने पर सल्फेटों की विलेयता बढ़ती है।
क्षार धातुओं के यौगिकों के सामान्य अभिलक्षण –
क्षार धातुओं के अधिकांश यौगिक आयनिक होते हैं। इनमें से कुछ मुख्य यौगिकों के सामान्य अभिलक्षण निम्नलिखित हैं –
ऑक्साइड एवं हाइड्रॉक्साइड:
क्षार धातुओं का वायु के आधिक्य के साथ दहन करने पर Li, मुख्य रूप से मोनोऑक्साइड, Li2O (कुछ परॉक्साइड), Na, परॉक्साइड Na2O2 (कुछ सुपर ऑक्साइड) बनाते हैं जबकि K, Rb तथा Cs सुपर ऑक्साइड (MO2) बनाते हैं। विभिन्न प्रकार के ऑक्साइडों के स्थायित्व का क्रम निम्न प्रकार होता है –
सामान्य ऑक्साइड > परॉक्साइड > सुपर ऑक्साइड
शुद्ध अवस्था में सामान्य ऑक्साइड तथा परॉक्साइड रंगहीन श्वेत क्रिस्टलीय ठोस होते हैं लेकिन सुपर ऑक्साइड पीले या नारंगी होते हैं। सुपर ऑक्साइडों में अयुग्मित इलेक्ट्रॉन उपस्थित होने के कारण ये अनुचुम्बकीय होते हैं तथा Na2O2 (सोडियम परॉक्साइड) ऑक्सीकारक होता है। प्रथम वर्ग की सभी धातुओं के ऑक्साइड क्षारीय होते हैं तथा वर्ग में ऊपर से नीचे जाने पर इनका क्षारीय गुण बढ़ता है क्योंकि M – O बन्ध की आयनिक प्रकृति बढ़ने के कारण M+ तथा O2- आसानी से बनते हैं जिससे इनकी OH– देने की प्रवृत्ति बढ़ती है।
ऑक्साइडों की जल से अभिक्रिया:
सभी प्रकार के क्षार धातु ऑक्साइड जल से अभिक्रिया करके हाइड्रॉक्साइड बनाते हैं।
सामान्य ऑक्साइड –
M2O + H2O → 2M+ + 2OH–
परॉक्साइड –
M2O2 + 2H2O → 2M+ + 2OH– + H2O
सुपर ऑक्साइड
2MO2 + 2H2O → 2M+ + 2OH– + H2O2 + O2
ये हाइड्रॉक्साइड धातुओं की जल के साथ अभिक्रिया द्वारा भी बनते हैं। क्षार धातुओं के हाइड्रॉक्साइड प्रबल क्षार होते हैं तथा ये जले में आसानी से घुल जाते हैं जिसका कारण तीव्र जलयोजन है। इस प्रक्रम में ऊष्मा उत्सर्जित होती है तथा वर्ग में हाइड्रॉक्साइडों की विलेयता बढ़ती है। ऑक्साइडों के समान क्षार धातु हाइड्रॉक्साइडों का क्षारीय गुण भी वर्ग में ऊपर से नीचे जाने पर बढ़ता है क्योंकि धातु की आयनन एन्थैल्पी का मान कम होने से OH आयन बनाने की प्रवृत्ति बढ़ती है।
अतः इन हाइड्रॉक्साइडों के क्षारीय गुण का क्रम निम्न प्रकार होता है –
LiOH < NaOH < KOH < RbOH < CsOH
हाइड्रॉक्साइडों का तापीय स्थायित्व भी वर्ग में बढ़ता है।
हैलाइड (Halides):
क्षार धातुएँ, हैलोजनों के साथ क्रिया करके MX प्रकार के हैलाइड बनाती हैं।
2M + X2 → 2M+X–
इन हैलाइडों को उपयुक्त ऑक्साइड, हाइड्रॉक्साइड या कार्बोनेट की हाइड्रोहेलिक अम्ल (HX) के साथ अभिक्रिया द्वारा भी बनाया जा सकता है। सभी हैलाइडों की संभवन एन्थैल्पी (ΔfH⊝) का मान उच्च ऋणात्मक होता है। क्षार धातुओं के फ्लुओराइडों की संभवन एन्थैल्पी का मान वर्ग में ऊपर से नीचे जाने पर कम ऋणात्मक होता जाता है, जबकि अन्य हैलाइडों के लिए इसका विपरीत होता है। लेकिन किसी धातु के लिए संभवन एन्थैल्पी का मान फ्लुओराइड से आयोडाइड तक कम ऋणात्मक होता जाता है।
ये हैलाइड उच्च गलनांक युक्त रंगहीन, क्रिस्टलीय ठोस होते हैं। तथा सामान्यतः ये आयनिक होते हैं लेकिन धनायन का आकार कम होने तथा ऋणायन का आकार बढ़ने पर इनमें सहसंयोजी गुण आता है। इन हैलाइडों के गलनांक तथा क्वथनांक का सामान्य क्रम निम्न प्रकार होता है –
MF > MCI > MBr > MI
क्षार धातुओं के सभी हैलाइड जल में विलेय होते हैं लेकिन LiF की जल में विलेयता कम होती है, क्योंकि इसकी जालक ऊर्जा उच्च होती है। इसी प्रकार CsI की जल में विलेयता भी कम होती है क्योंकि Cs+ तथा I– के बड़े आकार के कारण जलयोजन ऊर्जा का मान कम होता है। लीथियम के अन्य हैलाइड कार्बनिक विलायकों जैसे एथेनॉल, ऐसीटोन तथा एथिल ऐसीटेट में विलेय होते हैं क्योंकि ये सहसंयोजक होते हैं। अतः क्षार धातु हैलाइडों की जल में विलेयता का क्रम निम्न प्रकार होता है –
LiF < LICI < LiBr < Lil
LiF < NaF < KF < RbF < CsF
LiCl, जल से क्रिया करके (जल अपघटन) LiOH तथा HCl देता है जबकि अन्य क्षार धातु हैलाइडों का जल अपघटन कम होता है।
LiCl + H2O → LiOH + HCl
- सल्फेट:
- कार्बोनेट:
क्षार धातु कार्बोनेट उच्च ताप पर भी स्थायी होते हैं लेकिन लीथियम कार्बोनेट का स्थायित्व अपेक्षाकृत कम होता है क्योंकि Li+ के छोटे आकार के कारण यह बड़े ऋणायन CO32- का ध्रुवण कर देता है। अतः इसको गर्म करने पर यह अपघटित होकर ऑक्साइड देता है।
Li2CO3 (overrightarrow { Delta } ) Li2O + CO2
वर्ग में ऊपर से नीचे जाने पर कार्बोनेटों का स्थायित्व बढ़ता है, जिसका कारण धातु आयन के आयनिक विभव का कम होना है।
वर्ग में धनायन की त्रिज्या बढ़ती है जिससे आयनिक विभव का मान कम होता है। अतः धातु आयन की कार्बोनेट आयन में से ऑक्साइड आयन को आकर्षित करने की क्षमता कम हो जाती है अर्थात् CO32- का ध्रुवण नहीं हो पाता है इसलिए धातु कार्बोनेट का विघटन नहीं होता है। प्रथम समूह के तत्त्वों के कार्बोनेट जल में विलेय होते हैं (Li2CO3 के अलावा) तथा वर्ग में विलेयता बढ़ती है।
All Chapter RBSE Solutions For Class 11 Chemistry Hindi Medium
—————————————————————————–
All Subject RBSE Solutions For Class 11 Hindi Medium
*************************************************
————————————————————
All Chapter RBSE Solutions For Class 11 Chemistry Hindi Medium
All Subject RBSE Solutions For Class 11 Hindi Medium
Remark:
हम उम्मीद रखते है कि यह RBSE Class 11 chemistry Solutions in Hindi आपकी स्टडी में उपयोगी साबित हुए होंगे | अगर आप लोगो को इससे रिलेटेड कोई भी किसी भी प्रकार का डॉउट हो तो कमेंट बॉक्स में कमेंट करके पूंछ सकते है |
यदि इन solutions से आपको हेल्प मिली हो तो आप इन्हे अपने Classmates & Friends के साथ शेयर कर सकते है और HindiLearning.in को सोशल मीडिया में शेयर कर सकते है, जिससे हमारा मोटिवेशन बढ़ेगा और हम आप लोगो के लिए ऐसे ही और मैटेरियल अपलोड कर पाएंगे |
आपके भविष्य के लिए शुभकामनाएं!!