हेलो स्टूडेंट्स, आज हम इस लेख में विधुत अपघटन क्या है | परिभाषा | क्रियाविधि | उपयोग के बारे में पढ़ेंगे |
Table of Contents
विधुत अपघटन क्या है – vidyut apghatan kya hai:
जब किसी विद्युत अपघट्य के विलायक में विद्युत धारा प्रवाहित करते है तो इलेक्ट्रोड पर पदार्थ इक्कठे (निक्षेपित) हो जाते है इसे विधुत अपघटन कहते हैं।
अथवा
किसी तरल पदार्थ में से करंट को परवाह किया जाए तो रसायनिक अभिक्रिया के कारण उस तरल पदार्थ के (Ions ) तत्व उससे अलग हो जाते हैं.इस प्रक्रिया को विद्युत अपघटन (इलेक्ट्रोलिसिस) कहते हैं |
उदाहरण:
जल में विद्युत धारा प्रवाहित करने पर जल, हाइड्रोजन एवं ऑक्सीजन में विघटित हो जाता है, जिसे ‘जल का विद्युत अपघटन’ कहते हैं।
संबंधित परिभाषाएं:
इलेक्ट्रोलाइट क्या होता है :
इलेक्ट्रोलाइट है तरल होता है जिसमें विद्युत प्रवाहित होने पर रासायनिक अभिक्रिया होती है और वह दल चालक अपने पोयम्स में विभाजित हो जाता है जैसे कि सिल्वर नाइट्रेट, नमक मिला पानी, H2So4, Nacl इत्यादि.
इलेक्ट्रोड क्या होता है :
धातु की प्लेट टर्मिनल या कोई रोड जिसके द्वारा करंट इलेक्ट्रोलाइट में से प्रवाह होता है उसे इलेक्ट्रोड कहते हैं यह दो प्रकार के होते हैं. एनोड और कैथोड.
एनोड क्या होता है :
जिस टर्मिनल या इलेक्ट्रोड पर बैटरी का पॉजिटिव टर्मिनल जोड़ा जाता है और इस टर्मिनल से करंट इलेक्ट्रोलाइट के अंदर जाता है वह टर्मिनल एनोड कहलाता है एनोड से ही आयन अलग होकर निकलते हैं.
कैथोड क्या होता है :
जिस टर्मिनल या इलेक्ट्रोड पर बैटरी का नेगेटिव टर्मिनल जोड़ा जाता है और तरल से विभाजित होकर आयन इसी टर्मिनल पर आते हैं यह टर्मिनल कैथोड होता है.
संयोजकता क्या होता है :
किसी भी परमाणु की वह ताकत है जो कि हाइड्रोजन परमाणु की ताकत से रासायनिक क्रिया करें वह उस तत्वों की संयोजकता कहलाती है .
विधुत अपघटन की क्रियाविधि:
एक पात्र में संगलित (पिघला) नमक लेकर उसमे दो Pt के इलेक्ट्रोड डुबो देते है। दोनों इलेक्ट्रोडो को तारो की सहायता से बैटरी से जोड़ देते है। बैटरी के धन सिरे से जिस छड़ को जोड़ते है वह धनावेशित होती है उसे ऐनोड कहते है , बैटरी के ऋण सिरे से जिस सिरे को जोड़ते है वह ऋणावेशित होती है उसे कैथोड कहते हैं।
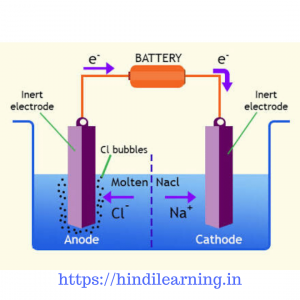
NaCl ⇆ Na+ + Cl–
Cathode reaction Na+ + e– → Na
Anode reaction Cl– → ½ Cl2 + e–
विधुत अपघटन के उपयोग:
विद्युत अपघटन के बहुत-से उपयोग हैं। अयस्कों को प्रसंस्कारित करके उनमें निहित रासायनिक तत्त्व को शुद्ध करना एवं उसे अलग करना इसका सबसे महत्त्वपूर्ण औद्योगिक एवं व्यावसायिक उपयोग है।
आवश्यक अवयव:
- विद्युत अपघट्य – किसी द्रव में स्थित चलायमान आयन
- दिष्ट धारा का स्रोत
- दो ठोस प्लेटें या छड़े, जिन्हें एलेक्ट्रोड कहते हैं।
उपरोक्त अवयवों की भूमिका इस प्रकार है:
- चलायमान आयन विद्युत धारा के प्रवाह के लिये ‘वाहक’ का काम करते हैं। यदि आयन चलायमान न हों (जैसे किसी ठोस में) तो विद्युत अपघटन सम्भव नहीं होगा।
- बाहर से विद्युत धारा प्रवाहित करने से आयन बनने या ‘डिस्चार्ज’ होने के लिये आवश्यक ऊर्जा प्राप्त होती है।
- दो विद्युताग्र – बाहरी विद्युत परिपथ एवं आयनिक विलयन को विद्युतीय दृष्टि से जोडने का काम करते हैं।
- विद्युताग्र, विद्युत के चालक होने चाहिये। धातु, ग्रेफाइट और अर्धचालक पदार्थों के एलेक्ट्रोड बहुता प्रयोग में लाये जाते हैं। एलेक्ट्रोड के पदार्थ का चुनाव दो बातों से प्रभावित होता है- एलेक्ट्रोड और एलेक्ट्रोलाइट के बीच कोई क्रिया नहीं होनी चाहिये तथा एलेक्ट्रोड के निर्माण का व्यय कम होना चाहिये।










